
第七章氧化还原滴定法 (Oxidation-Reduction Titration) 7.1氧化还原平衡 7.2氧化还原滴定原理 7.3氧化还原滴定的预处理 7.4常用的氧化还原滴定法 7.5氧化还原滴定结果的计算
1 7.1 氧化还原平衡 7.2 氧化还原滴定原理 7.3 氧化还原滴定的预处理 7.4 常用的氧化还原滴定法 7.5 氧化还原滴定结果的计算 第七章 氧化还原滴定法 (Oxidation-Reduction Titration)

71 氧化还原平衡 711 概述 氧化剂或还原剂的氧化或还原能力的强弱可以用有关电对的 电极电势来表示。 氧化还原电对 电对半反应 电极电势 例 01/R O+ne=R E Ce4++e-=Ce3+ E8=1.61V 02/R2 O,+nze=R2 E2 Fe3++e-=Fe2+ E=0.777v 如果, E1>E2,有氧化还原反应 nO1+nR2=nR+n02 Ce++Fe2+=Ce3++Fe3+ Analytical Chemistry 2
Analytical Chemistry 2 O1 R1 电对半反应 电极电势 O1 1 R1 n e E1 O2 2 R2 n e E2 如果, E1 > E2 ,有氧化还原反应 n2O1 n1R2 n2R1 n1O2 3 2 Fe e Fe 例 0.777v E 4 3 Ce e Ce 1.61v E 4 2 3 3 Ce Fe Ce Fe 氧化还原电对 O2 R2 氧化还原平衡 概 述

氧化还原反应实质:得失电子,电子转移(氧化 剂得到电子被还原,还原剂失去电子被氧化) 氧化还原电对 对称电对:氧化态和还原态的系数相同 如:Fe3++e=Fe2+ MnO+8H++5e Mn2+4H,O 不对称电对:氧化态与还原态系数不同 如:2+2e=21 Cr2022-+14H++6e=2Cr3++7H20 少东理2大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 3
Analytical Chemistry 3 氧化还原电对 对称电对:氧化态和还原态的系数相同 如: Fe 3+ + e = Fe 2+ MnO4 - + 8H+ + 5e = Mn2+ + 4H2O 不对称电对:氧化态与还原态系数不同 如: I2 + 2e = 2 I - Cr2O7 2- + 14H+ + 6e = 2Cr 3+ + 7H2O 氧化还原反应实质:得失电子, 电子转移(氧化 剂得到电子被还原,还原剂失去电子被氧化)
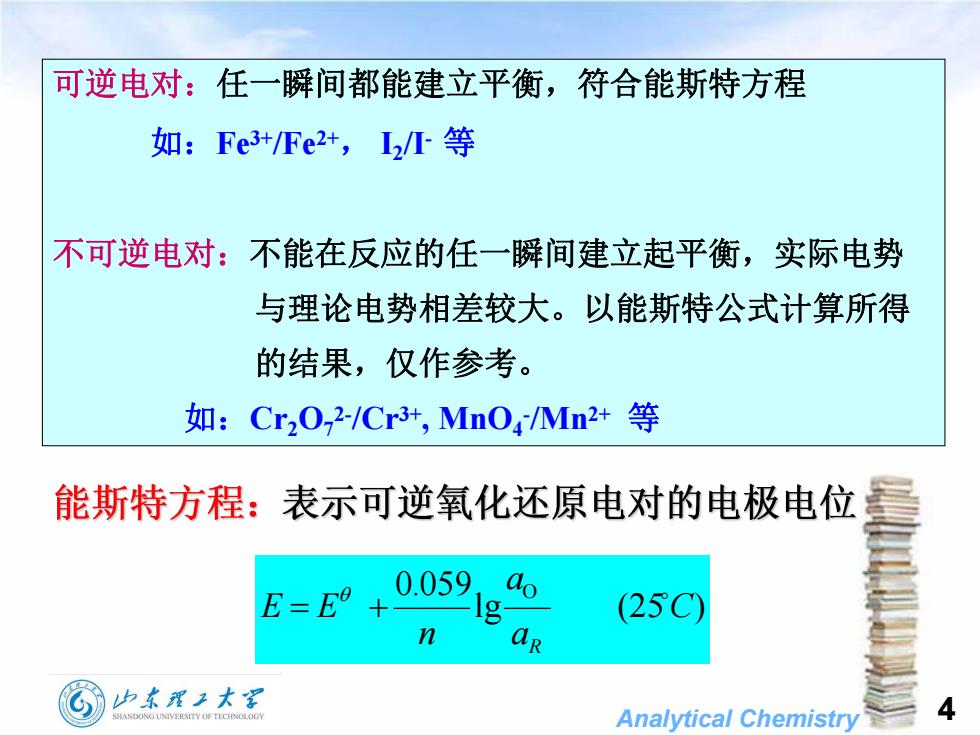
可逆电对:任一瞬间都能建立平衡,符合能斯特方程 如:Fe3+/Fe2+,I2I等 不可逆电对:不能在反应的任一瞬间建立起平衡,实际电势 与理论电势相差较大。以能斯特公式计算所得 的结果,仅作参考。 如:Cr20,2/Cr3+,Mn04Mn2+等 能斯特方程:表示可逆氧化还原电对的电极电位 E=E9+ 0.059 (25C) n aR 归东程子大军 HANDONG UNIVERS1 Y OF TE口HNOL.O月 Analytical Chemistry
Analytical Chemistry 4 可逆电对:任一瞬间都能建立平衡,符合能斯特方程 如:Fe 3+/Fe 2+ , I2 /I - 等 不可逆电对:不能在反应的任一瞬间建立起平衡,实际电势 与理论电势相差较大。以能斯特公式计算所得 的结果,仅作参考。 如:Cr2O7 2-/Cr 3+ , MnO4 -/Mn2+ 等 lg (25 ) 0.059 O C a a n E E R

注意: ()n:电对的电子转移数 (2)E:标准电极电位,温度的函数,t=25℃时, ao==1mol/L时的电极电位,E9可查表(p398表15)。 >高,其氧化型的氧化能力强,可氧化电位比它低的还原剂。 >低,其还原型的还原能力强,可还原电位比它高的氧化剂。 >E随H而改变,随ao和而变化。 25℃,r=1,忽略离子间相互作用 E=E 0.059,[0 (25C) n 山东露王大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 5
Analytical Chemistry 5 (1) n:电对的电子转移数 ( 2 ) Eθ: 标 准 电极电 位 , 温 度 的函数 , t = 2 5℃时 , aO=aR=1mol/L时的电极电位, Eθ可查表(p398 表15)。 ØEθ 高,其氧化型的氧化能力强,可氧化电位比它低的还原剂。 ØEθ 低,其还原型的还原能力强,可还原电位比它高的氧化剂。 25℃,r=1, 忽略离子间相互作用 ØE随[H+]而改变,随 aO和 aR而变化。 (25 ) [ ] [O] lg 0.059 C n R E E 注意:
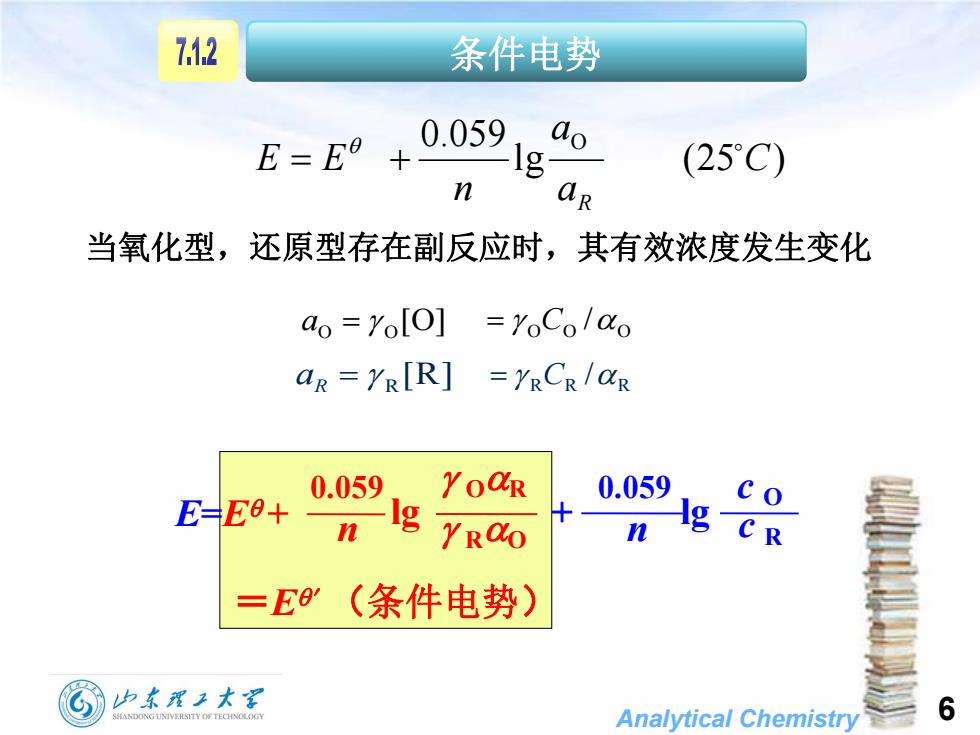
712 条件电势 E=E9+ 0.059, do (25°C) n aR 当氧化型,还原型存在副反应时,其有效浓度发生变化 ao YolO] YoColao aR =YRIR] =YRCR/aR 0.059 YOaR 0.059 E=E0+ n g YROO =E9(条件电势) 山东翟王大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 6
Analytical Chemistry 6 lg (25 ) 0.059 O C a a n E E R [O] O O a O O O C / [R] R aR R R R C / 条件电势 当氧化型,还原型存在副反应时,其有效浓度发生变化 =E (条件电势) 0.059 lg 0.059 lg n c O n E=E + OR RO c R

条件电势E':在给定条件下,当氧化态总浓度和还原态总 浓度均为1mol/L时,校正了活度系数和副反应系数后的电 极电位值。 E'与E的关系如同KMY'与KMY一样,是在一定实验条件下,衡 量反应方向的尺度。在实际条件下,应用E代替E(p401表 16)。 E=E+ 0.059 n CR 「例如]电对 Fe3+/Fe2+ E=0.77V 1mol/L的HC1O4中 E9'=0.74V 2mol/L的H3P04中 E9'=0.46V 1mol/L的H2S04中 E9'=0.68V 0.5mol/L的HCl中 E0'=0.71V 山东理子大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry
Analytical Chemistry 7 R O C C n E E lg 0.059 ' Eθ' :在给定条件下,当氧化态总浓度和还原态总 浓度均为1mol/L时,校正了活度系数和副反应系数后的电 极电位值。 Eθ'与Eθ的关系如同KMY '与KMY一样,是在一定实验条件下,衡 量反应方向的尺度。在实际条件下,应用Eθ'代替Eθ (p401 表 16) 。 [例如]电对 Fe 3+/Fe 2+ 0 E =0.77V 1mol/L的HClO4中 Eθ' =0.74V 2mol/L的H3PO4中 Eθ' =0.46V 1mol/L的H2SO4中 Eθ' =0.68V 0.5mol/L的HCl中 Eθ' =0.71V

[例1川计算1mol/LHC1溶液中,C(Ce4)=1.00×10-2 mol/L,C(Ce3+)=1.00x10-3mol/L时,Ce4+/Ce3+电对的 电位。 解E=B°+00591gY,02+9 特定条件下E=E+ 0.059. Co 一1g n 查条件电位表1mo/LHC1溶液中,E9'=1.28 E=E+ 0.05 -Ig Cce(v) Cce(1) =1.28+0.0591 .0×10-2 E=1.34y 1.0×10-3 归东程工大军 Analytical Chemistry 8
Analytical Chemistry 8 R O R O O R C C n n E E lg 0.059 lg 0.059 [例1] 计算1 mol/L HCl 溶液中,C(Ce 4+) = 1.0010-2 mol/L, C(Ce 3+) = 1.0010-3 mol/L时, Ce 4+ / Ce 3+电对的 电位。 解 查条件电位表 1 mol/L HCl 溶液中, E´ =1.28 (III) ' (IV ) lg 1 0.059 Ce Ce C C E E 3 2 1.0 10 1.0 10 1.28 0.059 lg E 1.34v 特定条件下 R O C C n E E lg 0.059 '

影响条件电势的因素 0.059.YoR E8=E0+ n g YROO >离子强度 Y >酸效应 >沉淀 a >络合效应 山东翟王大军 HANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 9
Analytical Chemistry 9 影响条件电势的因素 0.059 lg n E =E + OR RO Ø 离子强度 Ø 酸效应 Ø 沉淀 Ø 络合效应

1、离子强度的影响: 0.059. YOOR 0.059. E=E0+ n g YROO n I大,y<1,E与E相差大 忽略离子强度影响 0.059 [O] E=E0+n g R] 0.059 R ×、 0.059 E=E8+ n do 山东翟王大军 HANDONG UNIVERS1 Y OF TE INOLO分 Analytical Chemistry 10
Analytical Chemistry 10 1、离子强度的影响: 0.059 lg 0.059 lg n c O n E=E + OR RO c R I大, << 1, Eθ与Eθ'相差大 忽略离子强度影响 0.059 lg [O] n E=E + [R] 0.059 lg 0.059 lg n c O n E=E + R O c R