
@秦山医学院 省级精品课程申报 物理化学 第七章 化学动力学 首页 难题解析 学生自测题 学生自测答案 难题解析 例6-1 乙烷裂解制取乙烯的反应如下:C,H6→CH+H,已知1073K时的速车常数k=3.43s.问当乙 烷的转化率为50%和75%时分别要多长时间? 解:从速率常数k的单位知该反应为一级反应。则乙烷转化50%所需的时间(即半衰期)为 12=ln2/k=n2/3.43=0.202s 乙烷转化75%需时 解法-6s-n兴=3布h1-73%c0045 C、n 解法二转化75%也就是把转化了50%后余下的反应物再转化50%。而对一级反应来说,反应物的 转化率与开始浓度无关,达到相同转化率所需时间是相同的,因而625-212-2×0.202-0.4045 例6-2 氯化醇和碳酸氨钠反应制取乙二醇: CH:OHCH:CI (A)+NaHCO:(B)->CH:OHCH:OH+NaCl+CO: 已知该反应的微分逸率方程为:-ded=kccg且测得,355K时反应的速率常数-5.20moLh,试 计算在355K时: ()如果溶液中氧乙醇、碳酸氢钠的开始浓度相同,cA©g.0120molL,气乙醇转化95%需要多少 时问? (2)在同样开始浓度的条件下,氧乙醇转化率达到99.75%需要多少时间? (3)若溶液中气乙醇和碳酸氨钠的开始浓度分别为cA01.20molL,cgo=1.50molL.气乙醇转化 99.75%需要多少时间? 解:(山由速率方程知反应为二级反应,且两反应物开始浓度相同,则

@泰山医学院 省级精品课程申报 1 1 1 (3)因为两反应物开始浓度不同,则 =2.82h [讨论]比较4和2的数值可以看出,多转化4.75%所需要的时间为60.86小时,为转化95%所需的 间的20倍。这是山于浓度对二级反应速率的影啊比一级反应的影啊大,转化同一百分数,开始浓度愈低 则速率愈慢,所需时间愈长。而从的数值看到,增加另一反应物的浓度,达到与2)相同的转化率所需时 间大为减少。这同样是山于浓度对二级反应的速率影响较大的缘故。 例6-3 在330.55K时,某化合物在溶液中分解,得到以下一些数据.试确定该化合物分解反应的级数以及反 应速率常数。 CAmol-L- 0.501.10 2.48 3.21 huis 4280 885 174 104 解:以m2对1ncA.0作图得一直线.经回归后得:核距=6.98,斜率一2.00,相关系数-0.999.则 1h2即以.线会解反应为三线反应,对于三线反点,有=300即:-小2加心 之)线距698 ka=1.40x103mo12L2s 例6-4 茵栀黄注射液的有效期预测。该注射液是陈、山栀和黄岑经提取后制成的复方静脉注射液。注射 液中黄岑不稳定,所以以其主要成分黄岑式的含量作为质量控制标准。用薄层色谱法结合紫外分光光度 法测定含量。加速试验在373.15.363.15,353.15和343.15K迹光进行.实验结果下表所示, 首栀黄注射液在不同温度下时间1与含量的关系 373.15K 363.15K353.15K343.15K
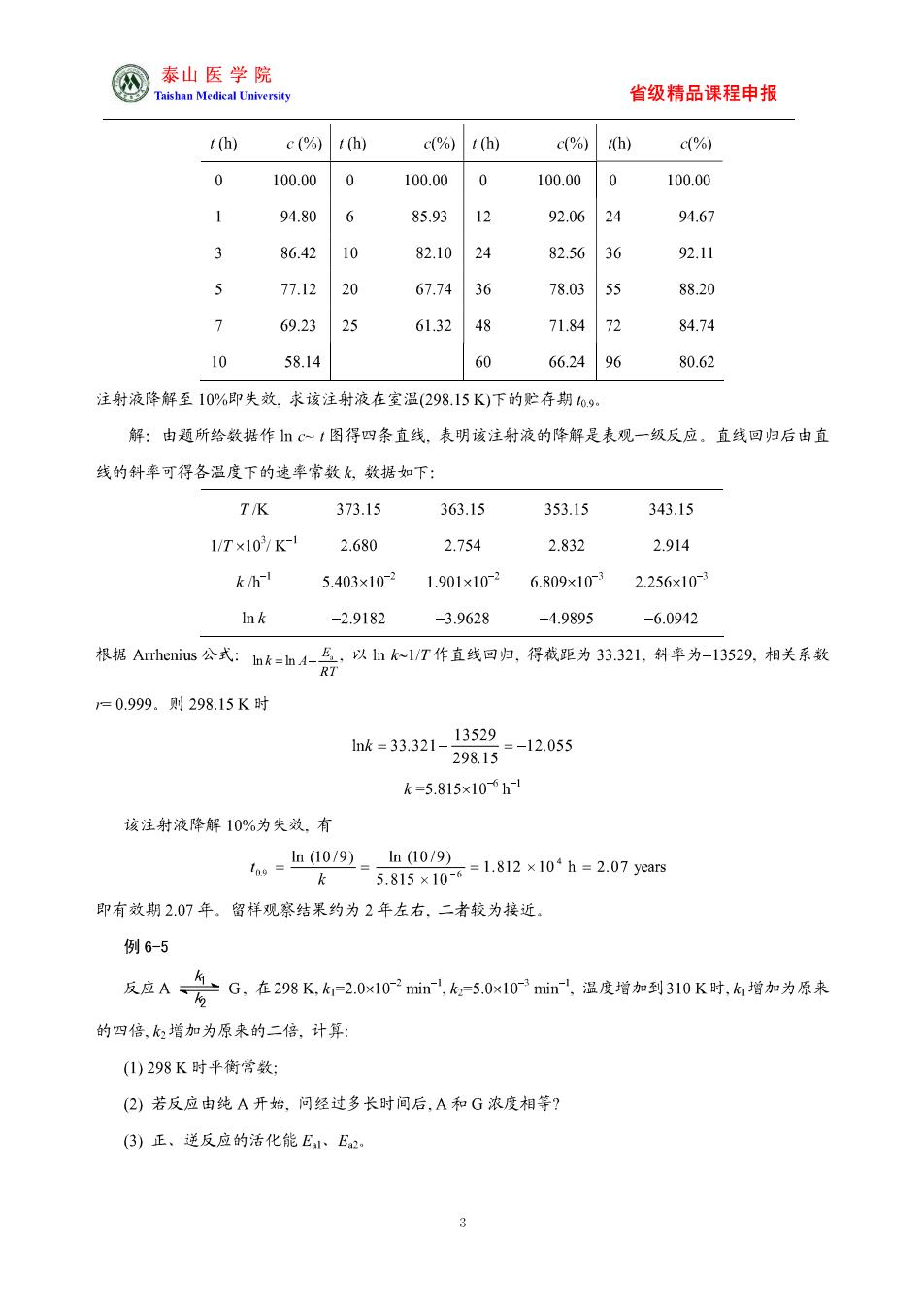
@泰山医学院 省级精品课程申报 1) c(%)t(h) (%) c%)h)c(%) 0100.000 100.000 100.000 100.00 1 94.806 85.93 92.06 24 94.67 3 86.4210 82.1024 82.56 36 92.11 77.1220 67.7436 78.03 88.20 69.2325 61.32 48 7184 72 84.74 10 58.14 60 66.2496 80.62 注射液降解至10%即失效,求该注射液在室温(29815K)下的贮存期9, 解:由题所给数据作c~1图得四条直线,表明该注射液的降解是表观一级反应。直线回归后由直 线的斜率可得各温度下的速率常数k数据如下: T/K 373.15 363.15 353.15 343.15 1/T×10/K-12.680 2.754 2.832 2.914 k/h 5.403x1021.901x1026.809x1032.256x10 -2.9182 -3.9628 -4.9895 6.0942 根据s公式:k=h4号、以血~T作直线回,归得我距为3.32L.斜华为-13S29,相关系致 =0.999.则298.15K时 城=321-82-20s5 k=5.815x10fh 该注射液降解10%为失效,有 。h09-90g-1210i-207as k 即有效期2.07年.留样观察结果约为2年左右,二者较为接近. 例6-5 反应A一务G,在298K-2.0x102mk5.0x10产m温度增加到310K时,增加为原来 的四倍,3增加为原来的二倍,计算: (1)298K时平衡常数: (2)若反应由纯A开始,问经过多长时间后,A和G浓度相等? (3)正、逆反应的活化能E、E 3

@泰山医学院 省级精品课程申报 20×102 ②)先求出再求反应至6。=6,=兰时所需时间国为 解得 根据11级对峙反应积分速率方程 n0=4=G,+k》 CA-CA. 1 In Cao-cats B)对于王反应,根据hiu方程月)-员(行-》代入各已知恤得 故正反应的活化能 E=88.7 kJ-mol 同理逆反应的活化能E=44.4kJmo厂. [结论]对于正向吸热的对峙反应,E>E,升高反应温度,既可增大反应运率,又有利于反应向正 向进行。 例6-6 一氧乙酸在水溶液中进行分解,反应式如下: CICH:COOH+H:0->CH;OHCOOH+HCI 今用=2537A的光照射浓度为0.5molL的一氧乙酸样品1L.照射时间为6样品吸收的能量c及c 的实验结果如下: t/min sl ccrx10'/mol-L- 837 34.36 2.325 当用同样的样品在暗室中进行实脸时,发现每分钟有3.5x100m0lL的CT生成,试计算该反应的量子 效率 解:根据量子效率中的定义:

网泰山医学院 省级精品课程申报 光解反应产生C厂离子的物质的量应为C1离子的总物质的量减去非光化反应产生C「离子的物质的量 nm-2.325×105-837×3.5×1016-2.296x10m0l 3436 Bmcm0196a1962537x107289x10'mml D=及=2296×10 片7289x10=0315 例6-7 碘化氢分解反应:2H→H+lk,已知临界能E-183.92kmo,H的分子直径d=3.5x10m 摩尔质量为127.9gm0l.试由碰撞理论计算在不同温度下H分解的逸率常数k并和下列实验数据相此 556 666 781 k/moms13.52x10102.20x103.95x10 解:根搭碰撞理论,对同种双分子之间反应速率常数 62aaswyax k=210x10斤exp6212马 分别将T=556、666.781K代入,计算结果列入下表: TK 556 666 781 kmor'm3s12.61x10-102.04×10-72.94×10-5 计算结果与实验值相比,从数量级上来看,基本接近 学生自测题 1.问答题 ()为什么反应速率需以微分形式来表达? (2)降低反应温度有利于提高合成氨反应的平衡转化率.但实际生产中为什么选取450550℃的较 5

⑧@泰山医学院 ishan Medieal Universit 省级精品课程申报 高温度? (3)工厂中用C,和H合成HC1时采用的装置都是两条管子分别引出H:和C1,若改用一条管子引 出H,和C2混合物气体来燃烧,行不行?为什么? (4)对于下述几个反应,增加溶波的离子强度,是杏会影响反应的速率常数?(指出增大,减小或不 变) (@)502+2r→5+2s0 ()蓝糖在酸性条件下的水解 (c)[Co(NHs)sBr)H-[Co(NH3)OH]"Br 2.选样题 0反应20,一0:其反应速*方程式为-雪=人,后公度者会-大后c。,明建*带数 ko和ko的关系是: A2ko=3ko B ko=kon C3 ko =2kon D-3ko=2 ko (2)实验测得化学反应50,之+2r→5+250,产的速率方程为-d =c今一,根据上述条件 可以认为: A反应分子数为3B反应分子数为2C反应级数为3D反应级数为2 (3③)反应C0(g)+2H(g)→CH,OH(g)在恒温恒压下进行,当加入某种催化剂,该反应速率明显加 快。不存在催化剂时,反应的平衡常数为K,活化能为E存在催化剂时为K和E,则: AK'=K,Ei'>E. BK'E CK'=K,E'<E。 D K'<K,E'E 3.填空题 ()山动力学实验测得某反应的若干组c~数据,然后以血以对1作图得一直线,已知该直线的截 距为100,斜率为-2.0x102s',则该反应的半衰期为 ②山辈元反应构成的复杂反应A冬G且物质。的浓度变化为 (3)按照光化当量定律,在光化反应的 过程,一爱因斯坦能量活化 原子 或分子。 学生自测答案 1.()反应速率随着反应的进行分子间相互碰撞的机率减小而逐渐变慢,为一瞬时量。故需以微分

@泰山医学院 省级精品课程申报 形式表达。 (2)为了加快反应速率。 (3)不行,链的传递会迅速扩辰到整个系统,引起爆炸 (4)(a)增大b)个变(e减小 2.(1)C(2D(3)C 3.(I)34.7(2)k1cA-kcG-k3cG(3)制级:1mol