
+气体一逸度 判十据 计算+ 、液体一稀溶液的依数性一活度一活度系数 热力学第三定律 热力学第零定律 表面张力 dG =-SdT +VdT +>udni odA' 化学反应+方向 →气相 ·电解质落液(A) A=U-TS G H-1S Carnot循环←一热力学第二定律 ◆限度一平衡常数一+表示 +液相→◆胶体化学() H-U+PV 厂+Hess定律 +计算及测定→复相-一分解压力 I-W+Q 热一律+△H Kirchhoff方程 一→影响因素广温度 L+△H +压力x=nR/P) 定义分类计算 ·(C) +惰性气体 —简单过程 相变化 化学变化 性质 →Laplace方程 饰枪过程寸 +Kelvin方程 ·界面一表面现象 现象 +Gibbs吸附 →表面活性剂 气固吸用 一+完全互溶-一蒸及精馏 广·单组份 相律F=C-P+2 相图 一+点、线、面 杠杆规则 「双液 +部分互溶 T-X、T-P、相点、物系点、气相线、液相线等 +二组分一 +完全不互溶一水蒸气蒸馏+ +三组分 凝聚 低共熔混合物 等边三角形规则两盐一水体系 稳定化合物一 T一X、热分析法、区域熔炼 化合物。不稳定化合物
气体----逸度 判 据 计算 液体----稀溶液的依数性----活度---活度系数 热力学第三定律 热力学第零定律 表面张力 dG = -SdT + VdT + ∑μidni + δdA。 化学反应 方向 气相 电解质溶液(A) A=U-TS G = H-TS Carnot 循环 热力学第二定律 Xi 限度—平衡常数 表示 液相 胶体化学 (B) H=U+PV Hess 定律 计算及测定 复相----分解压力 U=W+Q 热一律 ΔfHm 0 Kirchhoff 方程 影响因素 温度 ΔcHm 0 压力 K 。 =Π(PB/P 。 )νB 定义 分类 计算 (C) 惰性气体 ( )T 简单过程 相变化 化学变化 ( )V 性质 Laplace 方程 绝热过程 Kelvin 方程 可逆过程 界面—表面现象 现象 Gibbs 吸附 表面活性剂 气固吸附 (Clausius-Clapeyron) 完全互溶---蒸馏及精馏 单组份 相律 F = C – P + 2 相图 点、线、面 杠杆规则 双液 部分互溶 T–X、T–P、相点、物系点、气相线、液相线等 二组分 完全不互溶 —水蒸气蒸馏 三组分 凝聚 低共熔混合物 稳定化合物 等边三角形规则 两盐一水体系 T–X、热分析法、区域熔炼 化合物 不稳定化合物 2 O r m O ln RT H T K p 2 , ln RT H dT d P m P
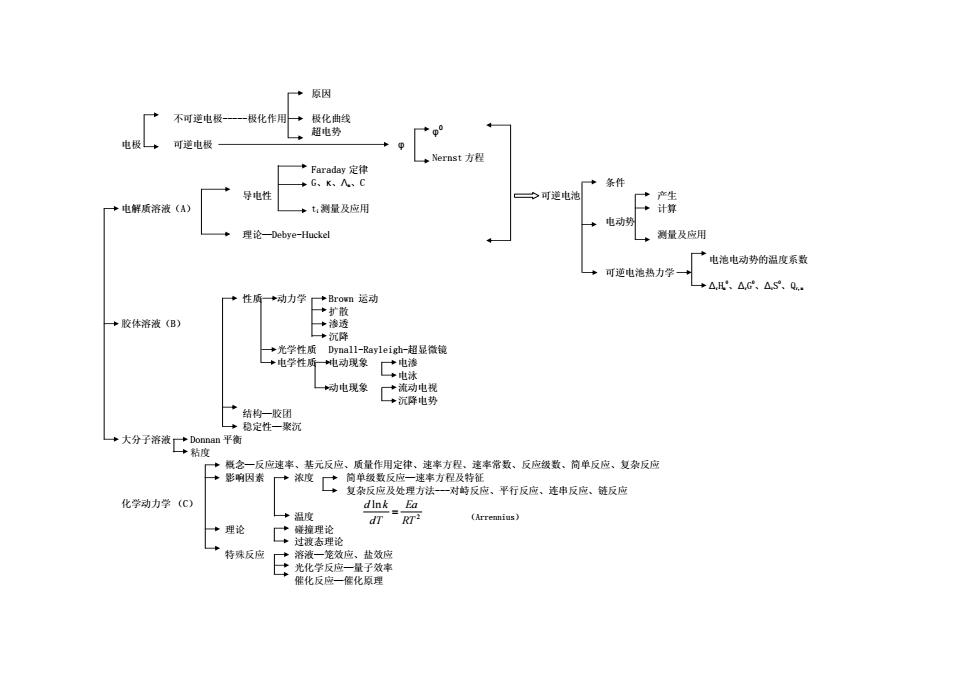
+原因 不可逆电极-—一一一极化作用→极化曲线 超电势 地极+可逆电极 ,Nernst方程 Faraday定律 +G.A、G +条件 导地性 可逆电沁 ·产生 +电解质溶液(A) +t:测量及应用 ·计算 电动势 理论一Debye-Huckel →测量及应用 厂广电池电动势的温度系数 可逆电池热力学→ +△H'、△c、△S.0. +性厨+动力学+B肛on运动 参打散 +胶体溶液(B) +渗透 +沉降 +光学性质 Dynall--Rayleigh-超显微镜 电学性所地动现象二电渗 *电泳 动电现象 仁亡汽牌电务 →结构一收团 L→稳定性一聚沉 一大分子溶的度 一+概念一反应速率、基元反应、质量作用定律、速率方程.速率常最、反应级数、简单反应、复杂反应 十影图素广度工复数餐风处素方。平行反位,花串反应.反应 化学动力学(C) Ea +温度 →理论 中防a风E充华 催化反应一医化原理
原因 不可逆电极-----极化作用 极化曲线 超电势 φ 0 电极 可逆电极 φ Nernst 方程 Faraday 定律 G、κ、Λm、C 条件 导电性 可逆电池 产生 电解质溶液(A) ti测量及应用 计算 电动势 理论—Debye-Huckel 测量及应用 电池电动势的温度系数 可逆电池热力学 ΔrHm 0、ΔrG 0、ΔrS 0、Qr,m 性质 动力学 Brown 运动 扩散 胶体溶液(B) 渗透 沉降 光学性质 Dynall-Rayleigh-超显微镜 电学性质 电动现象 电渗 电泳 动电现象 流动电视 沉降电势 结构—胶团 稳定性—聚沉 大分子溶液 Donnan 平衡 粘度 概念—反应速率、基元反应、质量作用定律、速率方程、速率常数、反应级数、简单反应、复杂反应 影响因素 浓度 简单级数反应—速率方程及特征 复杂反应及处理方法---对峙反应、平行反应、连串反应、链反应 化学动力学 (C) 温度 (Arrennius) 理论 碰撞理论 过渡态理论 特殊反应 溶液—笼效应、盐效应 光化学反应—量子效率 催化反应—催化原理 2 ln RT Ea dT d k