
第2章化学热力学 2.1基本概念 2.2化学平衡 2.3燃烧焓与绝热燃烧温度 反应物 燃烧产物 52.1 CHa+air → ?C02t?H20+?N0.. §2.2 T=300 K,P=1 atm Tad=?P=? S2.3 化学反应动力学 化学热力学 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn 2
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 2 第2章 化学热力学 2.1 基本概念 2.2 化学平衡 2.3 燃烧焓与绝热燃烧温度 反应物 CH4+air T=300 K, P=1 atm 燃烧产物 ?CO2+?H2O+?NO… Tad=? P=? §2.1 §2.2 §2.3 化学反应动力学 化学热力学
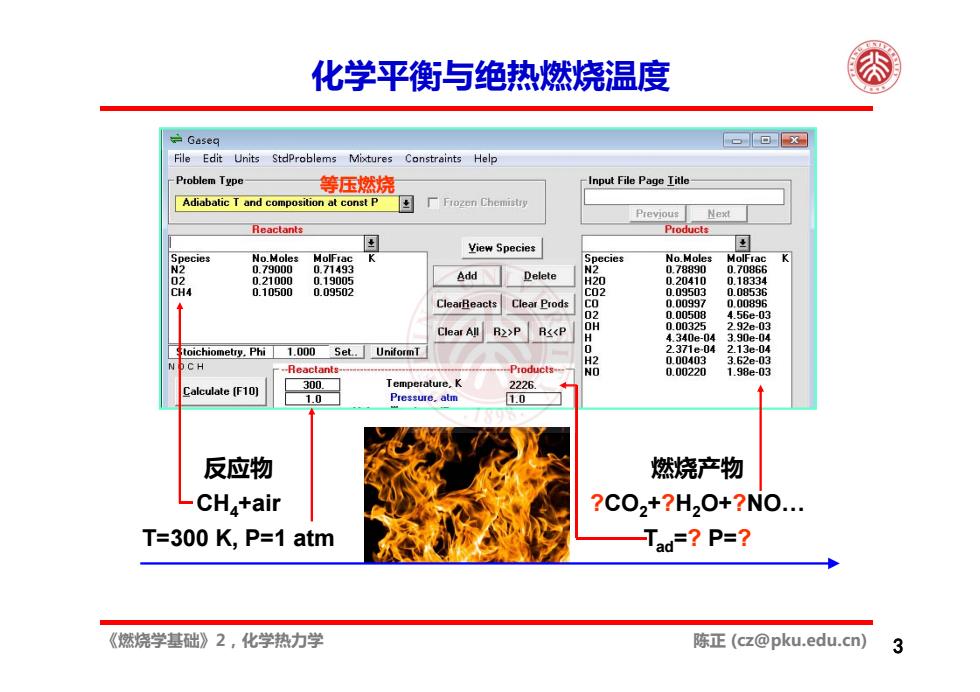
化学平衡衡与绝热燃烧温度 Gaseq 回x File Edit Units StdProblems Mixtures Constraints Help Problem Type 等压燃烧 Input File Page Iitle Adiabatic T and composition at const P Previou峰 Reactants Products View Species No.Moles MolFrac cies No.Moles MolFrac K 0.79000 0.71493 0.78890 0.70866 02 0.21000 0.19005 add卫elete H20 0.20410 0.18334 CH4 0.10500 0.09502 C02 0.09503 0.08536 ClearReacts Clear Prods u.00994 0.00896 Clear All R2>P R<<P 3- Stoichiometry.Phi 1.000 Set..UniformT 371e04 213 -04 0.00403 3.62e-03 CH Reactants. 0.00220 1.98e-03 alculate [F10 Temperature,K 2226 Pressure.atm 10■ 反应物 燃烧产物 LCHa+air ?C02+?H20+?N0. T=300 K,P=1 atm Tad=?P=? 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn)
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 3 化学平衡与绝热燃烧温度 2.1 基本概念 2.2 化学平衡 2.3 燃烧焓与绝热燃烧温度 反应物 CH4+air T=300 K, P=1 atm 燃烧产物 ?CO2+?H2O+?NO… Tad=? P=? 等压燃烧
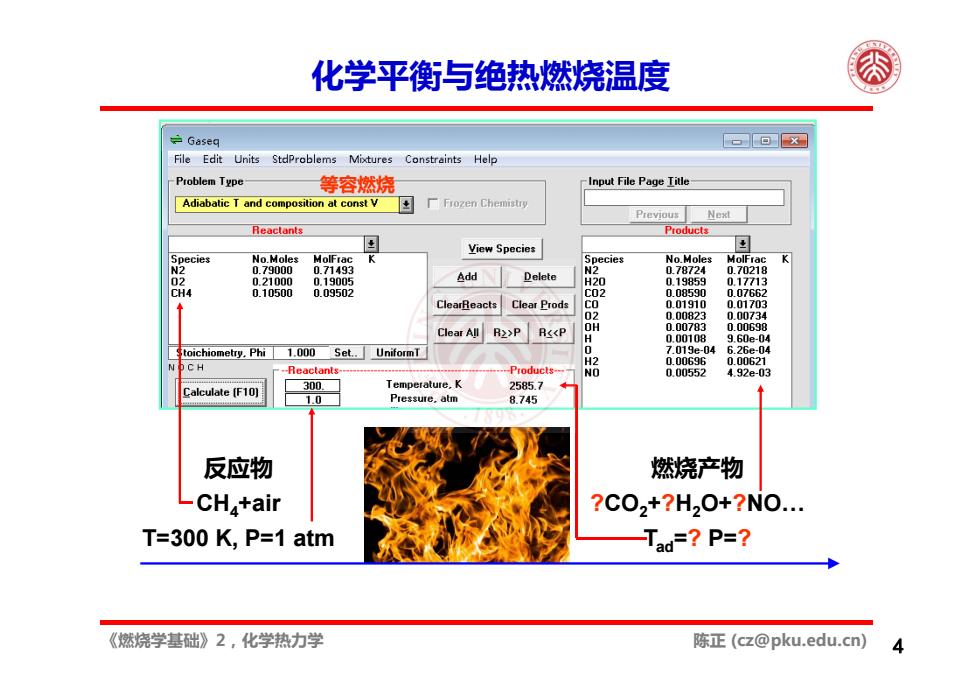
化学平衡与绝热燃烧温度 Gaseq 口回x File Edit Units StdProblems Mixtures Constraints Help Problem Type 等容燃烧 Input File Page Title Adiabatic T and composition at const V 厂Frozen Chemistry Previous Next Reactants Products pecies No Moles MolFrac View Species ecies No.Moles MolFra N2 0.79000 0.71493 07B724 0.70218 02 0.21000 0.19005 Add Delete H20 0.19859 0.17713 CH4 0.10500 0.09502 C02 00B590 0.07662 ClearReacts Clear Prods 0.01910 0.01703 Clear All R2>P R<<P 品 U00B23 0.00734 3.bue- toichiometry.Phi 1.000 Set..UniformT 04 CH -Reactants- ---Products--- 0.00552 4.92e-03 Calculate[F10) 300 Temperature.K 2585.7 Pressure,atm 8.745 反应物 燃烧产物 LCHa+air ?C02+?H20+?N0. T=300 K,P=1 atm Tad=?P=? 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn)
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 2.1 基本概念 2.2 化学平衡 2.3 燃烧焓与绝热燃烧温度 4 化学平衡与绝热燃烧温度 反应物 CH4+air T=300 K, P=1 atm 燃烧产物 ?CO2+?H2O+?NO… Tad=? P=? 等容燃烧
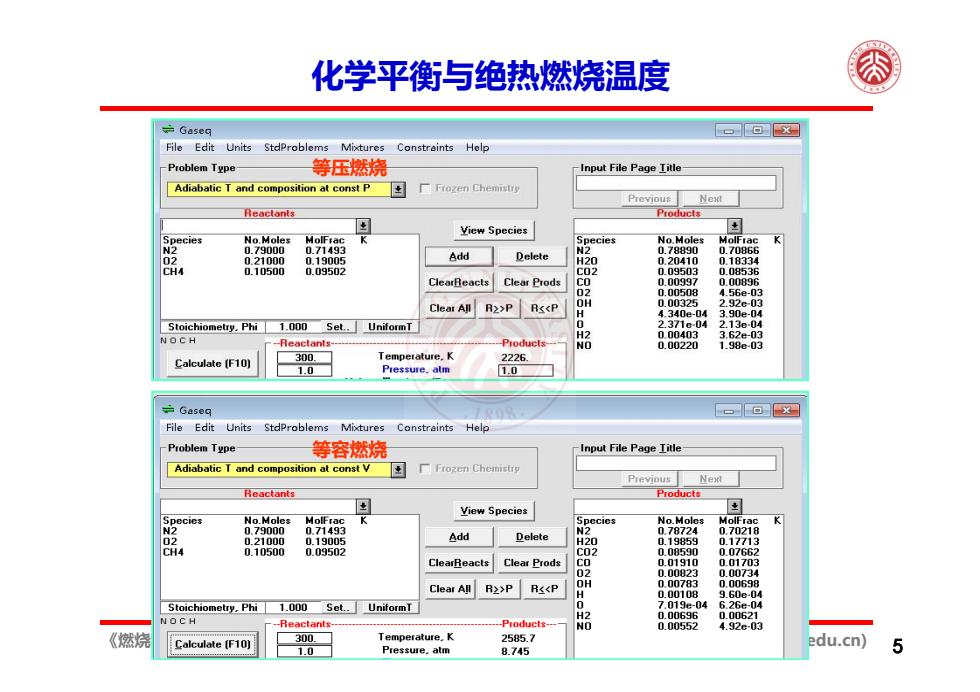
化学平衡衡与绝热燃烧温度 Gaseg ⊙X File Edit Units StdProblems Mixtures Constraints Help Problem Type 等压燃烧 -Input File Page Iitle Adiabatic T and composition at const P Previou:Next Reactants View Species pecies No.Moles MolFrac pecies No.Moles 0.79000 0.749 Add Delete 0.78890 0.7085 4 0.10500 0.095 ClearReacts Clear Prods 0.00896 02 4.56e-03 Clear All R2>P RsP R<<P 0.00698 Stoichiometry.Phi 1.000 Set..UniformT 04 -04 NOCH -----Products- 2 0.00696 000621 0.00552 4.92e-03 《燃 Calculate (F10) 300. Temperature.K 2585.7 edu.cn)】 1.0 Pressure.atm 8.745
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 5 化学平衡与绝热燃烧温度 等容燃烧 等压燃烧

第2章化学热力学 2.1基本概念 2.2化学平衡 2.3燃烧焓与绝热燃烧温度 反应物 燃烧产物 52.1 CHa+air ?C02+?H20+?N0.. §2.2 T=300 K,P=1 atm Tad=?P=? §2.3 化学反应动力学 化学热力学 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn) 6
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 6 第2章 化学热力学 2.1 基本概念 2.2 化学平衡 2.3 燃烧焓与绝热燃烧温度 反应物 CH4+air T=300 K, P=1 atm 燃烧产物 ?CO2+?H2O+?NO… Tad=? P=? §2.1 §2.2 §2.3 化学反应动力学 化学热力学

体积百分数与质量百分数 体积/摩尔百分数:n为第k个组分的摩尔数:N为组分种类数 ne Xk= n1+n2+..+nw 宫容1 i=1 ■质量百分数: Wk为第k个组分的分子量 nW n W yk=- wi+nw2+...+nyWy N ∑(n,W) i=1 ■空气: x02=21% → o2=(0.21×32)/0.21x32+0.79×28)=23.3% xw2=79% yw2=(0.79x28)/0.21×32+0.79x28=767% 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn)
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 7 体积百分数与质量百分数 N i i k N k k n n nnn n x 1 21 ... N i ii kk NN kk k Wn Wn WnWnWn Wn y 1 2211 )( ... 1 1 1 N k k N k k yx 体积/摩尔百分数: 质量百分数: 空气: %79%21 22 NO xx nk为第k个组分的摩尔数; N为组分种类数 Wk为第k个组分的分子量 ?? 22 NOyy %7.76)2879.03221.0/()2879.0( %3.23)2879.03221.0/()3221.0( 22 NOyy

体积百分数与质量百分数 nk Xk= nWk W yk= N ∑m =1 m k=1 i= ■相互转换: 片=g之x鸭)个=0m21w) i=1 ■混合物的平均分子量: F-2)=12w,) 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn) 8
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 8 体积百分数与质量百分数 N i i k k n n x 1 N i ii kk k Wn Wn y 1 )( 1 1 1 N k k N k k yx N i kkk WxWxy ii 1 )(/)( N i kkk WyWyx ii 1 )/(/)/( 混合物的平均分子量: N i ii N i WxW ii Wy 1 1 )/(/1)( 相互转换:

体积百分数与质量百分数 W Xk= yk= nWk N w) 兰之 k=1 i=1 ■分压定律: P-t P=xP P=nR'T/V=PRT/W =1 Pk=ykP ■摩尔浓度: C=IM]= = 七xP XkP RT W Mk为第k个组分的分子式 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn) 9
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 9 体积百分数与质量百分数 分压定律: N k PP k 1 kk k WTRVTRnP k / / 0 0 kk PxP ykk W x TR Px V n MC kk k k k 0 ][ 摩尔浓度: Mk为第k个组分的分子式 N i i k k n n x 1 N i ii kk k Wn Wn y 1 )( 1 1 1 N k k N k k yx
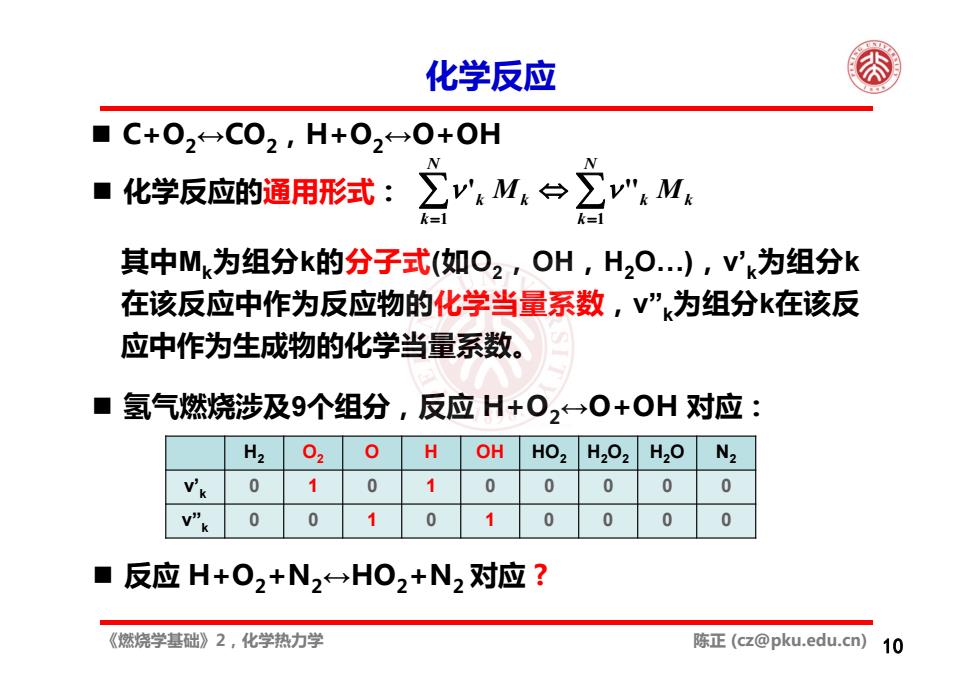
化学反应 ■C+02C02,H+020+OH ■化学反应的通用形式:】 M:台2M k 其中Mk为组分k的分子式(如O2,OH,H,O.),Vk为组分k 在该反应中作为反应物的化学当量系数,V”k为组分k在该反 应中作为生成物的化学当量系数。 ■ 氢气燃烧涉及9个组分,反应H+0,→0+OH对应: H2 0 0 OH HO, H202 H20 N2 0 1 0 1 0 0 0 0 v”k 0 0 0 0 ■ 反应H+02+N2H02+N2对应? 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn) 10
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 化学反应 10 C+O2↔CO2,H+O2↔O+OH N k kk N k Mkk M 1 1 化学反应的通用形式: ' " 其中Mk为组分k的分子式(如O2,OH,H2O…),ν’k为组分k 在该反应中作为反应物的化学当量系数,ν”k为组分k在该反 应中作为生成物的化学当量系数。 反应 H+O2+N2↔HO2+N2 对应 ? H2 O2 O H OH HO2 H2O2 H2O N2 ν’k 0 1 0 1 00000 ν”k 0 0 1 0 1 0000 氢气燃烧涉及9个组分,反应 H+O2↔O+OH 对应:

化学反应 ■C+O2C02,H+020+OH ■化学反应的通用形式: H+02+N2HO2+N2 H2 02 0 H OH HO2 H2O2 H20 N2 V'k 0 1 0 0 0 0 0 v”k 0 0 0 0 0 0 ■ 定义反应计量系数:Vk=V"k一Vk ∑(w"-v')M.=0 V'k=00,则组分伪反应产物 V'k>0=V”k即V0则该反应中组分伪第三体(催化剂) 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cm)11
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 化学反应 11 C+O2↔CO2,H+O2↔O+OH 化学反应的通用形式: 定义反应计量系数: kkk '" k "0' k k "0' k 0"' kk 0"' kk 即νk>0,则组分k为反应产物 则该反应中不涉及组分k 则该反应中组分k为第三体(催化剂) 即νk<0,则组分k为反应物 H+O2+N2↔HO2+N2 H2 O2 O H OH HO2 H2O2 H2O N2 ν’k 0 1 0 1 0000 1 ν”k 00000 1 0 0 1 N k kk N k Mkk M 1 1 ' " 0 1 N k Mkkk )'"(