
目 拎 第1章化学热力学及化学动力学 811 化合物的生成始, 反应特及燃格 311 :化合物的生成为 31,1,2反应哈 .4 专12热化学定律…… 513热力学平衡与自由能,化学平衡与反应自由能 。6 81,4西最作用定律及可近反应的平衡常数+ 15平衡数和标准反应自由能的关系 1.6 温度和压力入 常数的影 火焰温度1算 等1.君化学动力学中采用的几个基木新念和定义………………………5 多1.8.】浓度及其表示法nn444w, 15 秀1,8,2化学反应速率的凝念…… 墨1.8.3活化能的腰念*: 17 51,10阿累尼乌瓶(Arrhenius)定体 双分子反 1.12 反应分子数及反应级数 S1,13影响化学反应的因泰……, 22 多1.131化学反应速率与反应物性质的关系… .2 等13.2化学反应速率与温度的关系…… 多】,13.3化学反应速率与反应物浓度(压力)的关系 S113.4反应速半与混合物成分的关系 81.14 1.14. 不分枝反应 "2 1142分枝链反应 …25 第2章燃烧物理学基本方程 19 32.1引宫… 9 2,2多组分气体太参是: 82.3分子输运燕本定神 52.3. rtoa)粘性定种 2.3.2 饵立叶(Fourier)导热定律 2,3,3费克(FiCk)扩定律…444444:+,n4 S2.4基本守恒方程m…… 414444* 昌2.4.1连线任方程 。2,4.2动景待恒方程…, 82,4.8扩散方程……

82.44能量守恒方程 52,4:5二维边界层守恒方程 艺.5泽尔多维态《3h9mg)转换和广义雷诺比拟 52.5.1泽尔多维奇转换… 82.5.2广义话(Revaolds)比拟 826 斯蒂芬(Sfa)和相分界面上边界条件 4 52.6.2 相分界面的内移 号2.6.3液-气分界面边界条件及广义雷诺比拟 至2.6,4固-气分界面边界条件 第3章预混气的者火与灭火… §3,2着火的装白燃理论 §3,2.1谢苗诺夫(CeNmo)的非稳态分析法 5 832,2托特新(Toc)的非稳本分析法……:4*4n S3.2,3弗朝克-·卡门视茨基的非稳态分析法 65 63,2,4典朗京-卡门得茨基的段态分析法 .6 83开口系流)中的热自分 .71 点燃理修 3.4.1 气流中炽热平板的点燃连论 零值边界梯度法 475 3.4.2电火花点燃理论· S3.43熟气流点燃(火焰点燃)…… 83.5简单开口系统的着火、灭火分折 多3,6朗格惑尔的均匀橙排反应器理论 9 83.7 着火的链式反应理论一 94 第4章液体燃料滴的燃烧 95 登41引宵… 95 多4,2相对静止高温环境中液滴的蒸发和燃烧… 84.3强泊气流中液滴蒸发和淋烧一薄燕理论 4,4数位解 第5章预混气的层流然 S5.1燃绕被的两种形式 一缓选(或火焰正常传播)及爆震 多5,2层流火焰传橱及其传播方程的特性… 114 55.2.1 火铭传播德度的概会 85.2. 层流火焰的内部结构及其传机理 5.2.3 层流火焰传播的基本方程及其 5.3马兰特和利恰及利耶的简化分析社 S5.4层泼火焰传播速度的无量钢分析法 44 S5,5评尔多维奇和弗朗克-卡门湿茨基的分区近以解……… 120 S5.6分区近似解的改进………*…*… 85.7豫解… 124 s5.7.1 董道义法 .j24

S5.7,2克莱选代法, 55,8物理化学参数对S,的影响及对火焰厚度的影响 等5,8.1物理化学参数对S,的形向 专5,8,2物理化学参数计火格厚度A的影时 85.9 火始传界烈 35.10 用 火传速度计算化学动力参数的方法… 55.11 火始的基本性质及火焰的几何学*+, 多5,11,】火馅的基本性质,*4 85,11.2火缩几何学… §5.】2本生灯火焰稳定的条件… 多5.12.1火蛤知火的临界条件及同火界图… 55.12.2 火焰欢的临界条件及吹熄界 层流火传播速度的实验测定 55.13. n144 s5,13.2 平面形火焰法*…t,* 145 等5.13.3管内火焰法 145 5,13,4碳强法(水室法) 1d 85.13,5肥阜泡法(定压法) 5,14单组元燃料滴燃烧 514.1 本方 55.14.2简化分析解 148 第6管燃格, 4 153 36. 湍流燃烧的一·特 多6,2非均勾流场的数学模型及雷话应力的处理方法 154 S6,2,1平均速度场模型 156 多6,2,。平均蒂流能量梅型 -植方架链列和双方阴拔型,,+ 15R 多6.2.3平均留话应力模型 16 6,3端流蝶烧及流火地的物理 56.3. khicr)和尔金( x)折火始面模型 处菲尔特 容积燃烧核西 6.3. 本生灯流火焰传粉速度实验结果 -164 多6.4钝体后方的湍流烧+…++ 6,4,】通道内钝体后力燃烧的一般特点 156 66.4,2线举森的篇化横利 号6,5突扩口同流风燃烧的数值计算糖型 第7章 高速气流中的火焰稳定 4173 87.1引宫n ST.2简化热理论 7,2.1 威斯的简化热理论 林的简化热理 7. 朗格尔的均匀拌反应器模至 74逆向射稳定火

&75气一液两相火性障定 第8章 流射流中的燃烧 4* 381写引言 88.2端注射液白茶本方程 多8.3端流同桂彩片油射流的解 88,A治流财洁h在广散燃烧 81火的形快 火始保藏西上的成分分布 8.4 火始装面上的型度分布 192 $8,5纵向受限射流火戏 第9章液雾然烧基础… 196 89.1引言 89.之清嘴特性及客化特性 19 9.2 液滴尺寸分布去达式 204 39.2. 平均裤径的定义其表示方法 208 9.2.3 110 §9.2.4计算平均流径的准则公可 多9.名高温条件下两料流中浓度场的简化分析 893.1扩胎法* 21 89.3.2液滴道法… 9.3.3轨道扩散法… *4222 89.3.4 气流中直流式后方燃油浓度场计算方法 +232 94液雾燃绕 s9.4,1 一维演群扩散燃烧((Probert模型) S9,4,2一维滴群扩散腾烧(5 palding-Priem--H四ex摸型) …239 S9.43一维摘间地烧的Mse换型m… 多9.4,4液雾两相抛烧的多维揽型………… 41 第10章煤的您浇基 510.1引 510.名然的快速热分船 号10.2,1快德热分解的概念和实验 号1022努塞尔收缩热解物理核型 810,2,3热解的动力学信述…… 310.3 +24号 碳粒非均相反的物理述… 151 10.5 生扩控制的粒表面非均相燃核型· 4253 10.6广散动力控制能碳粒表面 s10,7 石容积反应的碳拉燃烧慎型· 专10,8园拉燃档中的内孔效应和覆盖层的影刚 S10.9碳粒的着火出火火理伦* 269 附录A 物性表 附录B燃烧物理学基本方程的一般推导及其在柱、球坐标系中的表示式 …8

第1章化学热力学及化学动力学 化学热力学是利用热力学第一定律来分析化学能转化为热能时的相互关系,利用热力学 第二定律米分析化学平衡的条件,以及在平衡时的平衡常数与自由能的关系。 化学动力学是研究化学反应机理及化学反应速率的一门科学,燃烧是一种剧烈的化学反 应,因此化学动力学在燃烧理论中占有重要的地位。但化学动力学是一门独立的学科,对鹅 烧物理学来说只需利用其中的一些主要概念及避论, 因此在本章中只讨论一些在分析燃烧过 程中所必须掌提的基础知识 §1.1化合物的生成烙、反应焓及燃烧热1) §1.1.1化合物的生成始 当化学元素在化学反应中构成一种化合物时,根据热力学第一定律,化学能将转变为热 能(或者相反)。转变中生成的能称之为化合物的生成给(kca/mo1)。在计算中常采用标准 生成烙,它的定义是:各化学元素在恒压条件下形成1摩尔的化合物所产生的给的增量。选 择的温度是298K,压力是一个大气压。标准生成络用△…表示, 其下标“298”代表标 准温度,上标·0”代表1大气压的标准压力。表1-1表示了某些物质的标准生成给。例 如: C+0:→c0,△am=-26.42ka/(I(CO)) 2H+2l,→H,4e=6.00kca/mol(H)y 但注意下列反应 C0+20→C0,△h=-67.63kcal/mol(C0,) 其中△h=-67.63kcal/Cmo1(C0,)不是C0,的生成给,因为反应物C0不是元素,而是化 合物,在生成处的定义中,反应物 一定要是自然状态的元素。 51.1.2反应始 在几种化合物(或元素)相互反应形成生成物时,放出或吸收的热量称为反应给(k), 它可以由反应物及生成物的络差来计算: △Hi,=∑M,A,-∑Ma9 (1-1) 其中△H:表示在温度为T、压力为1大气压下的反应始。M,和M,分别为各生成物和各反 应物的摩尔数。“P”表示生成物,“R”表示反应物。例如CH,+20,一→C0+2H:0的反 应给的计算如下,反应物的总给(由表1-1查出)是:1×(-17.9)+2×(0.0)kcal生成物 的总给是:1×(-94.0)+2×(-68.3)kca,反应结果给的增加可以由式(1-1)算出 -94.00-136.6-(-17.9)=-212.7kcal
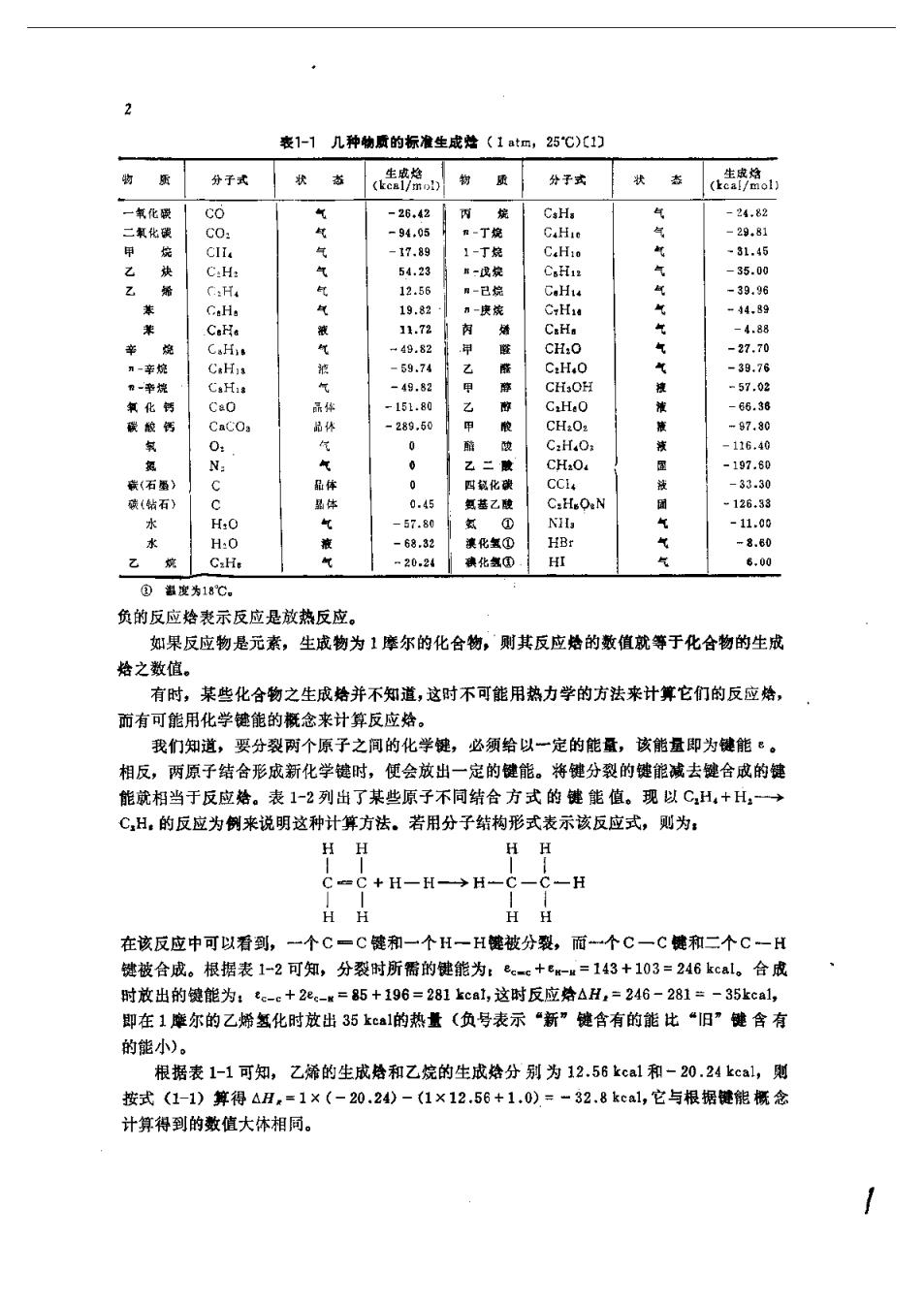
表1-1几种物质的标准生成址〈1at四,25℃)(1) 分于式 状 状志《告格o: 一氧化 CO 26.42 4,8 94.0 C:H 12.5 气气气气气气气淮液液团团气 -39.96 9.8 -27.70 -39.78 9.8 0. C2H.0 16.40 0 CHaO. 197.89 石 C.H.ON 1265 水 H0 5.80 -11.09 H:0 气 -68.32 澳化氢① HB: -8.80 C:H 2024化氢 HI ,00 ⑧温堂为18心 负的反应老示反应是放热反应。 如果反应物是元素,生成物为1座尔的化合物,则其反应处的数值就等于化合物的生成 焙之数值。 有时,某些化合物之生成婚并不知道,这时不可能用热力学的方法来计算它们的反应 而有可能用化学键能的概念来计算反应给。 我们知道,要分裂两个原子之间的化学键,必须给以一定的能量,该能量即为健能·。 相反,两原子结合形成新化学时,便会放出一定的健能。将键分裂的键能减去健合成的 能就相当于反应给。表1-2列出了某些原子不同结合方式的键能值。现以CH,+H,一→ ℃H。的反应为例来说明这种计算方法。若用分子结构形式表示该反应式,则为: H C+H一H→片 一H HH HH 在该反应中可以看到,一个C一C键和一个H一H被分裂,而个C一C能和二个C一H 被合成。根据表1-2可知,分裂时所需的能为: w=143+103=246kcal。合成 时放出的能为:e-e+2-=85+196=281kca1,这时反应给△H,=246-281=- 35kcal, 即在1摩尔的乙婚氢化时放出35ka1的热量(负号表示“新”健含有的能比“旧”健含有 的能小)。 根据表1-1可知,乙烯的生成烙和乙烷的生成给分别为12.56kca1和-20.24kca1,则 按式(1-1)算得△H,=1×(-20.24)-(1×12.56+1.0)=-32.8kca1,它与根据链能概念 计算得到的数值大体相同

委1-2望能(kc1/饿)C1们 量 健 能 量 能 C-B: 6 H一B c- C-N N C--CI 8 H-H 80 再举一例: 甲烷直接氧化生成二氧化碳和水蒸汽的反应烙的计算。其化学结构式为 H H+0-0+00 0-C一0+H -0- -H+H-O一H 由上式可以看出有四个C一H键被分裂;二个C一0健和四个0一H赞被合成。分裂四个 C一H键和二个0-0键所清的能量为:(4×98+2×33)=458kcl。而形成二个C一0能 和四个0一H键释放的能量为:(2×86+4×109)=608kcl,因此△H,=458-608= -150kca,即甲烷的氧化反应其反应烙约为-150kcl, 虽然用健能来计算反应焙是较粗赖的,但在没有化合物的生成给资料的情况下,采用使 能的概念来计算反应络是很有用的。 前而讲的反应给都是指的反应给的标准值,即是在压力为1标准物理大气压,温度为 25℃时确定的。那么对任意给定的压力和温度下的反应结应如何计算呢?我们知道,对于理 想气体来说,热与压力无关,但与温度有关,现以最简单的反应来说明反应处与温度的关 系。设反应物R有:个摩尔,经化学反应后变成P个摩尔的生成物P,即:R→P,反应 给应等于R变到P过程中系统的烙的减少,即,: △H:=△H,-△H.ePah,-rAa. △H:随盗度的变化为: (1-2) 由定压比热的定义得, a-vem (1-3) 这就是说反应给随温度的变化率等于定压下反应物和生成物的比热差,这个关系膏之为蕃尔 荷夫(Kirchof)定律。积分式(1-3)得 △H-pc-rC,)dr+Him 「T (1-4) 其中AHa,可根据生成给算得。C、C:随温度的变化可查有关物性表,这样可由式(1 4)计算任意温度下的反应给

g 若C,和C与温度无关,则: AH=(PC-rC)(T -298)+ (1-5) Kirehoff定律可以进一步推广到反应物和生成物多于一种的反应系统中去,若反应为: A+B+C+M+N+O+… 这时只要将比热取为平均值即可,即: C=xCa+xC+…=∑x,C C=x.Cp+×,C+…=∑xC 其中、x,(S=A、B、C,K=M、N、O…)分别为第S种和K种成分的摩尔相对 浓度。 例:计算水在90℃时的反应。假定初始的混合物是按化学当量混合的。且C=a+ b7,对H来说4=6.94,6=-0.2×10对0,*说a=6.09,6=3.25×10。 解:由表1-1知,在标准情况下水的反应烙为68.32k©al/mol。初始混合物为:H,+ 0,因货:-昌最终混合物为H0,所以1。于是:方员,号 C=号(6.94-0.2×10T)+(6.09+3.25×10-T) =6.G4-0.00024Tcal/(mol.K) C=C18 cal/(mol.K) pC-rC=18-26.64-0.00024T)=8.04+0.00036T 代入式(1-4)得: △H=-67,782kea1 反应给还与其物理状态有关。例如氧与氢反应生成水,生成的水可以是汽态,也可以是 液态,这取决于温度。表1-1列出了液态水和汽态水的生成给值。表1-1中的其他各项也指 出了△,值与产物的状态有关。表1-3表明燃料的燃烧热△h。也和它的状态有关。例如: H2+0,-→H:(液态),△,=-68.31kca1 如果产生的水是蒸汽状态,我们必须将蒸发给加到H,0(液)的生成.上去,即: H,0(液)→H,0(汽),6an=10.52kca1 根据盏斯定律(见下节)有: ,+20,一→H,0(,44,=-57.79kal 11.8烧热(然烧给)
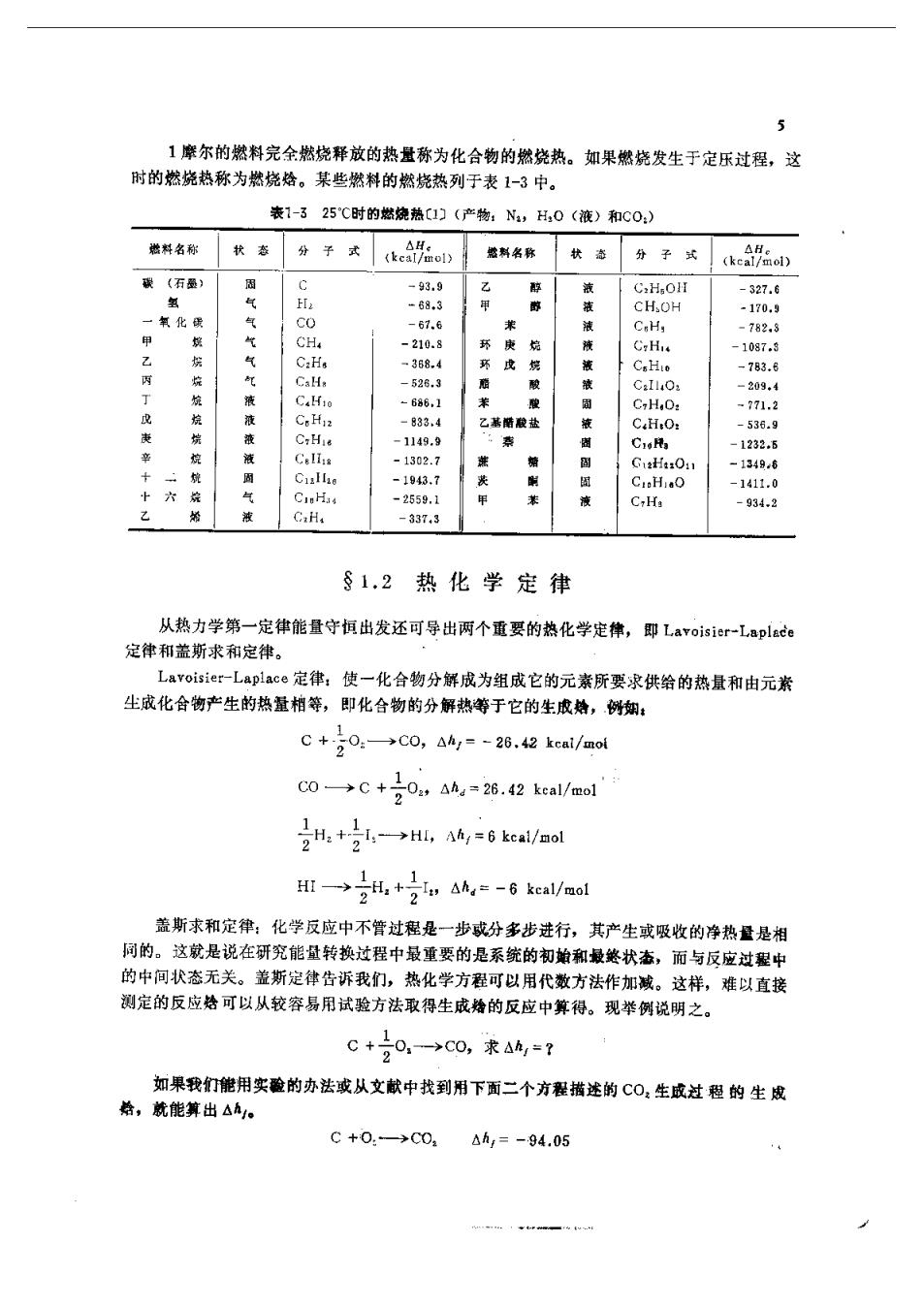
5 1摩尔的燃料完余燃烧释放的热量称为化合物的燃烧热。如果燃烧发生于定乐过程,这 时的燃烧热称为燃烧格。某些燃料的燃烧热列于表1-3中。 表1-325℃时的燃烧热C1)(产物:N,0(液)和C0: 名称秋老分子式合料名路款分子e。 -327.6 氧化安 c -170. 气气 CH =210. C.H. 10 368. CH 783.6 C.H. 209 C.H -833. c,H.0 1149.9 CaRa 1232 10 -2559.1 C.H. C.H -337,3 §1.2热化学定律 从热力学第一定律能量守恒出发还可导出两个重要的热化学定律,即Lavoisier--Laplade 定律和盖斯求和定律。 Laroisier一Laplace定律:使一化合物分解成为组成它的元素所要求供给的热量和由元素 生成化合物产生的热量柏等,即化合物的分解热等于它的生成蜂,例蜘: C+号0:→C0,△4g=-26.42kcai/aol C0→C+号0,Ana=26.42kcal/mol 一→,+2,AA,=-6 keal/mol 盖斯求和定律:化学反应中不管过程是一步成分多步进行,其产生或吸收的净热量是相 同的。这就是说在研究能量转换过程中最重要的是系统的初蜘和最终状杰,而与反应过程中 的中间状态无关。盖斯定律告诉我们,热化学方程可以用代数方法作加减。这样,难以直接 测定的反应烙可以从较容易用试验方法取得生成婚的反应中算得。现举例说明之。 C+20,-→C0,求Ah,=? 如果我们能用实酸的办法或从文献中找到用下面二个方程描述的C0:生成过程的生成 给,就能算出△五。 C+0.-→C0.△h,=-94.05 y-

6 c0+20,一00: △H,=-67,62 两式相碱得, C+0.-c0-20→c0,-C0-94,05+7.62 即 c+20,→c0-26.43 △h1=-26:43 盖斯定律的另一个用处就是根据已知的各反应物和生成物的燃烧给来求出反应络。例 如 C,H+H→C,H,求△H=? 从表1-3中查得乙桶、氢和乙烷的燃烧热在标准温度下分别为-337.3、-68.3和-368.4kcl, 写出下列三个燃烧方 CH,+30,-→2C02+2H,0,k,=-337.3kca .>H,Ah=-68.3 keal CH+20,→2C0+3H,0,A4,=-383.4kca 若用头二个方程的和减去第三个方程,则得: CaH,+H:>CH,=-37.2 keal §1.3热力学平衡与自由能,化学平衡与反应自由能 热力学平衡意味着系统的各参数保持恒定并均匀分布,判别热力学系统是否能达到平衡 状态,可由热力学第二定律米描写。由热力学第一定俸知, dg=de+pdo 对于不可逆过程,则根据热力学第二定律有: s>兽 Tds>de+pdo de +pdo-Tds<0 对于定压、定温过程,上式可改写成: d (e+po-TS)n<0 d(h -TS).< f=A-TS-一吉布斯(Gbbs)自由能 (d<0 因此等温等压过程总是向自由能减小的方向进行。当过程达到平衡状态时,则自由能为最小, 这时(d,=0,因而在等温等压下热力学平衡的条件可以写成(d…=0。这个判捌式 可以推广到化学平衡中去,这时必须定义一个“反应自由能”。对于标准反应自由能的定义可