
,72 上海交通大学“九五”重点教材 燃烧理论基础 周校平张晓男编著 阳 A0949676 上海交通大学出版社

内容提要 本书以动力设备中的燃烧现象为研究对象,详细介绍了燃烧中的化学热力学及燃烧物理化学 问题。就液态、气态、固态燃料的着火、火焰传播及燃烧产物的组分构成进行了讨论。本书可供动 力与能源二程部门的工程技术人员阅读,亦可作为大专院校热能与动力机械专业的教学用书。 图书在版编目(CIP)数据 燃烧理论基础/周校平,张晓男编著.一上海:上海交通 大学出版社,2001 ISBN 7-313-02576-9 I.燃…I.①周…②张…Ⅲ.燃烧理论 IV.0643.2 中国版本图书馆CIP数据核字(2000)第56579号 燃烧理论基础 周校平张晓男编著 上海交通大学出版社出版发行 (上海市番路877号邮政编码200030) 电话:64071208出版人:张天蔚 常熟市印刷二厂印刷全国新华书店经销 开本:787mm×1092mm1/16印张:11字数:269千字 2001年1月第1版2001年1月第1次印刷 印数:1~1250 ISBN7-313-02576-9/0·120定价:18.50元 版权所有侵权必究

前 言 本书是在上海交通大学热能与动力机械工程专业的《动力机械工程燃烧理论 基础》讲义基础上经过近十年的教学实践后修订编写而成。 在本书的编写过程中,我们仍以燃烧现象、燃烧机理为主,加强基础,革新教 材内容,力图反映动力设备中可能涉及到的液态燃料、气态燃料和固态燃料的燃 烧特征。为了学生更全面地了解动力设备中的燃烧特点,必须扩大知识面,因而 本书涉及到燃气轮机、内燃机、锅炉等方面的燃烧专题。但愿本书能作为进一步 深入进行燃烧专题研究的必备参考书。 本书的主要内容包括:燃烧中的化学热力学及燃烧化学问题,燃烧物理学,着 火(自燃与引燃),预混合气体火焰,扩散燃烧与液体燃料的燃烧,气体燃料的喷射 与燃烧,固态燃料的燃烧以及燃烧排放物组分的预测方法等知识。本书按授课54 学时编写,但根据专业具体要求,在内容上可以有所取舍。 本书可作为内燃机、燃气轮机、环境工程、锅炉等专业的教对,亦可作为动力 与能源类专业的教学用书,也可供从事燃烧技术方面实际工作的科技人员参考。 本书由上海交通大学周校平副教授、张晓男教授编著,黄震教授负责主审并 提出了很多宝贵的意见,在此深表感谢。 由于编者水平有限,错误在所难免,欢迎采用本书的师生及广大读者批评 指正。 编著者 2000年10月

第1章燃烧中的化学热力学及燃烧化学问题 1.1概说 人类对火(燃烧)的利用,最早是煮食、取暖、驱赶野兽,火成为人类与自然界斗争的有力工 具。火的使用可以认为是出现人类的标志之一。而后,人类又利用火来烧制陶器、瓷器、砖瓦 炼铜、冶金…成为人类创造辉煌文玥的有力手段。当人类发明火药后,火药又成为工程爆炸 及制作武器的有力工具。自从蒸汽机出现以后,燃烧技术又用于动力工程,使人类的生产力有 了巨大的发展,燃烧技术对于人类最新文化发展占有极其重要的地位。然而,失控的燃烧又会 给自然界及人类带来火灾,燃烧产物给自然界带来有害排放物,污染自然、危害人畜健康及植 物生长等。 迄今为止,燃烧技术或燃烧工程中所用的燃料几乎都是古代动植物遗骸在地壳经过千百 万年演化的结果,它们的储存量,尤其是石油储量是很有限的。20世纪70年代的石油危机曾 对世界能源问题及动力机械的生产等带来巨大的影响。大力改进燃烧技术、提高能量转换效 率,寻求新的节能措施、开辟新的能源以及实现洁净燃烧,降低动力设备的有害排放物等均成 为21世纪初人类面临的重大研究课题。随者我国工业规模的扩大,能源的供求矛盾是十分突 出的。优质能源工业增长速度远小于国民经济总产值增长的速度;尤其是我国人口众多,每个 人所拥有的能源资源远少于某些工业发达国家。这就要求我国的工程技术人员在燃烧技术 节能、开辟新能源等重大科学技术领域作出更多的贡献才能满足我国工业飞速发展的要求。 为此,深人地认识燃烧现象、掌握燃烧机理是与我们所从事的工作有密切联系的,也是我们所 必须具有的专业基础知识的重要组成部分。 燃烧是一种急速、剧烈、发热、发光的氧化反应,它也可被看作是爆炸现象(在一些文献及 教科书中,combustion与xn有同等的意义),在极短的时间内,整个燃烧过程要完成燃料 与氧化剂的混合以形成良好的可燃混合物、急速的燃烧化学反应、释放能量、传播火焰、燃烧产 物的转移等物理的及化学的复杂过程。大多数的燃烧过程都是在气相中进行的,只有固体燃 料的燃烧才有气体与固体的直接反应存在。 近代的动力工程及燃烧工程对燃烧技术的要求都十分严格,要求有极高的空间燃烧率 (space heating rate)一即在单位时间、单位空间中燃烧化学反应的放热率[k/(m子s)],应具有 极高的燃烧效率,同时还应有较清洁的排放物(即有害排放物C0,HC,CO2,NO.,…应尽可能地 满足环境保护法的要求)。当今,由于能源供求间的矛盾日益扩大,愈来愈多地使用代用燃料 及劣质燃料,迫使动力机械工程师们必须加深对燃烧现象的认识和掌握更先进的燃烧技术。 在制备可燃混合物的过程中需涉及到对燃料的物理化学性质认识,需要对流体力学,气体 动力学、传热与传质等学科的知识有一定的了解。为了认识燃烧化学反应过程的一些问题,则 要求有化学热力学、化学反应机理,化学平衡及化学反应动力学的一些基本知识。燃烧过程机 理及燃烧产物能量的应用与燃烧室或炉膛设计有密切的联系

2 燃烧理论基础 由于燃烧的复杂性,人们通常只按照自己的专业需要去研究燃烧中的某一方面的问题 例如: 化学家-一研究燃烧的反应机构、反应速度、反应程度、燃烧产物的生成机理等问题; 执能机战工程师 —研究燃烧设备设计,燃料的燃烧技术及燃烧中的流体力学、传热、传 质等热物理现象,燃烧设备的管理使用,燃烧能量的合理使用等。 1.2化学能与热能的转换 热力学第一定律告诉我们,独立系统中的能量是恒定的,不因其过程不同而变化。燃料与 氧化剂燃烧后变成燃烧产物,将化学能以热能的形式释放也是遵循热力学第一定律的一种转 换方式 燃料燃烧所释放的能量以焓(等压燃烧)或内能(等容燃烧过程)的变化形式表现出来,欲 了解燃烧过程的能量转换的数量关系,就必须了解化学变化过程系统内各种化合物(即反应物 及产物)的岭的数值变化关系 从化学反应的化学平衡原理知道,化学反应常常是在正反两个方向同时进行的。燃料的 燃烧十分复杂,其过程是由多种简单反应组成,而每个简单反应均服从于化学平衡的规律。因 此,燃烧反应并不能使燃料百分之百地进行到底,而总有少量的中间产物存在。这就是为什么 实际燃烧产物比理论产物的组分要复杂得多的原因。这与我们研究燃烧产物的精确组分、有 害排放物的排放量、燃烧产物热力学参数的精确值等密切相关。 近代的热能装置及动力机械(如内燃机、锅炉及涡轮机等)的燃烧都必须在极短的时间内 完成。因而,燃烧反应速度及决定反应速度的反应机构(或机理)必然为工程师们所关注。反 应速度与着火滞燃期、火焰传播速度及燃烧产物的组分构成都有着密切的关系。 1.2.1燃烧反应过程能量转换的数量关系 大多数的燃烧都是在定压或定容条件下进行的。欲了解燃烧过程的能量转换(即燃料的 化学能经燃烧反应释放出热能)就需要了解化合物的生成焙、反应焓及燃烧烙(或反应能、燃烧 能)的意义。 1.化合物的标准生成焓△h 化合物的标准生成焓是由某化合物的构成元素在标准状态下(298K,0.1MPa),经化合反 应生成1mol的该化合物的焓的增量,用△hs(k/mol)来表示。 在化学热力学中讨论焓或内能的变化都是用相对值来计算的,故人为规定所有元素在标 准状态下的标准生成焓均为零。例如: C()+0,(g000,(g, △h8%=-393.505kJ/molC02 当生成焓为负值时,表示所生成的化合物的生成焓的焓值低于其构成元素的生成格值之和,为 放热反应。 如果化合物不是由元素直接反应的生成物,则反应后生成物与反应物间的焙差值不是生 成焓而是反应焓。例如:

第1章燃烧中的化学热力学及燃烧化学问题 3 c0(g)+20,(g)0-0,g △h=-282.965kJ/male 表1-1为标准状态下若干物质的生成焓。 2.反应烩与燃烧焓 当反应是在特定的温度、压力下进行时,反应物(R)与产物(P)具有相同的t、P,产物与反 应物间的焓值之差为该反应的反应焓。各反应物及产物的焓值以其生成焓表示。 如果某化学反应的通用表达式为 (1.1) 则该反应的反应焓△Hr为 (1.2) 式中△H的含义:△表示差值,H表示整个反应物或产物的焓而不是单位:质量的焓值以便 与h相区别,下标R、T分别表示为“反应”及反应温度;:为第i种产物的摩尔数,i=1,2,…, p乃为第j种反应物的摩尔数,j=1,2,,i分别表示第j种反应物及第i种产物。 例如 CH(g)+202(g)→C0z(g)+2H0(I) 其反应焓为 △Ha%=-393.505-2×285.85-74.89=-890.3kJ3 显然,如果反应物为元素,产物为其化合物且质量为1mol,则反应焓就是产物的生成焓 用△H一T图可以清楚地表达反应焓与产物的焓值间的关系。如图1-1所示。图中的曲线 R及P分别代表反应物的焙∑n;Ah品及产物的焓n,△hme SH r△h .(T,) a (b) 图1-1△H-T图 ()成热反应(b)吸热反应 当n△hm)时,为吸热反应。 燃烧焓是反应焓的一种特例,燃烧焓就是单位质量的燃料(不包括氧化剂)作等压燃烧反
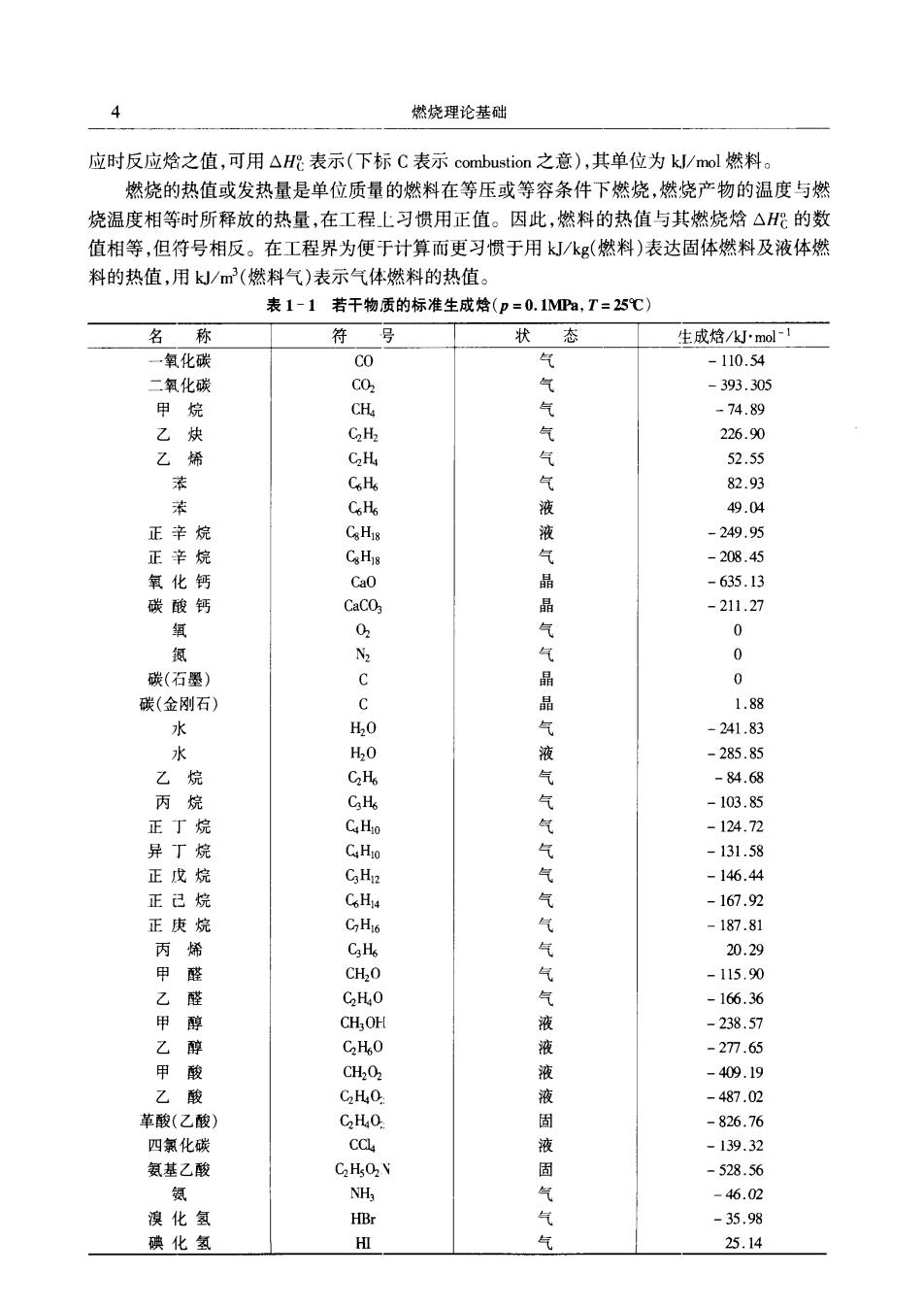
燃烧理论基础 应时反应焓之值,可用△表示(下标C表示combustion之意),其单位为k/mol燃料 燃烧的热值或发热量是单位质量的燃料在等压或等容条件下燃烧,燃烧产物的温度与燃 烧温度相等时所释放的热量,在工程上习惯用正值。因此,燃料的热值与其燃烧烙△的数 值相等,但符号相反。在工程界为便于计算而更习惯于用kJ/k(燃料)表达固体燃料及液体燃 料的热值,用k/m(燃料气)表示气体燃料的热值。 表1-1若干物质的标准生成焓(p=0.1MP,T=25℃) 名 称 符 县 状态 生成焓/k·ol1 每化碳 co .110.54 -393.305 烷 CH -74.89 乙炔 C2Hz 226.90 乙烯 52.55 战 气液 正辛 Ca -249.95 正辛烷 s -208.45 -635.13 晶气 -211.27 0 碳(石墨) 0 碳(金刚石) 1.88 水 品气液 2418 -285.85 -84.68 -10385 正昇 丁 -124.7 气气 -131.58 正 -146.4 己烷 -167.92 正庚烷 187.81 丙甲 气气气 20.29 -15.0 -166.36 醇 CHOH -238.57 甲乙 酸酸 C.HO 液 .277.65 液液 409. 革酸(乙酸 -826.76 四氯化碳 8 -139.32 氨基乙酸 -528.56 气气 碘化氢 HI 25.14
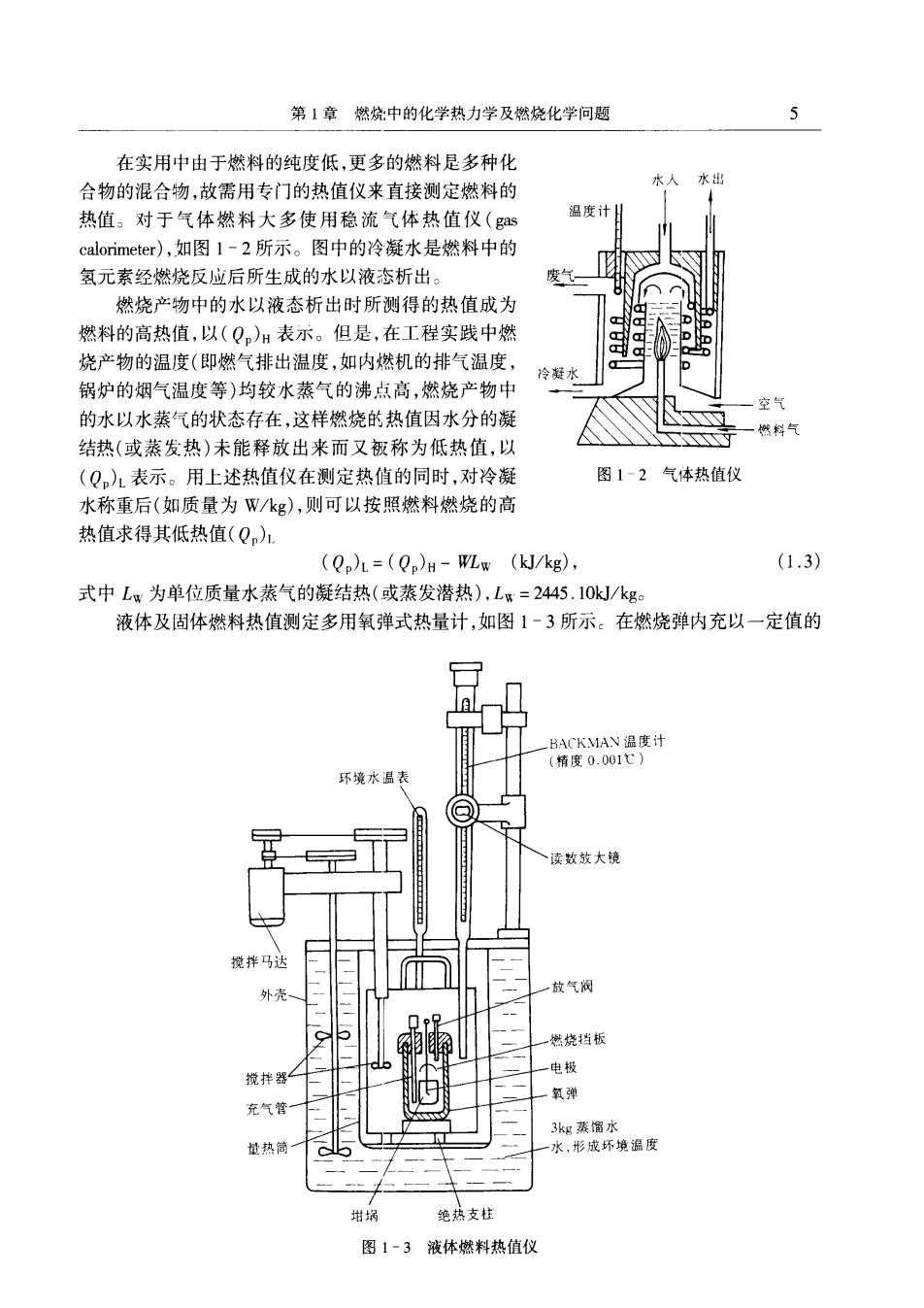
第1章燃烧中的化学热力学及燃烧化学问题 在实用中由于燃料的纯度低,更多的燃料是多种化 合物的混合物,故需用专门的热值仪来直接测定燃料的 水出 热值。对于气体燃料大多使用稳流气体热值仪( 温度计 calorimeter)),如图1-2所示。图中的冷凝水是燃料中的 氢元素经燃烧反应后所生成的水以液态析出。 燃烧产物中的水以液态析出时所测得的热值成为 燃料的高热值,以(Q)H表示。但是,在工程实践中燃 烧产物的温度(即燃气排出温度,如内燃机的排气温度 锅炉的烟气温度等)均较水蒸气的沸点高,燃烧产物中 的水以水蒸气的状态存在,这样燃烧的热值因水分的凝 结热(或蒸发热)未能释放出来而又板称为低热值,以 (Q,)1表示。用上述热值仪在测定热值的同时,对冷凝 图1-2气体热值仪 水称重后(如质量为Wkg),则可以按照燃料燃烧的高 热值求得其低热值(Q)1 (Q)L=(Qp)H-WLw (kJ/kg). (1.3) 式中L为单位质量水蒸气的凝结热(或蒸发潜热),Lx=2445.10k/kg 液体及固体燃料热值测定多用氧弹式热量计,如图1-3所示:在燃烧弹内充以一定值的 环境水温表 读数蚊大镜 放气阀 燃烧板 电极 戏拌器 氧弹 充气管 量热 绝热支柱 图1-3液体燃料热值仪

6 燃烧理论基础 氧气及燃料,燃料放置在氧弹中的坩埚内,氧弹外充以定量的水,整个热值仪的热容量为已知 用电火花引燃。燃料在充满氧气的环境下完全燃烧,从水及热值仪的温升可以计算出燃料燃 烧所发出的热量,从而计算出燃料的热值。由于燃烧物中的水均凝结为液体,故所测得的热值 为定容燃烧的高热值(Q,).同理,可以求得被测燃料的定容低热值为: (Qv)L.=(Qv)-WLw (kJ/kg), (1.4) 由于此试验装置不能直接测得凝结水的质量W,可从燃料成分中H的质量百分比计算求得: F=Muox号(kg,0/kg燃料)。 (1.5) 式中:Mo为氧弹中被测燃料的燃烧反应产生的水的分子量;gH为燃料中H的质量百分比 液体燃料及固体燃料的热值可以按燃料中的组成元素的质量百分数近似地按下式计算 低热值: Q1=4.186x[8100gc+29000(gH-go/8)+2200gs-600gw](kJ/kg), (1.6 高热值: QH=4.186×[8100gc+34400(gH-go/8)+2200gs】(kJ/kg), (1.7) 式中:gC,gH,go,gs,g,分别为燃料中的碳,氢,氧,硫,水的质量百分比。 3.反应焓(及燃烧焓)与反应能(及燃烧能)的比较 从焓的定义可知 h=u+pv, 对于一个反应而论,则有 △HR=△UR+△u=△UR+△nRRT, (1.8) 式中:△UR为反应能;△R为反应后的产物与反应前反应物间分子数的变化;R为通用气体 常数:T为反应温度。 在温度298K时,RT=8.3引4×298=2477.6J/kml=2.48kJ/mol,且因然烧前后的摩尔数 变化不大,以辛烷CgH2为例,然烧反应后△nR=3.5,△nRRT=8.68kJ/mal=76J/kgCsH2,与其 燃烧焓-47837.7J/kg相比,△nRT项其值甚微,在工程上可近似认为 △HR≈△UR, (1.9) 即反应焓(或燃烧焓)与反应能(或燃烧能)近似相等。因而在工程上考虑实测热值Q。及Q, 时常常不加以区别,并将燃烧焓及燃烧能统称燃烧热 4.反应焓(或燃烧焓)与温度的关系 由于燃烧反应多不是在标准状态下进行,如内燃机中开始着火的温度范围为: 汽油机 300℃(573K500℃773K): 柴油机 500℃(773K)-900℃1173K)。 因此在精确计算其热值(或燃烧热)时就必须考虑反应温度的影响,即需要知道反应焓与 温度间的关系。 设燃烧反应为 rR-DP. (1.10) 式中P各为反应物和产物的摩尔数,反应焓与温度的关系可写成 =parT)-7aA(T】=p-,h dT dT -=pCpp-repR

第1章燃烧中的化学热力学及燃烧化学问题 积分后可得 ahu-△Hr-(ep-ed7=p时sd7-dr=paho-7a 可得 △HRr,=△HRr,+(p△hp-rAhR)。 (1.11) 式中:T、T2分别为状态1及2时的温度;△hR,△h,分别为反应物及产物由T1到T2时的显 焓的增值,如图1-1中cd所示。 至此,由生成焓,反应焓及燃烧焙的定义可知,当燃烧反应进行得十分完全时的化学能与 热能的转换关系,化合物及元素的生成焓都含有化学能在内。尽管人们在定义生成焓时有相 对值的概念,而反应焓及燃烧焓却表达了由于化学变化过程所释放或吸收的热能 1.2.2化学平衡与平衡常数一一化学反应过程问题的讨论 作为化学反应的一种情况一—燃烧反应是否能使燃料百分之百地变成理想的最终产物 呢?通过下面的学习来分析这个问题。 1.化学平衡与平衡常数 各种化学反应都同时存在着正反两个方向的反应,即 aA+bB点cC+dD. (1.12) 在特定的温度、压力条件下必然会只有一种平衡状态出现,这时正向反应与逆向反应的速度相 等在反应系统内同时存在着A,B,CD四种化合物。这也就是说,在反应开始时我们只在系 统内放置了适当数量的反应物aA及bB,A与B之间立即按式(1.12)朝右方向反应,产生出产 物C及D。一旦C,D在系统中出现后它们之间就按式(1.12)所示的逆方向(向左)进行反应, 在这样的动态反应过程中,系统中A及B的浓度不断减弱,C及D的浓度不断增加。 反应速度:反应速度(对反应物是消耗速度,对产物是生成速度)的定义为: 反应物A的消耗速度 =d[A] dt 反应物B的消耗速度 ra=d[B] dt 产物C的生成速度 dt 产物D的生成速度 o=d[D] (1.13) 式中[]表示各种物质的浓度。 由于反应是按式(1.12)进行的,各反应物与产物的反应速度应符合该式所表达的计量关 系,即 (1.14) adt bdt r被称为式(1.12)的化学反应速度。显然,反应系统中各化合物的反应速度分别为 ∫rA=-ar,rB=-br, (1.15) (rc=cr,ro=dro 从质量作用原理可知,式(1.12)的瞬时反应速度为: