
第六章配位滴定法(compleximetry)第一节概述配位滴定法是以形成配位化合物反应为基础的滴定分析法。配位反应具有极大的普遍性。多数金属离子在溶液中以配位离子形式而存在,但只有具备滴定分析条件的配位反应才能用于滴定分析。YOUR
第六章 配位滴定法 (compleximetry) 第一节 概述 配位滴定法是以形成配位化合物反应为基础 的滴定分析法。配位反应具有极大的普遍性。多 数金属离子在溶液中以配位离子形式而存在,但 只有具备滴定分析条件的配位反应才能用于滴定 分析

滴定分析对反应的要求确定的化学计量关系X反应必须定量完成(99.9%以X上)?反应必须迅速完成有合适的确定终点的方法XYOUR
滴定分析对反应的要求 ❖ 确定的化学计量关系 ❖ 反应必须定量完成(99.9%以 上) ❖ 反应必须迅速完成 ❖ 有合适的确定终点的方法

配位剂无机配位剂形成简单配位化合物,稳定常数小,各相邻化合物稳定性无显著性差别有机配位剂氨羧配位剂以氨基二乙酸为基体,含有氨氮和羧氧配位原子,应用最广是乙二氨四乙酸(ethylenediaminetetraaceticacidEDTA)YOUR
配位剂 有机配位剂 氨羧配位剂以氨基二乙酸为基体,含有氨 氮和羧氧配位原子,应用最广是乙二氨四乙 酸(ethylenediamine tetraacetic acid, EDTA) 无机配位剂 形成简单配位化合物,稳定常数小,各相 邻化合物稳定性无显著性差别
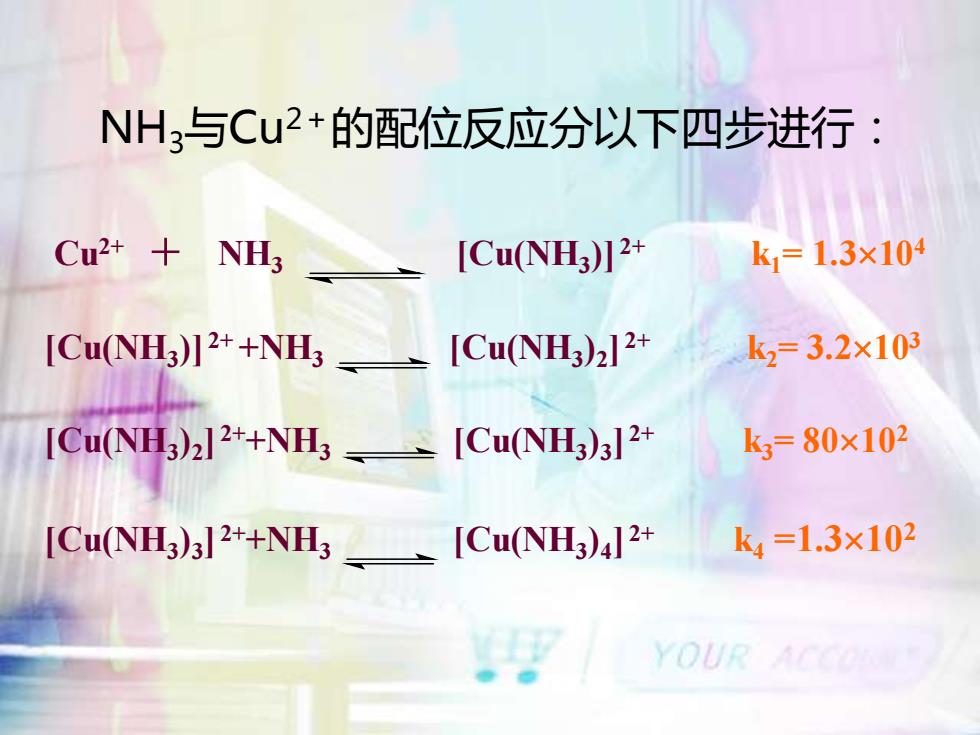
NH3与Cu2+的配位反应分以下四步进行:Cu2+ +k= 1.3x104NH3[Cu(NH3)]2+[Cu(NH3)2] 2+kz=3.2x103[Cu(NH3)] 2+ +NH3 ks=80x102_ [Cu(NH3)3]2+[Cu(NH3)2]2++NH3 -k4=1.3x102[Cu(NH3)4]2+[Cu(NH3)3] 2++NH3YOUR
NH3与Cu2+的配位反应分以下四步进行: Cu2+ + NH3 [Cu(NH3 )] 2+ k1= 1.3104 [Cu(NH3 )] 2+ +NH3 [Cu(NH3 )2 ] 2+ k2= 3.2103 [Cu(NH3 )2 ] 2++NH3 [Cu(NH3 )3 ] 2+ k3= 80102 [Cu(NH3 )3 ] 2++NH3 [Cu(NH3 )4 ] 2+ k4 =1.3102
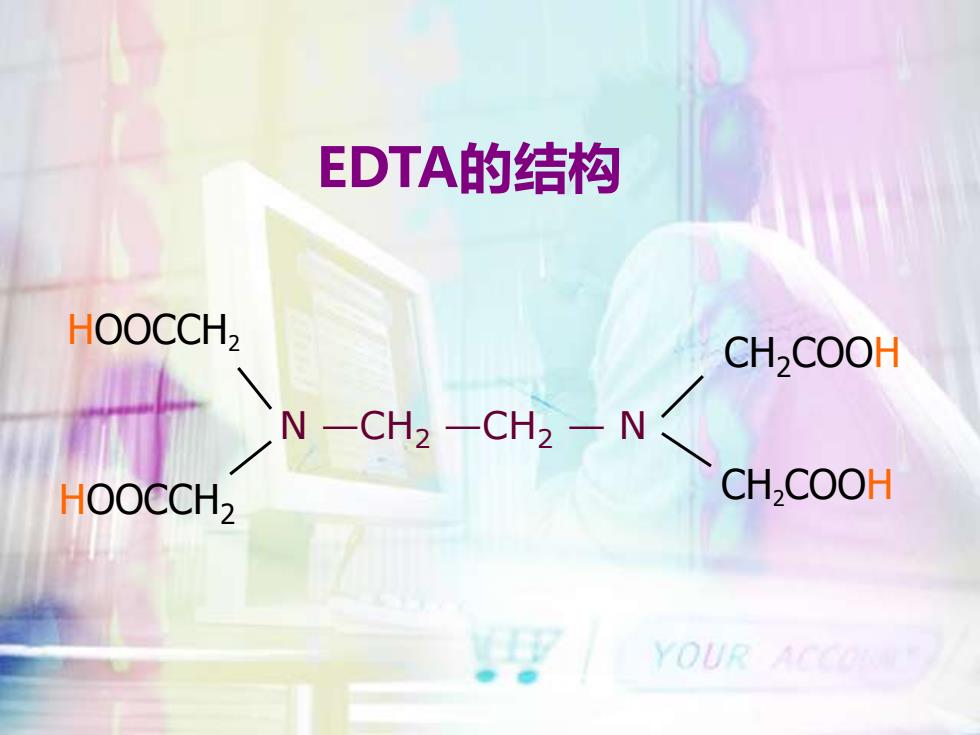
EDTA的结构HOOCCH2CH2COOHN —CH2 —CH2 — NCH,COOHHOOCCH2YOUR
EDTA的结构 N —CH2 —CH2 — N HOOCCH2 HOOCCH2 CH2COOH CH2COOH

EDTA配合物有如下特点:稳定性高(五元环)反应速度快配位比简单(1:1)水溶性大多为无色YOURA
EDTA配合物有如下特点: ✓ 稳定性高(五元环) ✓ 反应速度快 ✓ 配位比简单(1︰1) ✓ 水溶性大 ✓ 多为无色

第二节基本原理配位平衡(一)稳定常数与累积稳定常数金属离子与EDTA的反应通式为:M+Y === MY反应的平衡常数表达式为:[MY]KM ={MI)YOUR
第二节 基 本 原 理 一、配位平衡 (一)稳定常数与累积稳定常数 金属离子与EDTA的反应通式为: M+Y === MY 反应的平衡常数表达式为: KMY MY M Y = [ ] [ ][ ]
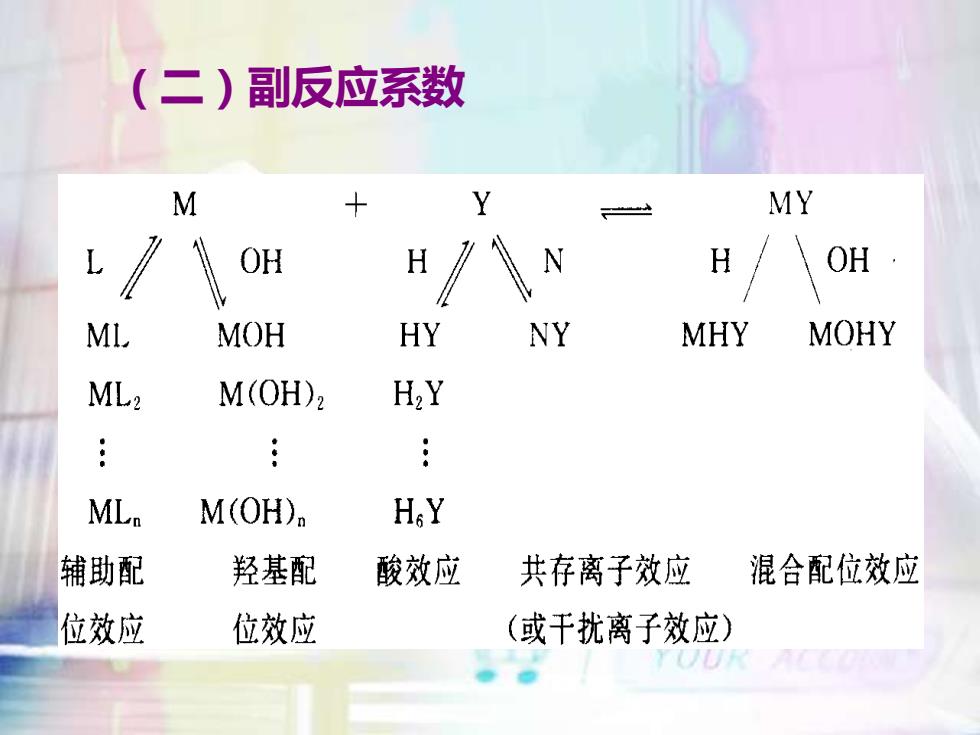
(二)副反应系数MY+MY2-HOHOHLHNMIHYNYMHYMOHYMOHML?H,YM(OH)2...::ML.H,YM(OH),辅助配酸效应羟基配共存离子效应混合配位效应位效应位效应(或干扰离子效应)@
(二)副反应系数

1、配位剂的副反应系数α=[Y'] [Y]未与M配位的EDTA各种型体的总浓度一天能与M配位的游离EDTA(Y4-)的浓度配位剂的副反应主要有酸效应和共存离子效应分别用αy(H)和αY(N)来表示。YOUR
Y = [Y]/ [Y] [Y] — 未与M配位的EDTA各种型体的总浓度 [Y] ⎯ 能与M配位的游离EDTA(Y4-)的浓度 配位剂的副反应主要有酸效应和共存离子效应, 分别用y(H)和Y(N)来表示。 1、配位剂的副反应系数

酸效应系数αy(H)1由于H+的存在,H+与Y之间发生副反应使Y参加主反应能力降低的现象称作酸效应。酸效应的大小用酸效应系数αy(H)来衡量。YOURA
① 酸效应系数y(H) 由于H+的存在,H+与Y之间发生副反应, 使Y参加主反应能力降低的现象称作酸效 应。酸效应的大小用酸效应系数y(H)来 衡量