
第一章热力学第一定律 本章目录 1-1热力学基本概念 1-7化学反应的热效应 1-2热和功 1-8热化学基本定律及 1-3热力学第一定律 反应热效应的计算 1-4焓 1-9反应热效应与温度 1-5热容 的关系 1-6焦耳-汤姆逊效应 1-10可逆过程与最大功 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 第一章 热力学第一定律 本章目录

第一 热力学第一定精 热力学是研究热和其他形式能量间相互转化的 规律。其基础是热力学第一定律和热力学第二定律。 热力学第一定律 1850年,Joule提出,主要研 究热和其他形式能量在变化过程中相互转化的守 恒关系。 热力学第二定律1848年和1850年分别由开尔文 和克劳修斯建立,主要研究热和其他形式能量相互 转化的方向性问题。 上页 页 回主目录 返回 2024年9月5日
2024年9月5日 第一章 热力学第一定律 热力学是研究热和其他形式能量间相互转化的 规律。其基础是热力学第一定律和热力学第二定律。 热力学第一定律 1850年,Joule提出,主要研 究热和其他形式能量在变化过程中相互转化的守 恒关系。 热力学第二定律 1848年和1850年分别由开尔文 和克劳修斯建立,主要研究热和其他形式能量相互 转化的方向性问题

热力学第一定律 热力学在化学过程的应用,就形成了化学热力学, 主要解决两大问题: (1)化学过程中能量转化的衡算 (2)判断化学反应进行的方向和限度 热力学方法的局限性: (1)热力学研究的是宏观体系 (2)仅表示反应的可能性 上页 下夏 回主目录 返 2024年9月5日
2024年9月5日 热力学在化学过程的应用,就形成了化学热力学, 主要解决两大问题: (1) 化学过程中能量转化的衡算 (2) 判断化学反应进行的方向和限度 热力学方法的局限性: (1) 热力学研究的是宏观体系 (2) 仅表示反应的可能性 热力学第一定律

§1-1热力学基库机念 体系与环境(system and surrounding) 在热力学中,为了明确讨论或研究的对象,常 常将所研究的一部分物质或空间与其余的物质和空 间分开,构成体系;与体系相联系的其他部分称为 环境。 体系可以是实际存在的,也可以是想象的。体系 与环境间的界面可以是真实的界面,也可以是虚构的 界面。 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 一 体系与环境(system and surrounding) 在热力学中,为了明确讨论或研究的对象,常 常将所研究的一部分物质或空间与其余的物质和空 间分开,构成体系;与体系相联系的其他部分称为 环境。 体系可以是实际存在的,也可以是想象的。体系 与环境间的界面可以是真实的界面,也可以是虚构的 界面。 §1-1 热力学基本概念

一、休素多球坑 根据体系与环境的关系可将体系分为三种: (1)敞开体系(open system) 体系与环境间既有物质交换,又有能量交换; (2)封闭体系(closed system) 体系与环境间只有能量交换; (3)孤立体系(isolated system) 体系与环境既无物质交换也无能量交换。 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 根据体系与环境的关系可将体系分为三种: (1)敞开体系(open system) 体系与环境间既有物质交换,又有能量交换; (2)封闭体系(closed system) 体系与环境间只有能量交换; (3)孤立体系(isolated system) 体系与环境既无物质交换也无能量交换。 一、体系与环境
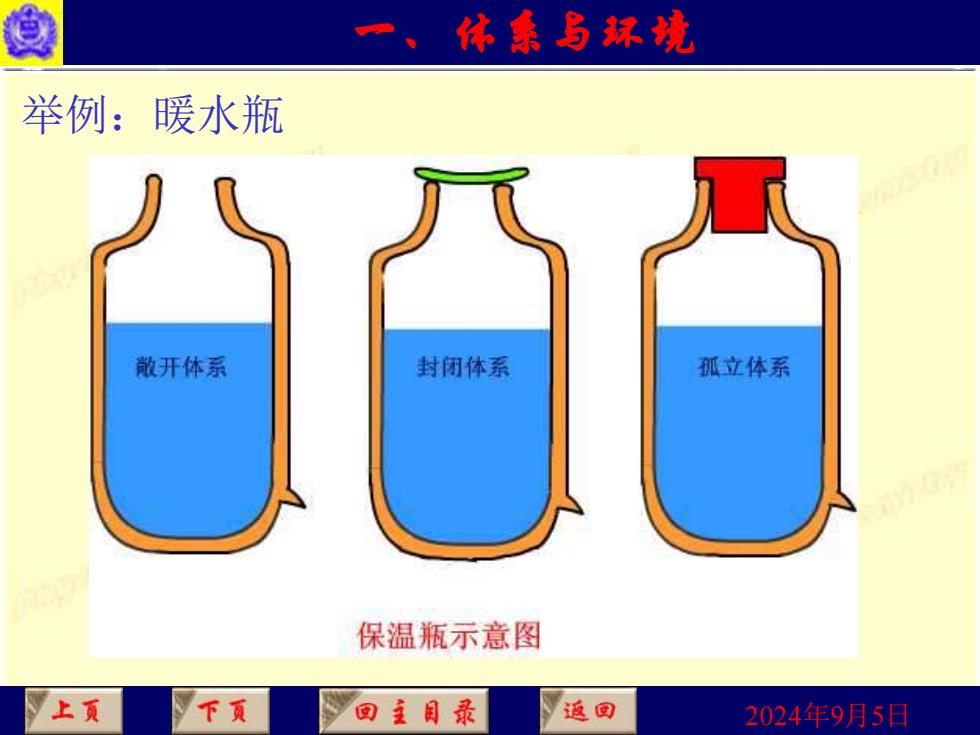
身 一、依素多环坑 举例:暖水瓶 散开体系 封闭体系 孤立体系 保温瓶示意图 上 下页 回主目录 返回 2024年9月5日
2024年9月5日 举例:暖水瓶 一、体系与环境

二、体系的次态和性质 1.热力学平衡态 体系处于某种状态,是指热力学平衡态,它同时 要满足下列四种平衡: (1)机械平衡(mechanical equilibrium) 体系内部各处压力相等,同时与环境的压力相等。 如果体系与环境被刚壁隔开,则可以不考虑环境的压力。 (2)热平衡(thermal equilibrium) 体系内部各处温度相等。 上页 下页 回主目录 返国 2024年9月5日
2024年9月5日 1.热力学平衡态 体系处于某种状态,是指热力学平衡态,它同时 要满足下列四种平衡: (1) 机械平衡(mechanical equilibrium) 体系内部各处压力相等,同时与环境的压力相等。 如果体系与环境被刚壁隔开,则可以不考虑环境的压力。 (2) 热平衡(thermal equilibrium) 体系内部各处温度相等。 二 、体系的状态和性质

体素的状态和性质 (3)化学平衡(chemical equilibrium) 体系组成不随时间变化 (4)相平衡(phase equilibrium) 各相组成不随时间变化。 上述平衡条件中任何一个得不到满足,则体系处 于非平衡态。 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 (3) 化学平衡(chemical equilibrium) 体系组成不随时间变化 (4) 相平衡(phase equilibrium) 各相组成不随时间变化。 上述平衡条件中任何一个得不到满足,则体系处 于非平衡态。 体系的状态和性质

体系的状态和性质 2广延性质和强度性质 (I)广延性质(extensive properties) 也称容量性质其数值与体系中物质的量成正比,如: 质量,体积,内能等。广延性质具有加和性。 (2)强度性质(intensive properties). 其数值与体系中物质的量无关,如:温度、压力、 密度等。强度性质不具有加和性。广延性质除以质量 或物质的量就成为强度性质。 上页 下夏 回主目录 返回 2024年9月5日
2024年9月5日 (1)广延性质(extensive properties) 也称容量性质其数值与体系中物质的量成正比,如: 质量,体积,内能等。广延性质具有加和性。 (2) 强度性质(intensive properties) 其数值与体系中物质的量无关,如:温度、 压力、 密度等。强度性质不具有加和性。广延性质除以质量 或物质的量就成为强度性质。 体系的状态和性质 2 广延性质和强度性质

体豪的状态和性质 3.状态和状态函数 物理性质和化学性质的综合表现就称体系的状态。 描述物质状态的性质叫做状态函数(state function)。 状态函数是相互联系,相互制约,一个状态函数的改变, 也会引起另一个状态函数的改变。 由经验可知,一般来说,质量一定的单组分均相体系,只 需要指定两个状态函数就能确定它的状态。另一个通过 PV=RT的关系也就随之而定了,从而体系的状态也就确 定了。 下页 回主目录 返国 2024年9月5日
2024年9月5日 3.状态和状态函数 物理性质和化学性质的综合表现就称体系的状态。 描述物质状态的性质叫做状态函数(state function)。 状态函数是相互联系,相互制约,一个状态函数的改变, 也会引起另一个状态函数的改变 。 由经验可知,一般来说,质量一定的单组分均相体系,只 需要指定两个状态函数就能确定它的状态。另一个通过 PV=nRT的关系也就随之而定了,从而体系的状态也就确 定了。 体系的状态和性质