
第八章芳香化合物 上一页下一页少 返回
第八章 芳香化合物

一.芳香烃及芳香性 二苯的结构 三.价键理论对苯结构的处理 四分子轨道理论对苯结构的处理
一.芳香烃及芳香性 二.苯的结构 三.价键理论对苯结构的处理 四.分子轨道理论对苯结构的处理

一、芳香烃及芳香性 1.芳香烃 苯及其同系物、多苯环物及衍生物构成芳香族碳 氢化合物简称芳香烃或芳烃。 2.芳香性 芳香烃比较稳定,苯环较容易进行取代反应,不 容易进行加成反应和氧化反应,称为芳香性。 3. 非苯芳烃 分子中不含苯环,但有芳香性的碳氢化合物称 为非苯芳烃 返回
一、芳香烃及芳香性 1. 芳香烃 苯及其同系物、多苯环物及衍生物构成芳香族碳 氢化合物简称芳香烃或芳烃。 2. 芳香性 芳香烃比较稳定,苯环较容易进行取代反应,不 容易进行加成反应和氧化反应,称为芳香性。 3. 非苯芳烃 分子中不含苯环,但有芳香性的碳氢化合物称 为非苯芳烃
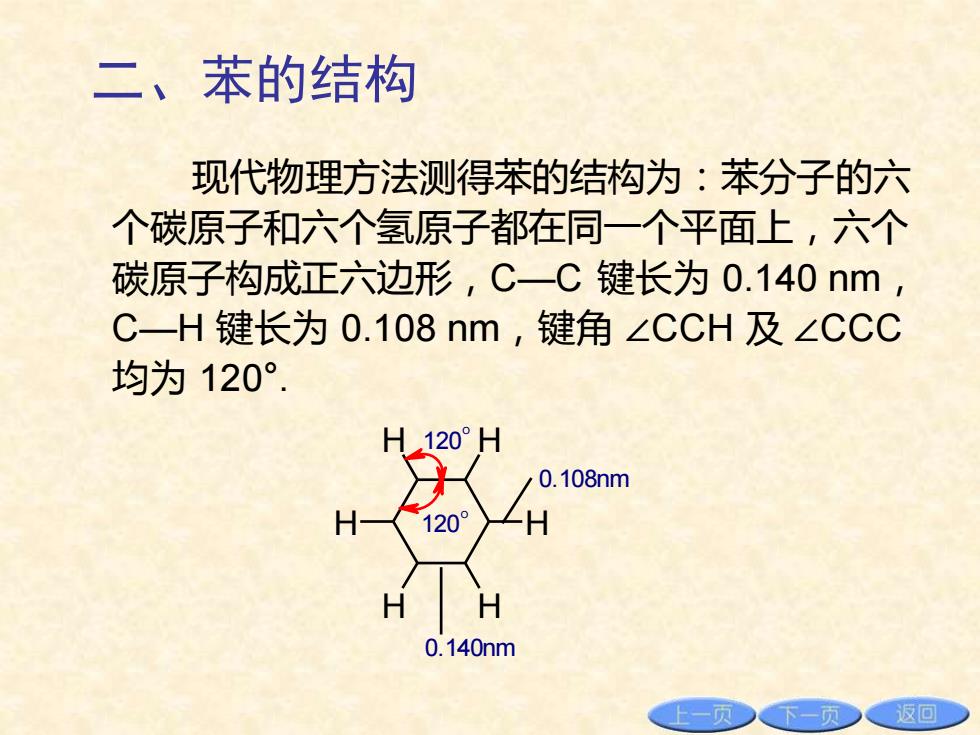
二、苯的结构 现代物理方法测得苯的结构为:苯分子的六 个碳原子和六个氢原子都在同一个平面上,六个 碳原子构成正六边形,C一C键长为0.140nm, C一H键长为0.108nm,键角∠CCH及∠CCC 均为120°. H120°H 0.108nm H 1209 ZH H 0.140nm 上一页下一页少返回
二、苯的结构 现代物理方法测得苯的结构为:苯分子的六 个碳原子和六个氢原子都在同一个平面上,六个 碳原子构成正六边形,C—C 键长为 0.140 nm, C—H 键长为 0.108 nm,键角 ∠CCH 及 ∠CCC 均为 120°. H H H H H H 120O 120O 0.108nm 0.140nm
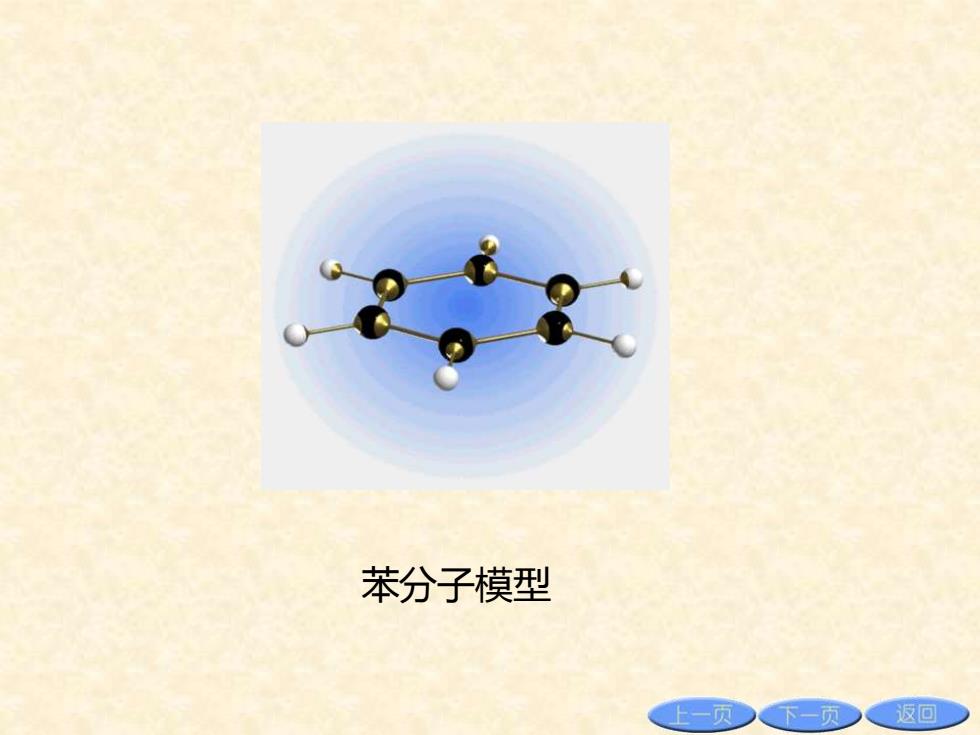
苯分子模型 上一页 下一页 返回
苯分子模型
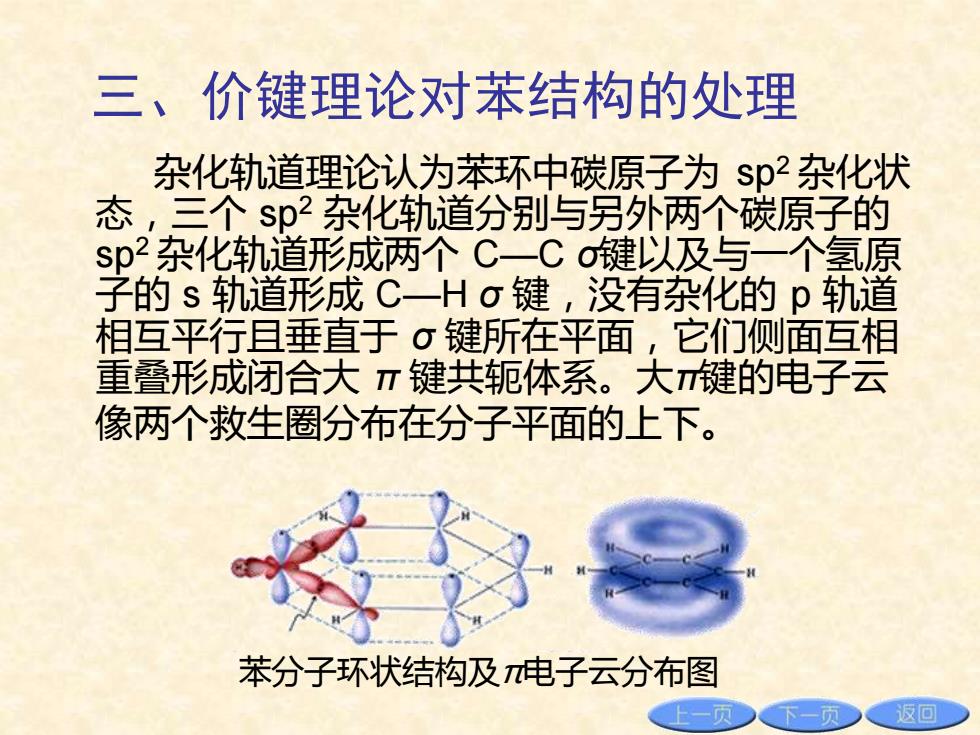
三、价键理论对苯结构的处理 杂化轨道理论认为苯环中碳原子为sp2杂化状 态,三个$p杂化轨道分别与另外两个碳原子的 sp杂化轨道形成两个C一Co键以及与一个氢原 子的s轨道形成C一Hσ键,没有杂化的p轨道 相互平行且垂直于σ键所在平面,它们侧面互相 重叠形成闭合大π键共轭体系。大键的电子云 像两个救生圈分布在分子平面的上下。 苯分子环状结构及电子云分布图 返回
三、价键理论对苯结构的处理 杂化轨道理论认为苯环中碳原子为 sp2 杂化状 态,三个 sp2 杂化轨道分别与另外两个碳原子的 sp2 杂化轨道形成两个 C—C σ键以及与一个氢原 子的 s 轨道形成 C—H σ 键,没有杂化的 p 轨道 相互平行且垂直于 σ 键所在平面,它们侧面互相 重叠形成闭合大 π 键共轭体系。大π键的电子云 像两个救生圈分布在分子平面的上下。 苯分子环状结构及π电子云分布图

1865年,德国化学家凯库勒提出苯的构造式, 苯环中双键可以不停地变动: 共振论认为苯的结构是两个或多个经典结构的 共振杂化体: 苯的氢化热比假想的1,3,5-环己三烯的低150 kJ-mol-1,称作共振能或离域能,体现了苯的稳定性。 上一页 返回
1865年,德国化学家凯库勒提出苯的构造式, 苯环中双键可以不停地变动: 共振论认为苯的结构是两个或多个经典结构的 共振杂化体: 苯的氢化热比假想的 1,3,5-环己三烯的低 150 kJ·mol-1,称作共振能或离域能,体现了苯的稳定性。 H H H H H H H H H H H H

四、分子轨道理论对苯结构的处理 分子轨道理论认为,六个碳原子上的六个 p轨道组成六个分子轨道必、必、必、 4、必和6。其中必、必和必是成键 轨道;4、必和6是反键轨道;必和 必,4和必为简并轨道。其能量为 <2=3<Ψ4=5<6。 上一页 下一页 返回
四、分子轨道理论对苯结构的处理 分子轨道理论认为,六个碳原子上的六个 p轨道组成六个π分子轨道ψ1、ψ2、ψ3、 ψ4、ψ5 和 ψ6。其中ψ1、ψ2 和 ψ3 是成键 轨道;ψ4、ψ5 和 ψ6 是反键轨道;ψ2 和 ψ3,ψ4 和 ψ5 为简并轨道。其能量为 ψ1 <ψ2=ψ3<ψ4=ψ5<ψ6
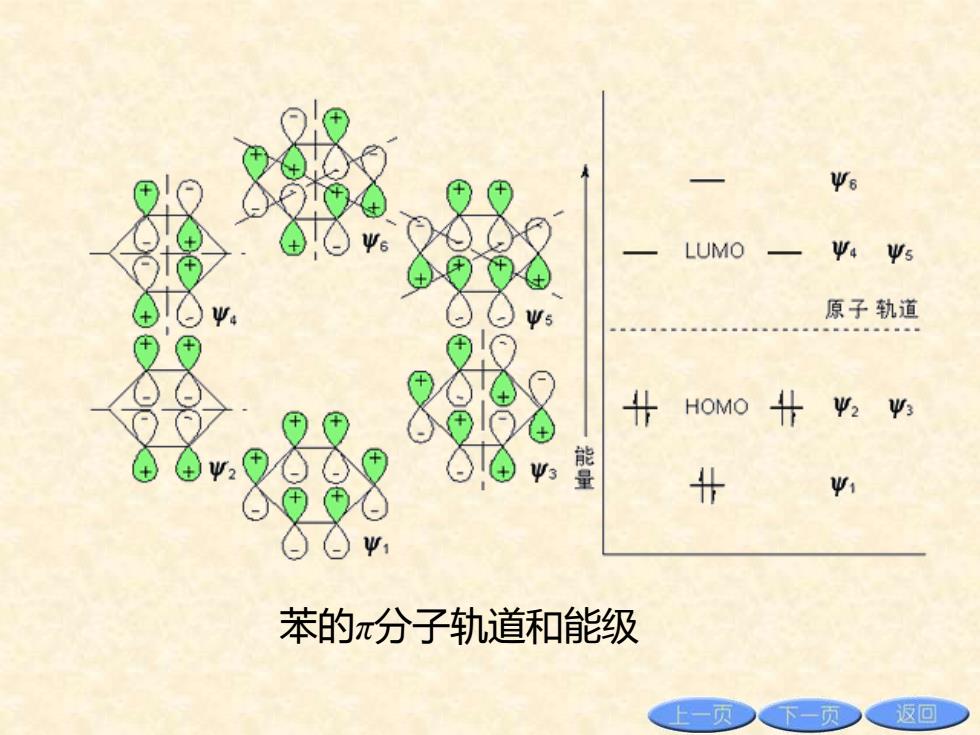
Ψ6 LUMO Ψ4Ψ5 原子轨道 8 HOMO 4 W2 V> ④, 能 北 1 苯的π分子轨道和能级 上一页下一页 返回
苯的π分子轨道和能级

二。单环芳烃的物理性质 一、溶解性 单环芳烃有特殊的气味,蒸气有毒,对呼吸 道、中枢神经和造血器官产生损害。 苯及其同系物多数为液体,不溶于水,易溶于有 机溶剂。二甘醇、环丁砜、N-甲基吡咯烷-2-酮、N, N-二甲基甲酰胺等溶剂对芳烃有很好的选择性溶解。 因此,工业上用它们从烃的混合物中萃取(抽提) 芳烃。 上一页 返回
一、溶解性 单环芳烃有特殊的气味,蒸气有毒,对呼吸 道、中枢神经和造血器官产生损害。 苯及其同系物多数为液体,不溶于水,易溶于有 机溶剂。二甘醇、环丁砜、N-甲基吡咯烷-2-酮、N, N-二甲基甲酰胺等溶剂对芳烃有很好的选择性溶解。 因此,工业上用它们从烃的混合物中萃取(抽提) 芳烃。 二。单环芳烃的物理性质