
第十五章氧族元素
第十五章 氧族元素

15-1卤素的通性 15-1-1氧族存在 在非金属化学中,和卤素一样,为构建元素周期系的大厦起 了非常重要的作用,本族是非金属到金属的完整过渡。 氧(Oxygen)地球含量最多的元素49.13%,“成酸元素”。 硫(Sulfur)古代称“黄芽”,印度梵文“鲜黄色”。 硒(Selenium)贝采利乌斯1817年发现,希腊文“月亮”、因 和碲性质相似,以表示它是碲的姐妹,可做为光敏电阻的理想材 料。 碲(Tellurium)赖兴施泰于1782年发现,原意为“地球”, 因 它在地壳中丰度虽小,却广布于地球表面。 钋Polonium)居里夫人为纪念她的祖国波兰,命名为钋,放射 性元素,半衰期为138.7天
15-1 卤素的通性 15-1-1 氧族存在 在非金属化学中,和卤素一样,为构建元素周期系的大厦起 了非常重要的作用,本族是非金属到金属的完整过渡。 氧(Oxygen)地球含量最多的元素49.13%,“成酸元素”。 硫(Sulfur)古代称“黄芽”,印度梵文“鲜黄色”。 硒(Selenium)贝采利乌斯1817年发现,希腊文“月亮”、因 和碲性质相似,以表示它是碲的姐妹,可做为光敏电阻的理想材 料。 碲(Tellurium)赖兴施泰于1782年发现,原意为“地球”,因 它在地壳中丰度虽小,却广布于地球表面。 钋(Polonium)居里夫人为纪念她的祖国波兰,命名为钋,放射 性元素,半衰期为138.7天
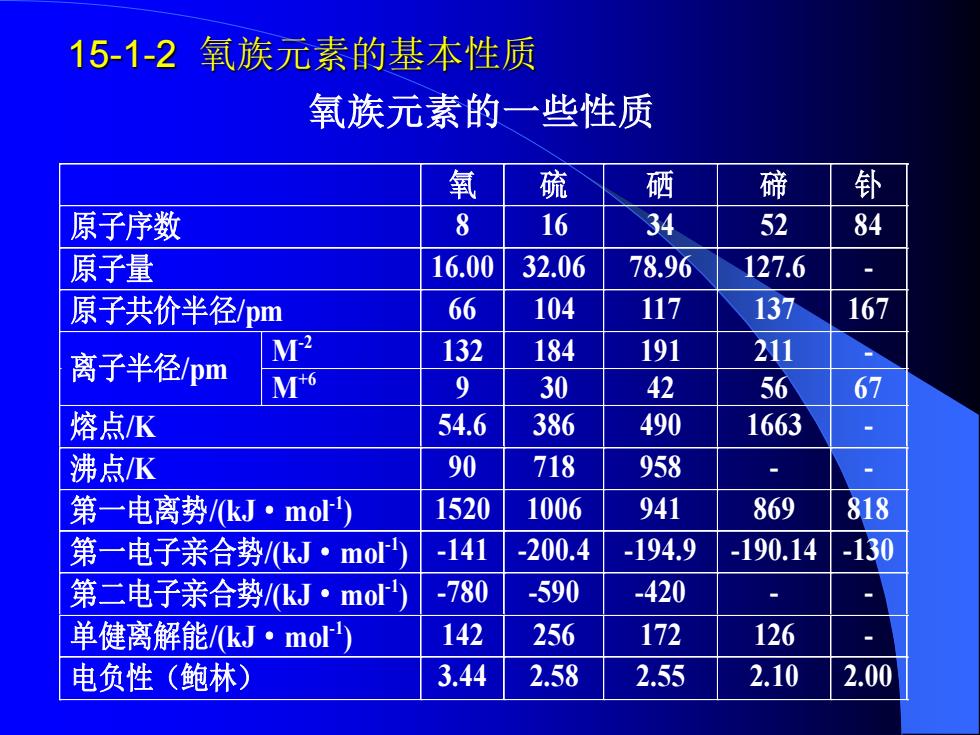
15-1-2 氧族元素的基本性质 氧族元素的一些性质 氧 硫 硒 碲 钋 原子序数 8 16 34 52 84 原子量 16.00 32.06 78.96 127.6 原子共价半径pm 66 104 117 137 167 离子半径pm M2 132 184 191 211 M+6 9 30 42 56 67 熔点K 54.6 386 490 1663 沸点K 90 718 958 第一电离势/kJ·mo 1520 1006 941 869 818 第一电子亲合势/kJ·mor -141 -200.4 -194.9 -190.14 -130 第二电子亲合势/kJ·mo) -780 -590 -420 单健离解能/kJ·mo少 142 256 172 126 电负性(鲍林)》 3.44 2.58 2.55 2.10 2.00
15-1-2 氧族元素的基本性质 氧族元素的一些性质 氧 硫 硒 碲 钋 原子序数 8 16 34 52 84 原子量 16.00 32.06 78.96 127.6 - 原子共价半径/pm 66 104 117 137 167 M-2 132 184 191 211 - 离子半径/pm M+6 9 30 42 56 67 熔点/K 54.6 386 490 1663 - 沸点/K 90 718 958 - - 第一电离势/(kJ·mol-1 ) 1520 1006 941 869 818 第一电子亲合势/(kJ·mol-1 ) -141 -200.4 -194.9 -190.14 -130 第二电子亲合势/(kJ·mol-1 ) -780 -590 -420 - - 单健离解能/(kJ·mol-1 ) 142 256 172 126 - 电负性(鲍林) 3.44 2.58 2.55 2.10 2.00

15-1-2 氧族元素的基本性质 氧族元素的氧化态 电子构型 常见氧化态 He]2s22p4 210 [Ne]3s23p4 :2-1.0+2.+4±6 Se [Ar]4s24p* -2.0,+4+6 Te Kr]5s25p4 -2.+2.0+4,+6 Po [Xe]6s26p4 ±2,+6
15-1-2 氧族元素的基本性质 氧族元素的氧化态 电子构型 常见氧化态 O [He]2s22p4 -2,-1,0, S [Ne]3s23p4 -2,-1,0,+2,+4,+6 Se [Ar]4s24p4 -2,0,+4,+6 Te [Kr]5s25p4 -2,+2,0,+4,+6 Po [Xe]6s26p4 +2,+6

15-2氧及其化合物 15-2-1氧气单质 氧的分子轨道电子排布式是: IKK(s2(s)2(r2p(Py)(2P)],在轨道中有不成 对的单电子,所以O,分子是有双原子气体中唯一 的一种具有偶数电子同时又显示顺磁性的物质。 氧气的反应活性很高,在室温或较高温度下可 直接剧烈的氧化除W、Pt、Au、Hg和稀有气体以 外的其它元素形成氧化物,遇活泼金属还可形成 氧化物或超氧化物。 氧的基态和激发态的2轨道电子排布和能量差 列表:
15-2 氧及其化合物 15-2-1 氧气单质 氧 的 分 子 轨 道 电 子 排 布 式 是 : [KK(2s ) 2 ( 2s ) 2 ( 2Px) 2 ( 2p ) 4 ( 2Py) 1 ( 2Pz) 1 ],在轨道中有不成 对的单电子,所以O2分子是有双原子气体中唯一 的一种具有偶数电子同时又显示顺磁性的物质。 氧气的反应活性很高,在室温或较高温度下可 直接剧烈的氧化除W、Pt、Au、Hg和稀有气体以 外的其它元素形成氧化物,遇活泼金属还可形成 氧化物或超氧化物。 氧的基态和激发态的2p轨道电子排布和能量差 列表:
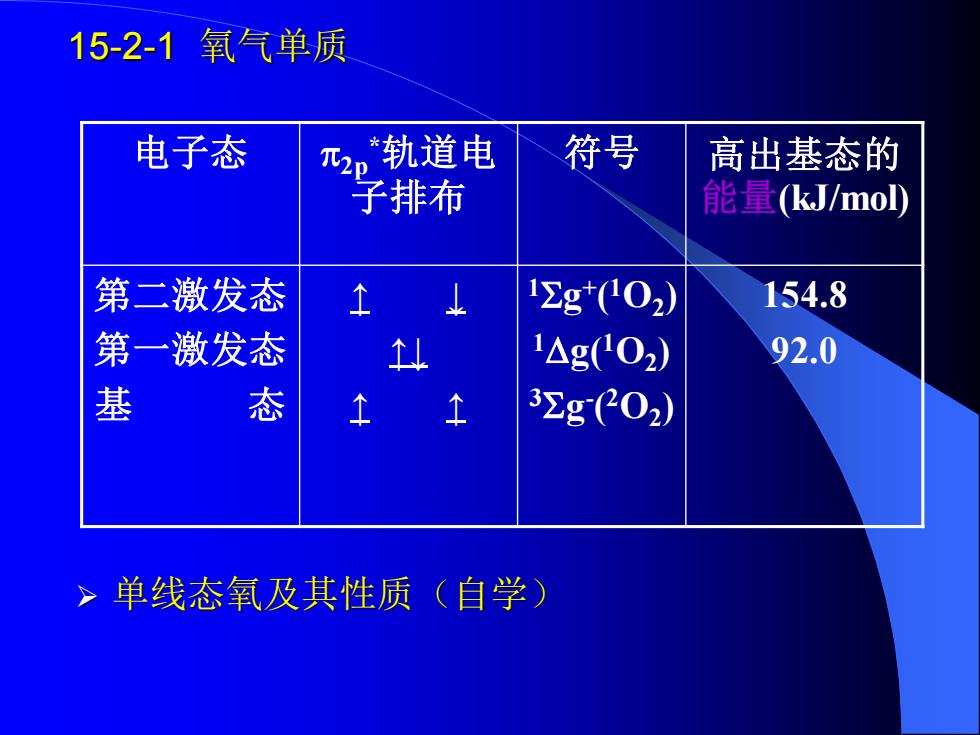
15-2-1氧气单质 电子态 兀2p轨道电 符号 高出基态的 子排布 能量kJ/mol 第二激发态 12g*C02) 154.8 第一激发态 1△g02) 92.0 基 态 32g(02) >单线态氧及其性质(自学)
15-2-1 氧气单质 电子态 2p *轨道电 子排布 符号 高出基态的 能量(kJ/mol) 第二激发态 第一激发态 基 态 ↑ ↓ ↑↓ ↑ ↑ 1g + ( 1O2 ) 1g(1O2 ) 3g - ( 2O2 ) 154.8 92.0 ➢ 单线态氧及其性质(自学)

15-2-2氧化物 大多数非金属氧化物和某些高氧化态的金属氧化物 均显酸性;大多数金属氧化物显碱性;一些金属氧化物 (如A山,03.ZmO)和少数非金属氧化物(如As,0,、 Sb,O。)显两性;中性氧化物有NO、CO等。氧化物酸 碱性的一般规律是: 同周期各元素最高氧化态的氧化物从左到右由碱性一 一两性—酸性 相同氧化态的同族各元素的氧化物从上到下碱性依次 增强 同一元素能形成几种氧化态的氧化物酸性随氧化数的 升高而增强 氧化物还可按其价键特征分为离子型氧化物、共价 型氧化物和过度型氧化物
15-2-2 氧化物 大多数非金属氧化物和某些高氧化态的金属氧化物 均显酸性;大多数金属氧化物显碱性;一些金属氧化物 (如Al2O3、 ZnO )和少数非金属氧化物(如As3O6 、 Sb4O6、)显两性;中性氧化物有NO 、CO等。氧化物酸 碱性的一般规律是: 同周期各元素最高氧化态的氧化物从左到右由碱性— —两性——酸性 相同氧化态的同族各元素的氧化物从上到下碱性依次 增强 同一元素能形成几种氧化态的氧化物酸性随氧化数的 升高而增强 氧化物还可按其价键特征分为离子型氧化物、共价 型氧化物和过度型氧化物

15-2-3臭氧 03与02是由同一种元素组成的不同单质,互称同素异 形体。 O3在地面附近的大气层中含量极少,仅占0.001ppm。在 离地面2040km处有个臭氧层,臭氧浓度高达0.2ppm。 它是氧气吸收太阳的紫外线后形成的。反应为: O2thW2<242nm)=0+0,0+0==03 03+hM2=220-320nm)==0,+0 这两种过程最后达到动态平衡,结果形成了一个浓度 相对稳定的臭氧层。正是这臭氧层吸收了高空紫外线的 强辐射,使地球上的生物免遭伤害。但近年由于大气中 污染物(如氯氟烃CFCI3、CF,CI,和氮氧化物等)不断增加 使臭氧层遭到破坏,从而造成对环境和生物的严重影响。 实验室里利用对氧无声放电来获得臭氧。简单臭氧发 生器装置如图:
15-2-3 臭氧 O3与O2是由同一种元素组成的不同单质,互称同素异 形体。 O3在地面附近的大气层中含量极少,仅占0.001ppm。在 离地面20~40km处有个臭氧层,臭氧浓度高达0.2ppm。 它是氧气吸收太阳的紫外线后形成的。反应为: O2+h(<242nm)===O+O,O+O2==O3 O3+h(=220~320nm)===O2+O 这两种过程最后达到动态平衡,结果形成了一个浓度 相对稳定的臭氧层。正是这臭氧层吸收了高空紫外线的 强辐射,使地球上的生物免遭伤害。但近年由于大气中 污染物(如氯氟烃CFCl3、CF2Cl2和氮氧化物等)不断增加 使臭氧层遭到破坏,从而造成对环境和生物的严重影响。 实验室里利用对氧无声放电来获得臭氧。简单臭氧发 生器装置如图:
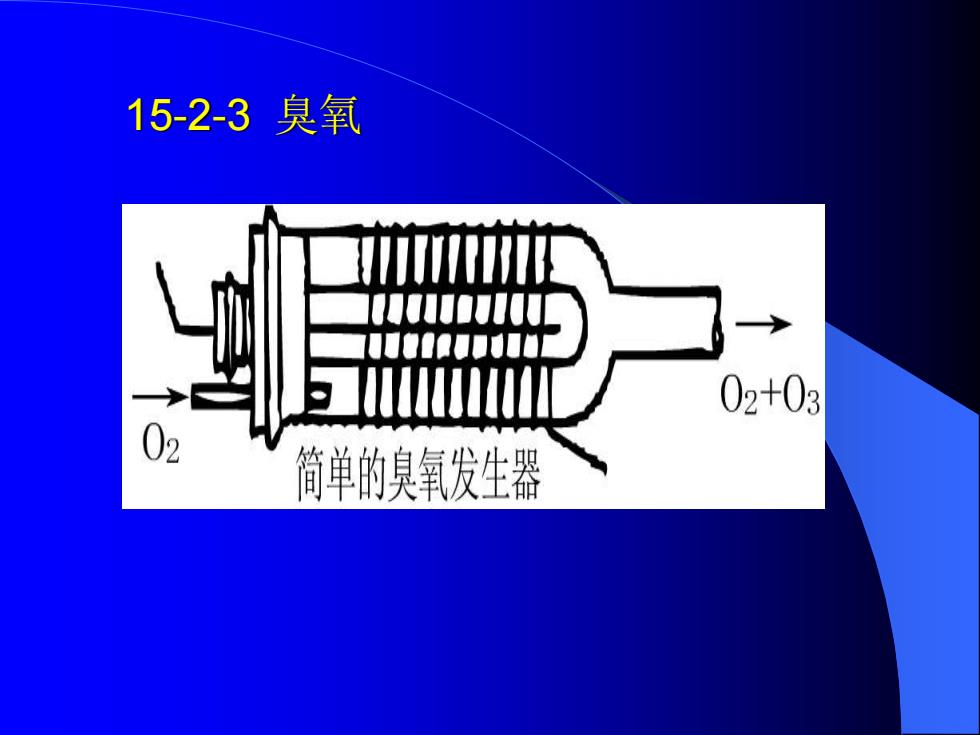
15-2-3臭氧 02+03 简单的臭氧发生器
15-2-3 臭氧
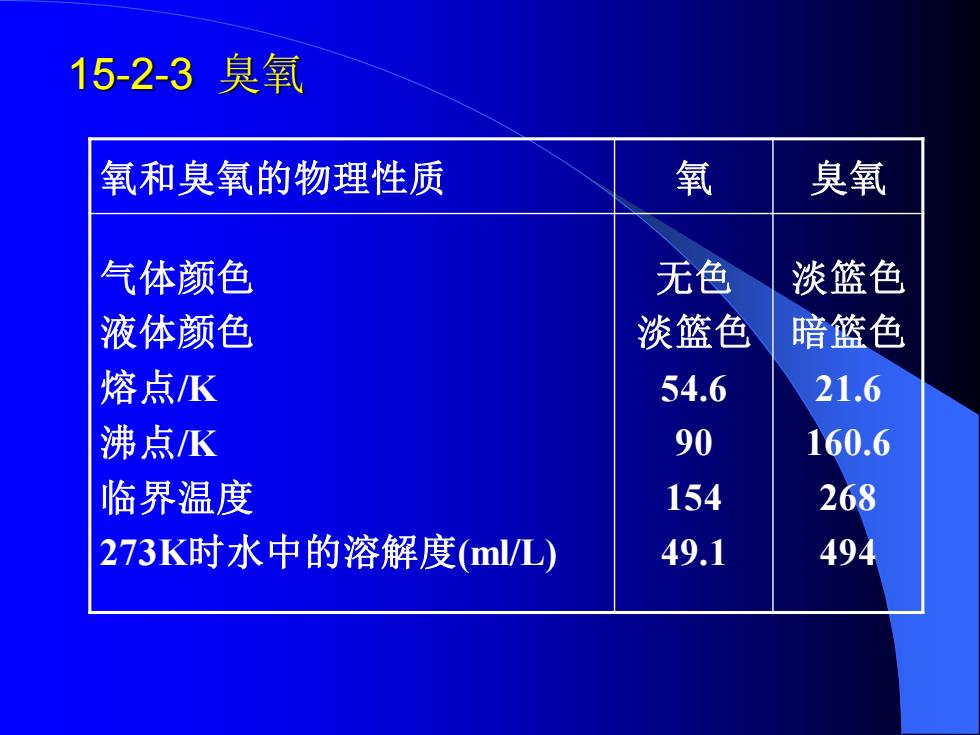
15-2-3臭氧 氧和臭氧的物理性质 氧 臭氧 气体颜色 无色 淡篮色 液体颜色 淡篮色 暗篮色 熔点K 54.6 21.6 沸点K 90 160.6 临界温度 154 268 273K时水中的溶解度(ml/L) 49.1 494
15-2-3 臭氧 氧和臭氧的物理性质 氧 臭氧 气体颜色 液体颜色 熔点/K 沸点/K 临界温度 273K时水中的溶解度(ml/L) 无色 淡篮色 54.6 90 154 49.1 淡篮色 暗篮色 21.6 160.6 268 494