
第十六章氮族元素 >本章要求 1.掌握氮和氨的氢化物、氧化物、含氧酸及其盐 的结构和性质 2.掌握磷及其重要化合物的结构和性质 3.掌握砷、锑、铋单质及其化合物的性质 4.掌握氮(磷)化合物的水解反应
第十六章 氮族元素 ➢本章要求 1.掌握氮和氨的氢化物、氧化物、含氧酸及其盐 的结构和性质 2.掌握磷及其重要化合物的结构和性质 3.掌握砷、锑、铋单质及其化合物的性质 4.掌握氮(磷)化合物的水解反应
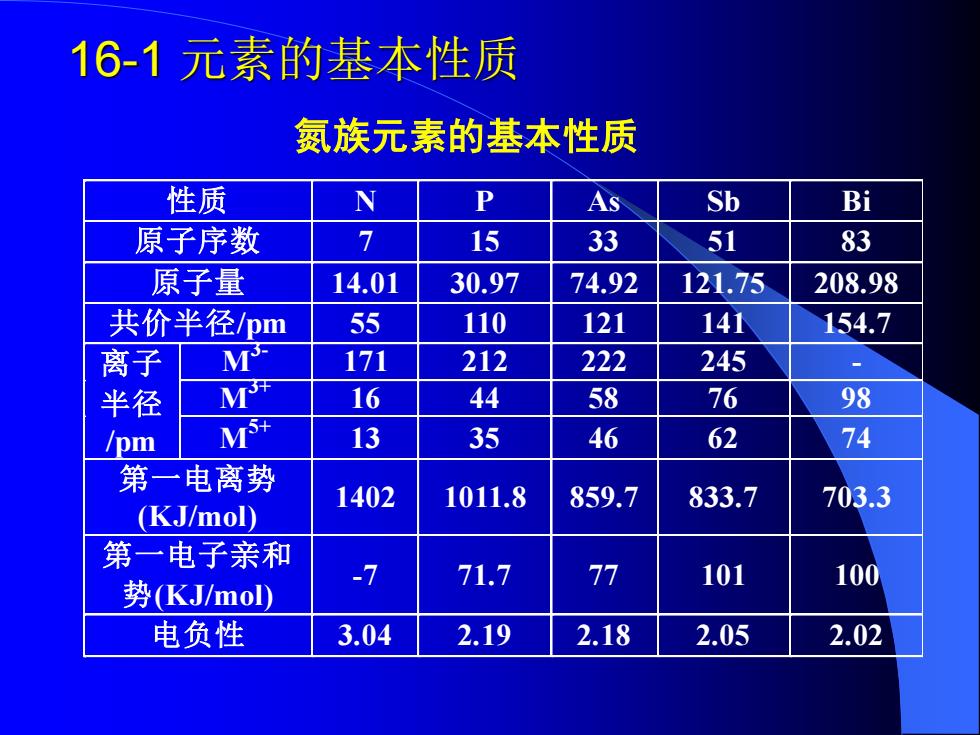
16-1元素的基本性质 氮族元素的基本性质 性质 As Sb Bi 原子序数 7 15 33 51 83 原子量 14.01 30.97 74.92 121.75 208.98 共价半径pm 55 110 121 141 154.7 离子 T 17列 212 222 245 半径 M 16 44 58 76 98 /pm M 13 35 46 62 74 第一电离势 (KJ/mol) 1402 1011.8 859.7 833.7 703.3 第一电子亲和 -7 71.7 77 101 100 势(KJ/mol) 电负性 3.04 2.19 2.18 2.05 2.02
16-1 元素的基本性质 氮族元素的基本性质 性 质 N P As Sb B i 原子序数 7 15 33 51 83 原子量 14.01 30.97 74.92 121.75 208.98 共价半径/pm 55 110 121 141 154.7 M 3- 171 212 222 245 - M 3+ 16 44 58 76 98 离 子 半 径 /pm M 5+ 13 35 46 62 74 第一电离势 (KJ/mol) 1402 1011.8 859.7 833.7 703.3 第一电子亲和 势(KJ/mol) -7 71.7 77 101 100 电负性 3.04 2.19 2.18 2.05 2.02
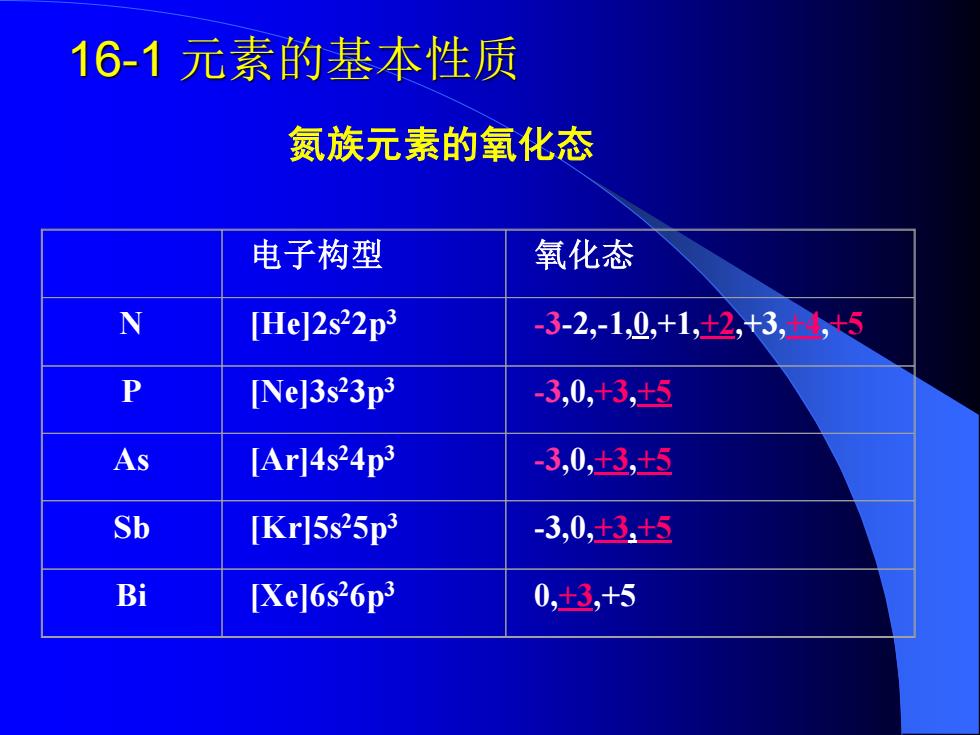
16-1元素的基本性质 氨族元素的氧化态 电子构型 氧化态 N [He]2s22p3 -3-2,-1,0+1,+2,t3,+4+5 P [Ne]3s23p3 -3,0,+3,+5 As [Ar]4s24p3 -3,0+3,+5 Sb [Kr]5s25p3 -3,0+3t5 Bi [Xe]6s26p3 0,+3,+5
氮族元素的氧化态 电子构型 氧化态 N [He]2s 22p 3 -3-2,-1,0,+1,+2,+3,+4,+5 P [Ne]3s 23p 3 -3,0,+3,+5 As [Ar]4s 24p 3 -3,0,+3,+5 Sb [Kr]5s 25p 3 -3,0,+3,+5 Bi [Xe]6s 26p 3 0,+3,+5 16-1 元素的基本性质

16-1元素的基本性质 >氮族元素的特性 由于价电子层为ns2np3与氧族、卤素比较, 它们若要获得三个电子而形成Ⅲ价的离子是 较困难的,只有电负性较大的N、P能形成极 少数-Ⅲ价的离子型化合物,LiN、MgN2 NaP、Ca3P2等,由于N3-、P3-离子半径大容易 变型,遇水强烈水解生成NH3和PH3如: Mg3N2+6H2O==3Mg(OH)2+3NH3T Na3P+3H2O===3NaOH+3PH3T 本族元素形成正价的趋势较强,如N3、 PBrs、AsFs、SbCl5、BiCl3、SbCl等,形成共 价化合物是本族元素的特征
➢ 氮族元素的特性 由于价电子层为ns2np3与氧族、卤素比较, 它们若要获得三个电子而形成-Ⅲ价的离子是 较困难的,只有电负性较大的N、P能形成极 少数-Ⅲ价的离子型化合物,Li3N、Mg3N2、 Na3P、Ca3P2等,由于N3-、P3-离子半径大容易 变型,遇水强烈水解生成NH3和PH3如: Mg3N2+6H2O===3Mg(OH)2+3NH3 Na3P+3H2O===3NaOH+3PH3 本族元素形成正价的趋势较强,如NF3、 PBr5、AsF5、SbCl5、BiCl3、SbCl3等,形成共 价化合物是本族元素的特征。 16-1 元素的基本性质

16-1元素的基本性质 从N到Bi,+V氧化态的稳定性递减,而+Ⅲ氧化态的稳 定性递增。 +V氧化态的氮是较强的氧化剂。除氮外从磷到铋+V 氧化态的氧化性(从+V还原到+Ⅲ)依次增强。 +V氧化态的磷儿乎不具有氧化性并且最稳定,而+V 氧化态的铋是最强的氧化剂,它的+Ⅲ氧化态最稳定,几 乎不显还原性
16-1 元素的基本性质 从N到Bi,+V氧化态的稳定性递减,而+Ⅲ氧化态的稳 定性递增。 +V氧化态的氮是较强的氧化剂。除氮外从磷到铋+V 氧化态的氧化性(从+V还原到+Ⅲ)依次增强。 +V氧化态的磷儿乎不具有氧化性并且最稳定,而+V 氧化态的铋是最强的氧化剂,它的+Ⅲ氧化态最稳定,几 乎不显还原性

16-2氮和氮的化合物 16-2-1氮 工业上生产氮一般是由分馏液态空气在 15.2MPa(150atm)压力下装入钢瓶备用。或做成 液氮存于液氮瓶中,实验室里备少量氮气。如: NHC1(s)+NaNO2(饱和==NHNO2+NaCI NHNO2==N2↑+2H20 产物中有少量NH3、NO、O2和H20等杂质, 可设法除去。 (NH)2Cr2O===N2T+Cr2O3+4H2O 2NH3+3Cu0==3Cu+N2↑+3H20 NaN3==Na①+N2个(可得到很纯的氮)
16-2 氮和氮的化合物 16-2-1 氮 工业上生产氮一般是由分馏液态空气在 15.2MPa (150atm)压力下装入钢瓶备用。或做成 液氮存于液氮瓶中,实验室里备少量氮气。如: NH4Cl(s)+NaNO2 (饱和)===NH4NO2+NaCl NH4NO2===N2+2H2O 产物中有少量NH3、NO、O2和H2O等杂质, 可设法除去。 (NH4 )2Cr2O7===N2+Cr2O3+4H2O 2NH3+3CuO===3Cu+N2+3H2O NaN3===Na(l)+N2(可得到很纯的氮)

16-2-1氮 氮原子间能形成多重键,因而能生成本族其它元素所没 有的化合物如叠氮化物N3),偶氮化合物(一N=N一)等。 由于N2的键能很大(946kJmo1),加热到3273K时,只有 0.1%离解。 N在常温下就和锂直接反应生成Li,N,在高温时不但能 和镁、钙、铝、硼、硅等化合生成氮化物,而且能与氧、 氢直接化合。 因N的原子半径小、又没有d轨道可供成键,所以N在化 合物中的配位数最多不超过4。 >化学模拟生物固氮(自学)
16-2-1 氮 氮原子间能形成多重键,因而能生成本族其它元素所没 有的化合物如叠氮化物(N3 - ),偶氮化合物(—N=N—)等。 由于N2的键能很大(946kJ·mol-1 ),加热到3273K时,只有 0.1%离解。 N2在常温下就和锂直接反应生成Li3N,在高温时不但能 和镁、钙、铝、硼、硅等化合生成氮化物,而且能与氧、 氢直接化合。 因N的原子半径小、又没有d轨道可供成键,所以N在化 合物中的配位数最多不超过4。 ➢ 化学模拟生物固氮(自学)
16-2-2氮的氢化物 一、氨 氨是氮的最重要化合物之一。在工业上氨的制 备是用氮气和氢气在高温高压和催化剂存在下合成 的。在实验室中通常用铵盐和碱的反应来制备少量 氨气。 蒸 1 氢水 12 早期哈伯二博法合成氨流星 煤气发生炉 2冰涤塔斯3 气柜4 133
16-2-2 氮的氢化物 一、氨 氨是氮的最重要化合物之一。在工业上氨的制 备是用氮气和氢气在高温高压和催化剂存在下合成 的。在实验室中通常用铵盐和碱的反应来制备少量 氨气
16-2-2 氮的氢化物 氨的主要化学性质有: 1、还原性 常温下,氨在水溶液中能被C2、H2O2、KMnO4等 氧化,例如: 3Cl2+2NH3==N2+6HC】 若Cl2过量则得NCl3。 3CI2+NH3===NCI+3HCI 2、取代反应 取代反应是氨分子中的氢被其它原子或基团所取代: HgC2+2NH3==HgNH2Cu(白色)+NH4CI
16-2-2 氮的氢化物 氨的主要化学性质有: 1、还原性 常温下,氨在水溶液中能被Cl2、H2O2、KMnO4等 氧化,例如: 3Cl2+2NH3===N2+6HCl 若Cl2过量则得NCl3。 3Cl2+NH3===NCl3+3HCl 2、取代反应 取代反应是氨分子中的氢被其它原子或基团所取代: HgCl2+2NH3===HgNH2Cl↓(白色)+NH4Cl

16-2-2 氮的氢化物 COCI,+4NH;==CO(NH2)2+2NH CI (光气) 尿素) 这种反应与水解反应相类似,称为氨解反应。 3、易形成配合物 氨中氮原子上的孤电子对能与其它离子或分子形成 共价配如AgNH)2和BF3NH都是氨配合物。 4、弱碱性 NH3H20的K,=1.8×105,可与酸发生中和反应
16-2-2 氮的氢化物 COCl2+4NH3===CO(NH2 )2+2NH4Cl (光气) (尿素) 这种反应与水解反应相类似,称为氨解反应。 3、易形成配合物 氨中氮原子上的孤电子对能与其它离子或分子形成 共价配如[Ag(NH3 )2 ] +和BF3·NH3都是氨配合物。 4、弱碱性 NH3·H2O的Kb=1.810-5,可与酸发生中和反应