
第二十章 s区元素 ק20.1S区元素概述 ק20.2S区元素的单质 ק20.3s区元素的化合物 ק20.4锂、被的特殊性 对角线视则 返回
§20.1 s区元素概述 §20.4 锂 、铍的特殊性 对角线规则 §20.3 s区元素的化合物 §20.2 s区元素的单质 第二十章 s区元素

§20.1s区元素橇述 碱金属A):nsl Li,Na,K,Rb,Cs,Fr 碱土金属ⅡA):ns2 Be,Mg,Ca,Sr,Ba,Ra 都是活泼金属。 返 回
§20.1 s区元素概述 碱金属(IA ):ns1 Li, Na, K, Rb, Cs, Fr 碱土金属(IIA ):ns2 Be, Mg, Ca, Sr, Ba, Ra 都是活泼金属

通性: 1.易与H,直接化合成MH、MH,离子 型化合物; 1.与O,形成正常氧化物、过氧化物、 超氧化物; 1.易与H,O反应(除Be、Mg外), 与非金属作用形成相应的化合物。 注:它们的活泼性有差异
1. 易与H2直接化合成MH、MH2离子 型化合物; 1. 与O2形成正常氧化物、过氧化物、 超氧化物; 1. 易与H2O反应(除Be、Mg外), 与非金属作用形成相应的化合物。 注:它们的活泼性有差异 通性:

IA IIA 电离能、 原子半径增 L Be 金属性、还原性增强 Na Mg K Ca 电负性减小 Rb Sr Cs Ba 原子半径减小 金属性、还原性减弱 电离能、电负性增大
原子半径增大 金属性、还原性增强 电离能、电负性减小 IA IIA Li Be Na Mg K Ca Rb Sr Cs Ba 原子半径减小 金属性、还原性减弱 电离能、电负性增大

§20.2s区元素的单质 ©>20.2.1单质的物理性质和化学性质 20.2.2s区元素的存在和单质的制备 返回
20.2.1 单质的物理性质和化学性质 §20.2 s区元素的单质 20.2.2 s区元素的存在和单质的制备

20.2.1单质的物理性质和化学性质 1.物理性质 Li Na K
20.2.1 单质的物理性质和化学性质 Li Na K 1.物理性质

Rb Cs Be Mg Ca Sr Ba
Be Mg Ca Sr Ba Rb Cs
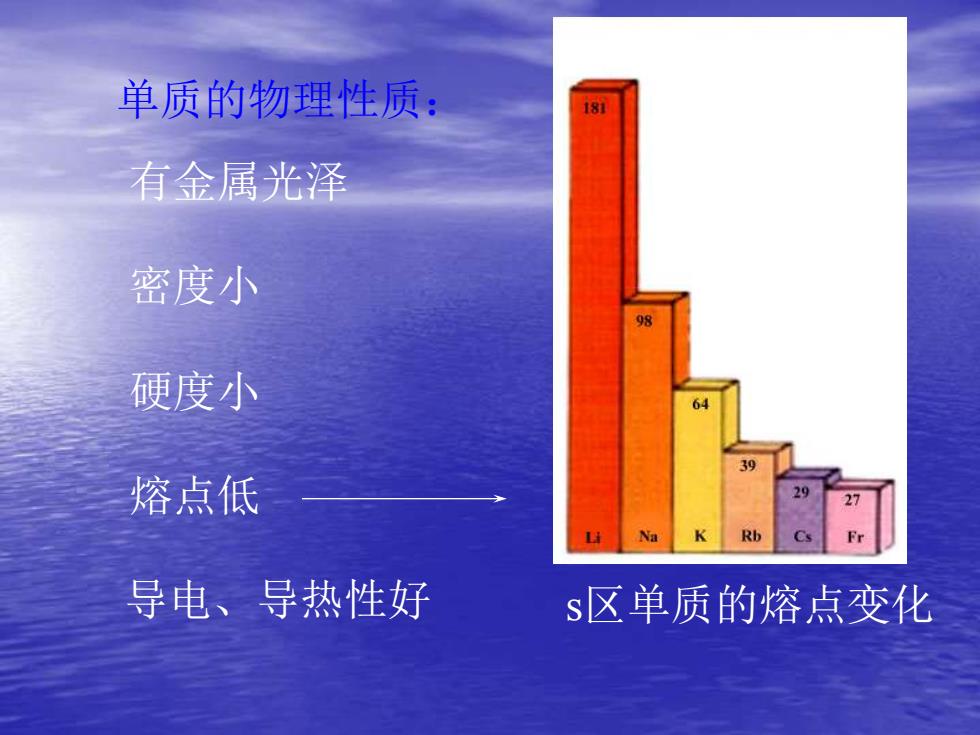
单质的物理性质: 18 有金属光泽 密度小 98 硬度小 6 39 熔点低 L Na K Rb 导电、导热性好 s区单质的熔点变化
单质的物理性质: 有金属光泽 密度小 硬度小 熔点低 导电、导热性好 s区单质的熔点变化

2.化学性质 与氧、硫、氮、卤素反应, 形成相应的化合物 单质在空气中燃烧,形成相应的氧化物: Li,O Na,O, KO, RbO, Cs0, BeO MgO CaO SrO BaCs Na,O2 L10 镁带的燃烧 KO
单质在空气中燃烧,形成相应的氧化物: Li2O Na2O2 KO2 RbO2 CsO2 BeO MgO CaO SrO BaO2 Li2O Na2O2 KO2 •与氧、硫、氮、卤素反应, 形成相应的化合物。 2.化学性质 镁 带 的 燃 烧

与水作用2M+2H,O→2MOH+H(g) Li NaK a
•与水作用 Li Na K Ca 2M + 2H2O → 2MOH + H2 (g)