
第十七章 碳硅硼 17.1通性 17.2 碳 17.3硅 17.4 硼 17.5碳化物、硅化物和硼化物
第十七章 碳 硅 硼 17.1 通性 17.2 碳 17.3 硅 17.4 硼 17.5 碳化物 、硅化物和硼化物

17-1通性 ©17-1-1元素的基本性质 碳、硅、硼的一些基本性质列于书本表17-1 17-1-2电子构型和成键性质 1.价电子构型 碳与硅的价电子构型为nsnp,价电子数目与价电子轨 道数相等,它们被称为等电子原子。硼的价电子层结构为 2s2p,价电子数少于价电子轨道数,所以它是缺电子原 子。这些元素的电负性大,要失去价电子层上的1-2个p电 子成为正离子是困难,它们倾向于将s电子激发到轨道而 形成较多的共价键,所以碳和硅的常见氧化态为+V,硼 为+I
17-1 通性 17-1-1 元素的基本性质 碳、硅、硼的一些基本性质列于书本表17-1 17-1-2 电子构型和成键性质 1.价电子构型 碳与硅的价电子构型为ns2np2 ,价电子数目与价电子轨 道数相等,它们被称为等电子原子。硼的价电子层结构为 2s 22p 1 ,价电子数少于价电子轨道数,所以它是缺电子原 子。这些元素的电负性大,要失去价电子层上的1-2个p电 子成为正离子是困难,它们倾向于将s电子激发到p轨道而 形成较多的共价键,所以碳和硅的常见氧化态为+IV,硼 为+III

2.成键特征 碳和硅可以用sp、sp和sp杂化轨道形成1到4 个o键,但Sisp和 sp态不稳定。碳的原子半径小,还能形成 pm一pπ键,所以碳能形成多重键。硼B用sp和 sp3杂化轨道成键时,除了能形成一般的σ键外, 还能形成多中心键
2.成键特征 碳和硅可以用sp、sp2和sp3杂化轨道形成1到4 个σ键,但Si sp和 sp2态不稳定。碳的原子半径小,还能形成 pπ—pπ键,所以碳能形成多重键。硼B用sp和 sp3杂化轨道成键时,除了能形成一般的σ键外, 还能形成多中心键

3.碳、硅、硼形成化学键的键能 P556表17-2。 碳、硅、硼都有自相结合成键的特性。从表17一2中的数据 可知C一C键的强度比Si一Si或B—B都大。碳自相结合成链 的能力最强,这些元素与氢形成的键比它们各自结合的健 更牢,所以它们都有一系列的氢化物,如有机化学中的烃 类化合物以及硅烷、硼烷等。 如果将硅和硼的氢化物燃烧或与水反应,它们都会转变成 硅与硼的氧化物。这说明$i一O键及B一O键更牢。在自然 界中硅、硼也确实是以含氧化合物的形式存在,而且它们 的许多非金属氧化合物容易转变为氧化物或含氧化合物。 所以硅和硼都是亲氧元素。从链能还可以知道它们和氟形 成的化合物也是很稳定的
3.碳、硅、硼形成化学键的键能 P556表17-2。 碳、硅、硼都有自相结合成键的特性。从表17—2中的数据 可知C—C键的强度比Si—Si或B—B都大。碳自相结合成链 的能力最强,这些元素与氢形成的键比它们各自结合的健 更牢,所以它们都有一系列的氢化物,如有机化学中的烃 类化合物以及硅烷、硼烷等。 如果将硅和硼的氢化物燃烧或与水反应,它们都会转变成 硅与硼的氧化物。这说明Si一O键及B—O键更牢。在自然 界中硅、硼也确实是以含氧化合物的形式存在,而且它们 的许多非金属氧化合物容易转变为氧化物或含氧化合物。 所以硅和硼都是亲氧元素。从链能还可以知道它们和氟形 成的化合物也是很稳定的

17-1-3自然村在和丰度 碳、硅、硼在地壳中的丰度分别为0.023%、 29.50%和1.2×103%。硅的含量在所有元素中 居第二位,它以大量的硅酸盐矿和石英矿存在 于自然界。碳的含量虽然不多,但它(除氢外) 是地球上化合物最多的元素。大气中有CO2;矿 物界有各种碳酸盐、金刚石、石墨和煤,还有 石油和天然气等碳氢化合物动植物体中的脂肪、 蛋白质、淀粉和纤维素等等也都是碳的化合物。 如果说硅是构成地球上矿物界的主要元素,那 么,碳就是组成生物界的主要元素。硼在自然 界中的含量更少,它同硅一样主要以含氧化合 物矿石而存在
17-1-3 自然村在和丰度 碳、硅、硼在地壳中的丰度分别为0.023%、 29.50%和1.2×10-3 %。硅的含量在所有元素中 居第二位,它以大量的硅酸盐矿和石英矿存在 于自然界。碳的含量虽然不多,但它(除氢外) 是地球上化合物最多的元素。大气中有CO2;矿 物界有各种碳酸盐、金刚石、石墨和煤,还有 石油和天然气等碳氢化合物动植物体中的脂肪、 蛋白质、淀粉和纤维素等等也都是碳的化合物。 如果说硅是构成地球上矿物界的主要元素,那 么,碳就是组成生物界的主要元素。硼在自然 界中的含量更少,它同硅一样主要以含氧化合 物矿石而存在

17-2碳 。17-2-1单质 。同素异形体 金刚石:原子晶体,硬度最大熔点最高。 石墨:层状晶体,质软,有金属光泽。 足球烯或富勒烯:C6o,C0等。 C60是1985年用激光轰击石墨作碳的气化实验时 发现的。 C60是由12个五边形 和20个六边形组成的 32面体。 碳纤维
17-2 碳 ⚫ 17-2-1 单质 ⚫ 同素异形体 金刚石:原子晶体,硬度最大,熔点最高。 石墨:层状晶体 ,质软,有金属光泽。 足球烯或富勒烯: C60, C70 等。 C60 是1985年用激光轰击石墨作碳的气化实验时 发现的。 C60 是由12个五边形 和20个六边形组成的 32面体。 碳纤维
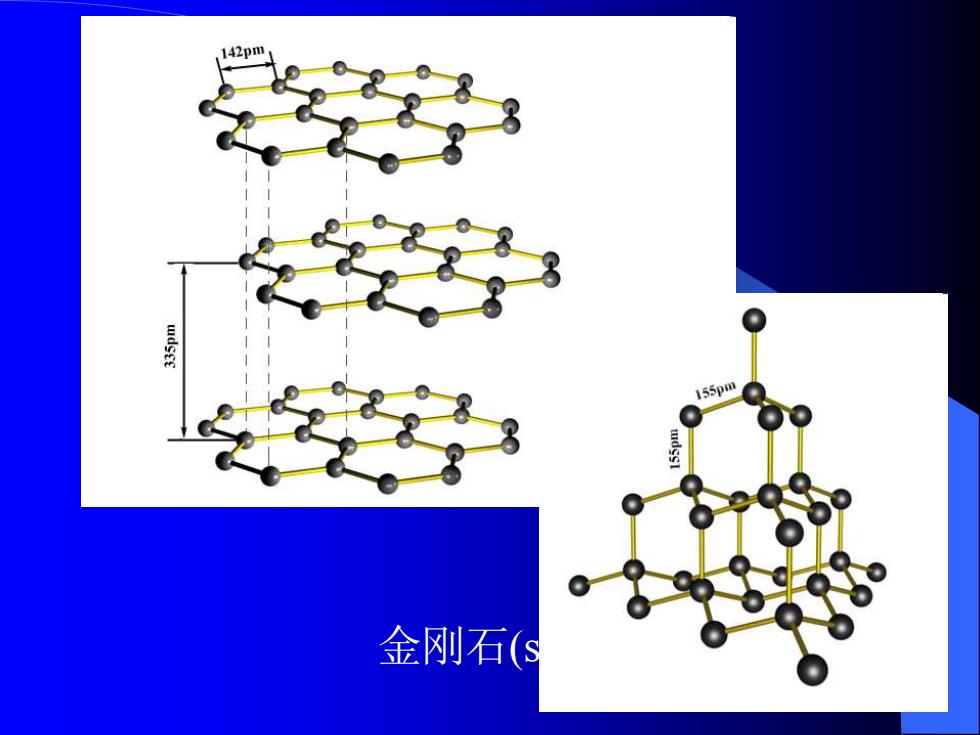
420 155pm 金刚石(S
石墨(sp2杂化) 金刚石(sp3杂化)

足球烯,富勒烯,C60(sp226杂化)
足球烯,富勒烯,C60 (sp2.26杂化)

17-2-2碳的氧化物、含氧酸及其盐 1.碳的氧化物 。一氧化碳(CO) 结构 C0(6+8=14e)与N2(2×7=14e) 是等电子体,结构相似。 一个o键 :C=0: 两个π键
17-2-2 碳的氧化物、含氧酸及其盐 结构: CO(6+8=14e- )与N2(2×7=14e-) 是等电子体, 结构相似。 一个σ键 两个π键 :C O: 1.碳的氧化物 • 一氧化碳(CO) :C O:

①作配位体,形成羰基配合物 Fe(CO)5,Ni(CO)4.Co2(CO)s 其中C是配位原子。 ②还原剂: CO(g+-0,(g →C0,(g Fe,0,(s)+3C0(g →2FeS+30 ③剧毒
性质: ①作配位体,形成羰基配合物 Fe(CO)5 , Ni(CO)4 , Co2 (CO)8 其中C是配位原子。 ②还原剂: O (g) CO (g) 2 1 CO(g) + 2 ⎯→ 2 Fe O (s) 3CO(g) 2Fe(s) 3CO (g) 2 3 + ⎯→ + 2 ③剧毒