
第十四章卤素
第十四章 卤素
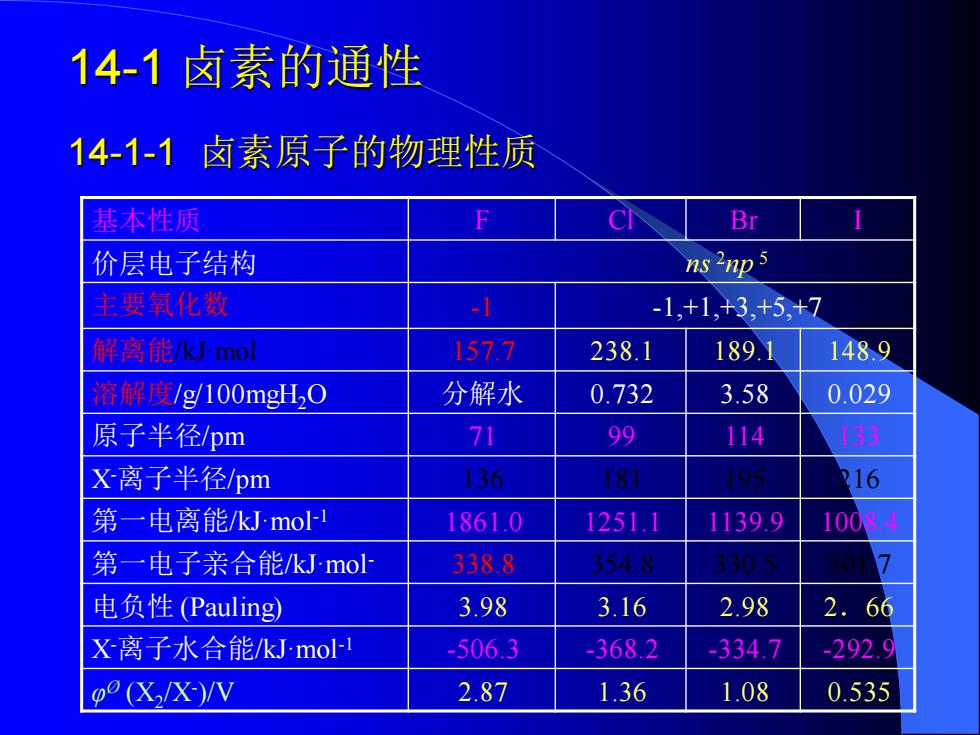
14-1卤素的通性 14-1-1卤素原子的物理性质 基本性质 F C Br 价层电子结构 ns2np5 主要氧化数 1 -1,+1,+3,+5,+7 解离能Uml 1577 238.1 189.1 1489 溶解度/g100mgH20 分解水 0.732 3.58 0.029 原子半径/pm 71 99 114 133 X离子半径/pm 136 181 193 16 第一电离能/kJmo 1861.0 1251.1 1139.9 10084 第一电子亲合能/kJ-mol- 3388 3544 电负性(Pauling) 3.98 3.16 2.98 2.66 X离子水合能/kJmo -506.3 -368.2 -334.7 -2929 p0(X,/X)/V 2.87 1.36 1.08 0.535
14-1 卤素的通性 14-1-1 卤素原子的物理性质 基本性质 F Cl Br I 价层电子结构 ns 2np 5 主要氧化数 -1 -1,+1,+3,+5,+7 解离能/kJ·mol 157.7 238.1 189.1 148.9 溶解度/g/100mgH2O 分解水 0.732 3.58 0.029 原子半径/pm 71 99 114 133 X-离子半径/pm 136 181 195 216 第一电离能/kJ·mol-1 1861.0 1251.1 1139.9 1008.4 第一电子亲合能/kJ·mol- 338.8 354.8 330.5 301.7 电负性 (Pauling) 3.98 3.16 2.98 2.66 X-离子水合能/kJ·mol-1 -506.3 -368.2 -334.7 -292.9 φ Ø (X2 /X- )/V 2.87 1.36 1.08 0.535

14-1卤素的通性 14-1-2卤素的存在 卤素单质具有很高的化学活性,因此在自然界中以稳 定的卤化物存在。 砹是人工合成的元素
14-1 卤素的通性 14-1-2 卤素的存在 卤素单质具有很高的化学活性,因此在自然界中以稳 定的卤化物存在。 砹是人工合成的元素

14-1-3卤素的电势图 一、元素电势图 对于具有多种氧化态的某元素,可将其各种氧化态按从高 到低的顺序排列,在每两种氧化态之间用直线连接起来并在直 线上标明相应电极反应的标准电极电势值,以这样的图形表示 某一元素各种氧化态间电极电势变化的关系称为元素电势图。 因是拉特默Latimer,W.M.)首创,故又称为拉特默图。 现以溴在碱性介质中的电势图为例,作些说明: BrO:093-BrO 0565 BrO:-0335Er2(0085 Br 0.61
14-1-3 卤素的电势图 一、元素电势图 对于具有多种氧化态的某元素,可将其各种氧化态按从高 到低的顺序排列,在每两种氧化态之间用直线连接起来并在直 线上标明相应电极反应的标准电极电势值,以这样的图形表示 某一元素各种氧化态间电极电势变化的关系称为元素电势图。 因是拉特默(Latimer,W.M.)首创,故又称为拉特默图。 现以溴在碱性介质中的电势图为例,作些说明: BrO4 - BrO3 - BrO - Br2(l) Br 1 - 2 0.93 0.565 0.335 1.085 0.61
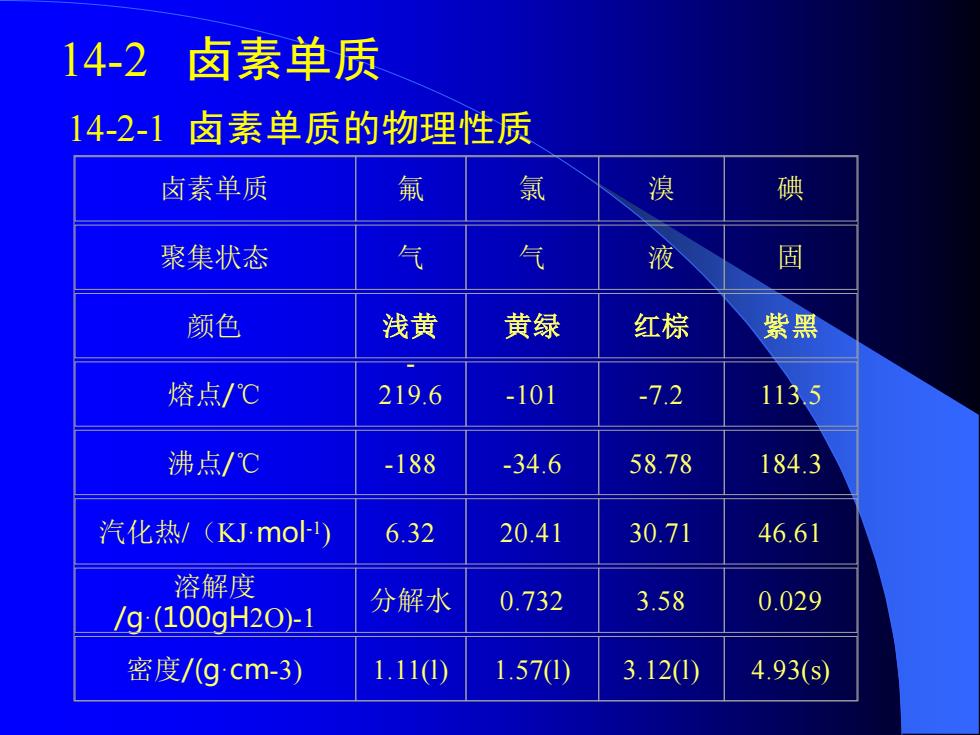
14-2卤素单质 14-2-1卤素单质的物理性质 卤素单质 氟 氯 溴 碘 聚集状态 气 气 液 固 颜色 浅黄 黄绿 红棕 紫黑 熔点/℃ 219.6 -101 -72 113,5 沸点/℃ -188 -34.6 58.78 184.3 汽化热/(KJmo) 6.32 20.41 30.71 46.61 溶解度 /g:(100gH2O-1 分解水 0.732 3.58 0.029 密度/(gcm-3) 1.11(0) 1.570) 3.120) 4.93(S)
14-2 卤素单质 14-2-1 卤素单质的物理性质 卤素单质 氟 氯 溴 碘 聚集状态 气 气 液 固 颜色 浅黄 黄绿 红棕 紫黑 熔点/℃ - 219.6 -101 -7.2 113.5 沸点/℃ -188 -34.6 58.78 184.3 汽化热/(KJ·mol-1 ) 6.32 20.41 30.71 46.61 溶解度 /g·(100gH2O)-1 分解水 0.732 3.58 0.029 密度/(g·cm-3) 1.11(l) 1.57(l) 3.12(l) 4.93(s)

14-2卤素单质 14-2-2卤素单质的化学性质 一、与金属、非金属的作用 氟能与所有金属和非金属(除氮、氧和一些稀有气体外) 包括氢直接化合,而且反应常常是很猛烈的,伴随着燃烧和 爆炸。氟与单质的反应总是把它们氧化到最高的氧化态如把 Co、S、V和Bi氧化为: CoF3,SF,VF5,BiFs 而氯与它们反应生成的是: CoCl,SCl,VCl,BiCla 在室温或不太高温度下,氟与镁、铁、铜、铅、镍等金属 反应,在金属表面形成一层保护性的金属氟化物薄膜,可阻 止氟与金属进一步的反应。在室温时氟与金、铂不作用,加 热时则生成氟化物
14-2 卤素单质 14-2-2 卤素单质的化学性质 一、与金属、非金属的作用 氟能与所有金属和非金属(除氮、氧和一些稀有气体外) 包括氢直接化合,而且反应常常是很猛烈的,伴随着燃烧和 爆炸。氟与单质的反应总是把它们氧化到最高的氧化态如把 Co、S、V和Bi氧化为: CoF3,SF6,VF5,BiF5 而氯与它们反应生成的是: CoCl2,SCl4,VCl4,BiCl3 在室温或不太高温度下,氟与镁、铁、铜、铅、镍等金属 反应,在金属表面形成一层保护性的金属氟化物薄膜,可阻 止氟与金属进一步的反应。在室温时氟与金、铂不作用,加 热时则生成氟化物

14-2卤素单质 14-2-2卤素单质的化学性质 氯也能与各种金属和大多数非金属(除氮、氧、稀 有元素外)直接化合,但有些反应需要加热,反应还 比较剧烈,如钠、铁、锡、锑、铜等都能在氯中燃烧。 潮湿的氯在加热条件下能与金、铂起反应,干燥的 氯却不与铁作用,故可将干燥的液氯贮于钢瓶中。氯 与非金属反应的剧刷烈程度不如氟。 一般能与氯反应的金属(除了贵金属)和非金属同 样也能与溴、碘反应,只是反应的活性不如氯,要在 较高的温度下才能发生
14-2 卤素单质 14-2-2 卤素单质的化学性质 氯也能与各种金属和大多数非金属(除氮、氧、稀 有元素外)直接化合,但有些反应需要加热,反应还 比较剧烈,如钠、铁、锡、锑、铜等都能在氯中燃烧。 潮湿的氯在加热条件下能与金、铂起反应,干燥的 氯却不与铁作用,故可将干燥的液氯贮于钢瓶中。氯 与非金属反应的剧烈程度不如氟。 一般能与氯反应的金属(除了贵金属)和非金属同 样也能与溴、碘反应,只是反应的活性不如氯,要在 较高的温度下才能发生

14-2卤素单质 14-2-2卤素单质的化学性质 二、与水的反应 卤素与水可能发生下列两类反应: X,+H,0==2Ht+2X+02(1) X2+H2O=H++X+HXO (2) 氟与水反应依(1)式进行。 氯、溴、碘与水反应主要依(2)式进行。该反应是 一种歧化反应
14-2 卤素单质 14-2-2 卤素单质的化学性质 二、与水的反应 卤素与水可能发生下列两类反应: X2 + H2O === 2H+ + 2X- + O2(1) X2 + H2O === H+ + X- + HXO (2) 氟与水反应依(1)式进行。 氯、溴、碘与水反应主要依(2)式进行。该反应是 一种歧化反应

14-2卤素单质 14-2-2卤素单质的化学性质 卤素的歧化反应与溶液的H值有关,当氯水溶液的 PH>4时,歧化反应才能发生,pH<4时则CI被HCIO氧化生 成C2。碱性介质有利于氯、溴和碘的歧化反应。 X,t2OH=X+XO+H,O(X=C2、Br) 3X+6OH=5X+XO,+3H2O(X=C2、Br2、2) 碘在冷的碱性溶液中能迅速发生歧化反应: 31,+6O1H==51+0+3H,0 氟与碱的反应和其它卤素不同,其反应如下: 2F2+20H(2%)=2F+0F2+H20 当碱溶液较浓时;则OF,被分解放出O2 2F2+40H=4F+02+2H20
14-2 卤素单质 14-2-2 卤素单质的化学性质 卤素的歧化反应与溶液的pH值有关,当氯水溶液的 PH>4时,歧化反应才能发生,pH<4时则Cl-被HClO氧化生 成Cl2。碱性介质有利于氯、溴和碘的歧化反应。 X2+2OH-===X-+XO-+H2O(X=CI2、Br2) 3X2+6OH-===5X-+XO3 -+3H2O(X=CI2、Br2、I2) 碘在冷的碱性溶液中能迅速发生歧化反应: 3I2+6OH-===5I-+IO3 -+3H2O 氟与碱的反应和其它卤素不同,其反应如下: 2F2+2OH-(2%)==2F-+OF2+H2O 当碱溶液较浓时;则OF2被分解放出O2 2F2+4OH-=4F-+O2+2H2O

14-2卤素单质 14-2-2卤素单质的化学性质 卤素的歧化反应与溶液的H值的关系,可以由下图直观看出 30 p/N 2 25 0可能发生区 15 +e2 Br时2e寸2Br 1.0 0.5 2e主2 02+4H+4e≥ 2H20 6 8 10 12 14 p 卤素与水反应的pH电势图
14-2 卤素单质 14-2-2 卤素单质的化学性质 pH 卤素与水反应的pH电势图 0 2 4 6 8 10 12 14 0.5 1.0 1.5 2.0 2.5 3.0 /V O2可能发生区 F2 e - F - +2 2 Cl 2 Cl - e - +2 2 Br2 Br - e - +2 2 I2 I - e - +2 2 O2 H + e H2O - + 4 +4 2 卤素的歧化反应与溶液的pH值的关系,可以由下图直观看出