
第八章稀溶液的依数性 溶液的饱和蒸气压下降 。二沸点升高和凝固点下降 ●三渗透压
第八章 稀溶液的依数性 ⚫ 一 溶液的饱和蒸气压下降 ⚫ 二 沸点升高和凝固点下降 ⚫ 三 渗透压

§8-1溶液的饱和蒸气压下降
§8-1 溶液的饱和蒸气压下降

一 纯溶剂的饱和蒸气压(P,) 在密闭容器中,在纯溶剂的单位表面上,单位时间 里,有N。个分子蒸发到上方空间中。随着上方空间 里溶剂分子个数的增加,密度的增加,分子凝聚,回 到液相的机会增加.当密度达到一定数值时,凝聚的 分子的个数也达到N,个。这时起,上方空间的蒸气 密度不再改变,保持恒定。此时,蒸气的压强也不 再改变,称为该温度下的饱和蒸汽压,用P。表示。 达到平衡.当蒸气压小于P。时,平衡右移,继续 气化;若蒸气压大于P。时,平衡左移,气体液化, 譬如,改变上方的空间体积,即可使平衡发生移动
一 纯溶剂的饱和蒸气压 (P0 ) 在密闭容器中, 在纯溶剂的单位表面上, 单位时间 里 ,有 N0 个分子蒸发到上方空间中。随着上方空间 里溶剂分子个数的增加, 密度的增加, 分子凝聚, 回 到液相的机会增加.当密度达到一定数值时, 凝聚的 分子的个数也达到 N0 个。这时起,上方空间的蒸气 密度不再改变, 保持恒定。此时, 蒸气的压强也不 再改变, 称为该温度下的饱和蒸汽压, 用 P0 表示。 达到平衡. 当蒸气压小于 P0 时, 平衡右移, 继续 气化; 若蒸气压大于 P0 时, 平衡左移, 气体液化. 譬如, 改变上方的空间体积, 即可使平衡发生移动

二溶液的饱和蒸气压(P) 当溶液中溶有难挥发的溶质时,则有部分溶 液表面被这种溶质分子所占据,于是,在溶液中 单位表面在单位时间内蒸发的溶剂分子的数目 N要小于N,。凝聚分子的个数当然与蒸气密 度有关.当凝聚的分子数目达到N,实现平衡时, 蒸气压已不会改变.这时,平衡状态下的饱和蒸 气压为P<P。,对溶液来讲,蒸气压大于P,液 化;蒸气压小于P,气化
二 溶液的饱和蒸气压 (P) 当溶液中溶有难挥发的溶质时, 则有部分溶 液表面被这种溶质分子所占据,于是, 在溶液中, 单位表面在单位时间内蒸发的溶剂分子的数目 N 要小于 N0 。 凝聚分子的个数当然与蒸气密 度有关. 当凝聚的分子数目达到 N, 实现平衡时, 蒸气压已不会改变. 这时, 平衡状态下的饱和蒸 气压为:P < P0 ,对溶液来讲, 蒸气压大于 P, 液 化;蒸气压小于P, 气化

三解释实验现象 过程开始时,HO和糖水均以蒸发为主;当 蒸气压等于P时,糖水与上方蒸气达到平衡,而 P。>P,即HO并未平衡,继续蒸发,以致于蒸气 压大于P.H0分子开始凝聚到糖水中,使得蒸 气压不能达到P.于是,H0分子从HO中蒸 出而凝聚入糖水.出现了本节开始提出的实验 现象. 变化的根本原因是溶液的饱和蒸气压
三 解释实验现象 过程开始时, H2O 和糖水均以蒸发为主; 当 蒸气压等于 P 时, 糖水与上方蒸气达到平衡, 而 P0 > P, 即 H2O 并未平衡, 继续蒸发, 以致于蒸气 压大于 P. H2O 分子开始凝聚到糖水中, 使得蒸 气压不能达到 P0 . 于是, H2O 分子从 H2O 中蒸 出而凝聚入糖水. 出现了本节开始提出的实验 现象. 变化的根本原因是溶液的饱和蒸气压下降

四拉乌尔定律(Laoult) 在一定温度下,溶液的饱和蒸气压等于纯溶剂 的饱和蒸气压与溶剂摩尔分数之积即:P= Pox剂 用P表示溶液的P与纯溶剂P。之差,则有P= Po-P=P。-Pox剂=Po(1-x剂故有P=Pox质 对于稀的水溶液: 一 定温度下,P。亦为常数,故P55.5也是 常数,令其等于k,则有:P=km(对于不同溶剂, k值不同)
四 拉乌尔定律 (Laoult) 在一定温度下, 溶液的饱和蒸气压等于纯溶剂 的饱和蒸气压与溶剂摩尔分数之积.即: P = P0 ·x剂 用P表示溶液的 P 与纯溶剂 P0 之差, 则有:P = P0 - P = P0 - P0 ·x剂 = P0 (1- x剂) 故有:P = P0·x质 对于稀的水溶液: 一定温度下, P0 亦为常数, 故 P0 /55.5 也是 常数, 令其等于k, 则有:P = k·m (对于不同溶剂, k 值不同)

§8-2沸点升高和凝固点下降
§8-2 沸点升高和凝固点下降

一沸点和凝固点 蒸发:表面气化现象称为蒸发, 沸腾:表面和内部同时气化的现象: 沸点:液体沸腾过程中的温度 只有当液体的饱和蒸气压和外界大气的压强相 等时,液体的气化才能在表面和内部同时发生 这时的温度即是沸点. 凝固点:液体凝固成固体(严格说是晶体)是在 定温度下进行的,这个温度称为凝固点。凝固 点的实质是,在这个温度下,液体和固体的饱和 蒸气压相等即为:液体固体平衡 若P固>P液,则固体要融化(熔解);P固<P液 液体要凝固;
一 沸点和凝固点 蒸发: 表面气化现象称为蒸发; 沸腾: 表面和内部同时气化的现象; 沸点: 液体沸腾过程中的温度. 只有当液体的饱和蒸气压和外界大气的压强相 等时, 液体的气化才能在表面和内部同时发生, 这时的温度即是沸点. 凝固点: 液体凝固成固体(严格说是晶体)是在一 定温度下进行的, 这个温度称为凝固点。凝固 点的实质是, 在这个温度下, 液体和固体的饱和 蒸气压相等.即为: 液体固体 平衡 若 P固 > P液, 则固体要融化(熔解);P固 < P液, 液体要凝固;
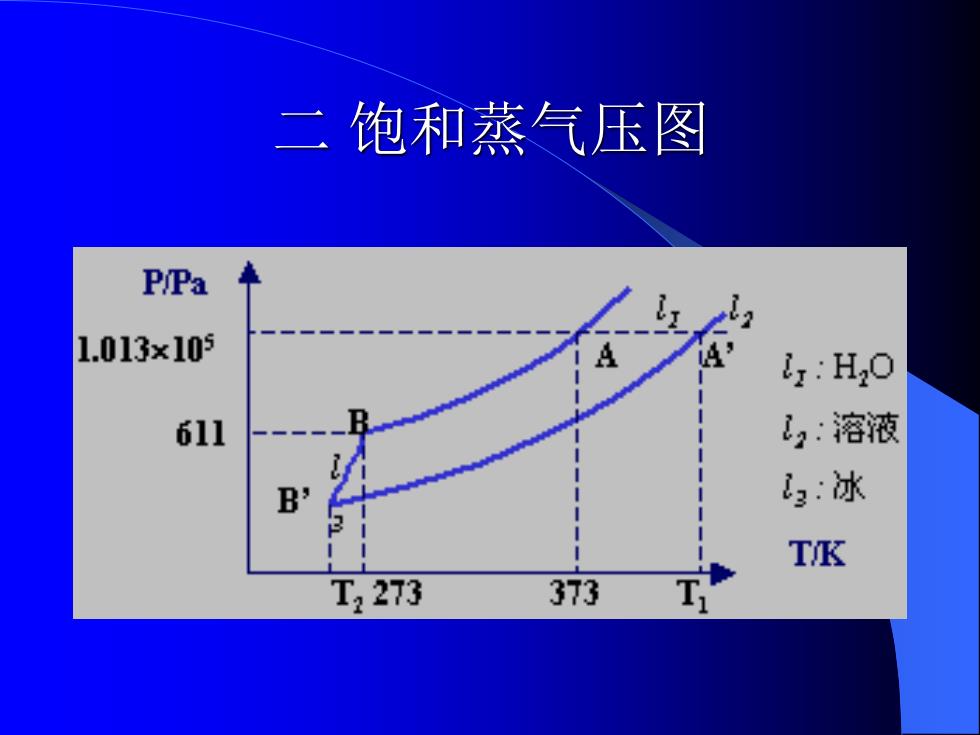
二饱和蒸气压图 P/Pa 1.013x105 HO 611 ,:溶液 B' 3:冰 TK T2273 373
二 饱和蒸气压图

1.物质的饱和蒸气压P,对温度T做图。左侧是 冰,水,水溶液的饱和蒸气压图.随着温度的升高 冰,水,溶液的饱和蒸气压都升高.在同一温度下, 溶液的饱和蒸气压低于H,O的饱和蒸气压冰的 曲线斜率大,随温度变化大。 ●2.373K时,水的饱和蒸气压等于外界大气压强 (1.103×105),故373K是H0的沸点 如图中A点.在该温度下,溶液的饱和蒸气压 小于,溶液未达到沸点.只有当温度达到T,时 (T>373K,A?点),溶液的饱和蒸气压才达到,才 沸腾。可见,由于溶液的饱和蒸气压的下降, 导致沸点升高.即溶液的沸点高于纯水
⚫ 1.物质的饱和蒸气压 P, 对温度 T 做图。左侧是 冰, 水, 水溶液的饱和蒸气压图.随着温度的升高, 冰, 水, 溶液的饱和蒸气压都升高. 在同一温度下, 溶液的饱和蒸气压低于 H2O 的饱和蒸气压.冰的 曲线斜率大, 随温度变化大。 ⚫ 2. 373K时, 水的饱和蒸气压等于外界大气压强 (1.103×105 ), 故 373K 是 H2 O 的沸点 . 如图中 A 点. 在该温度下,溶液的饱和蒸气压 小于,溶液未达到沸点.只有当温度达到T1时 (T1 >373K, A’点),溶液的饱和蒸气压才达到, 才 沸腾。可见, 由于溶液的饱和蒸气压的下降, 导致沸点升高. 即溶液的沸点高于纯水