
第四章化学平衡 本章目录 一反应的等温方程和平衡常数 二标准生成自由能与平衡常数 三一些因素对平衡的影响 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 第四章 化学平衡 本章目录

§41反宝的等温方程和年衡常款 本节要目 化学反应的平衡条件 二范特荷夫等温方程 三平衡常数 小 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 本节要目

食 §4,1反寇的等温方程和平衡常赵 一、化学反应的平衡条件 1.反应的摩尔吉布斯能变 2、平衡条件 3.为什么会存在化学平衡? 4.亲和势(affinity) 上页 下页 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 一、化学反应的平衡条件 1.反应的摩尔吉布斯能变 2、平衡条件 3.为什么会存在化学平衡? 4. 亲和势(affinity)

§4.1反寇的等温方程和平衡常款 1.反应的摩尔吉布斯能变 化学反应体系: 封闭的单相体系,不作非膨胀功,发生了一个 化学反应,设为: dD+eE+.→P+gG+. 在体系内发生了微小的变化(包括温度、压力和化学反应的变化), 体系内各物质的量相应地有微小的变化(设无非体积功),则 dG=-SdT+dP+∑h.dng 如果变化是在等T,P进行的,则 dG=∑4.d血。 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 1. 反应的摩尔吉布斯能变 化学反应体系: 封闭的单相体系,不作非膨胀功,发生了一个 化学反应,设为: 在体系内发生了微小的变化(包括温度、压力和化学反应的变化), 体系内各物质的量相应地有微小的变化(设无非体积功),则 如果变化是在等T, P进行的,则 d e f g D E F G + + → + + dG= -SdT+VdP+ B B dnB dG= B B B dn

§4,1反寇的等温方程和平衡常赵 根据反应进度的定义,可以得到: d5= dng-Vpdg (dGr,p=∑Madne=∑e4ad5 (dng vad) 对于为微小变化或为1mo1时体系的吉布斯能的改变为: △G m ∑g4a 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 根据反应进度的定义,可以得到: 对于为微小变化或为1mol时体系的吉布斯能的改变为: B d B d n = B B dn =ν dξ , B B B B B B ( )d d d G n T p = = B B (d d ) n = , r m B B T P G G = =

§4.1反寇的等温方程和平衡常款 公式理解: a) 在一个无限量的体系内,体系的发生一个o变化引起G的变化 b)在一个有限量的体系内,体系发生一个微小变化d5,引起体系发 生一个dG的变化。 对A,Gm的理解: 1)量纲:J.mo1 2)强度性质,与体系的物质的量无关 3)对同一化学反应来讲,其具体值与计量方程式写法有关 4)随着反应的进行,由于浓度发生变化,则发生变化,引起变化, 所以不是一个定值。 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 公式理解: a) 在一个无限量的体系内,体系的发生一个mol变化引起G的变化 b) 在一个有限量的体系内,体系发生一个微小变化d ,引起体系发 生一个dG的变化。 对 的理解: 1)量纲:J.mol-1 2) 强度性质,与体系的物质的量无关 3)对同一化学反应来讲,其具体值与计量方程式写法有关 4)随着反应的进行,由于浓度发生变化,则B发生变化,引起变化, 所以不是一个定值。 r m G

§4,1反寇的等温方程和平衡常赵 2.平衡条件 用 , ∑y4。 △,G,判断都是等效的 (A,Gm)T.0 反应自发地向左进行,不可能自发 向右进行 (△,Gmhp=0 反应达到平衡 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 2. 平衡条件 用 , , 判断都是等效的 T P, G B B r m G r m , ( ) G T p 0 反应自发地向右进行 r m , ( ) 0 G T p 反应自发地向左进行,不可能自发 向右进行 r m , ( ) 0 G T p = 反应达到平衡
§4.1反寇的等温方程和平衡常款 用 判断,这相当于G-5图上曲线的斜率,因为是微小变 /T P 化,反应进度处于0~1mol之间。 0 反应自发向左进 行,趋向平衡 =0 反应达到平衡 上页 下页 回主目录 返国 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 • 用 判断,这相当于G - 图上曲线的斜率,因为是微小变 化,反应进度处于0~1 mol之间。 T P, G ( ) , 0 T p G 反应自发向右进 行,趋向平衡 ( ) , 0 T p G 反应自发向左进 行,趋向平衡 ( ) , = 0 T p G 反应达到平衡
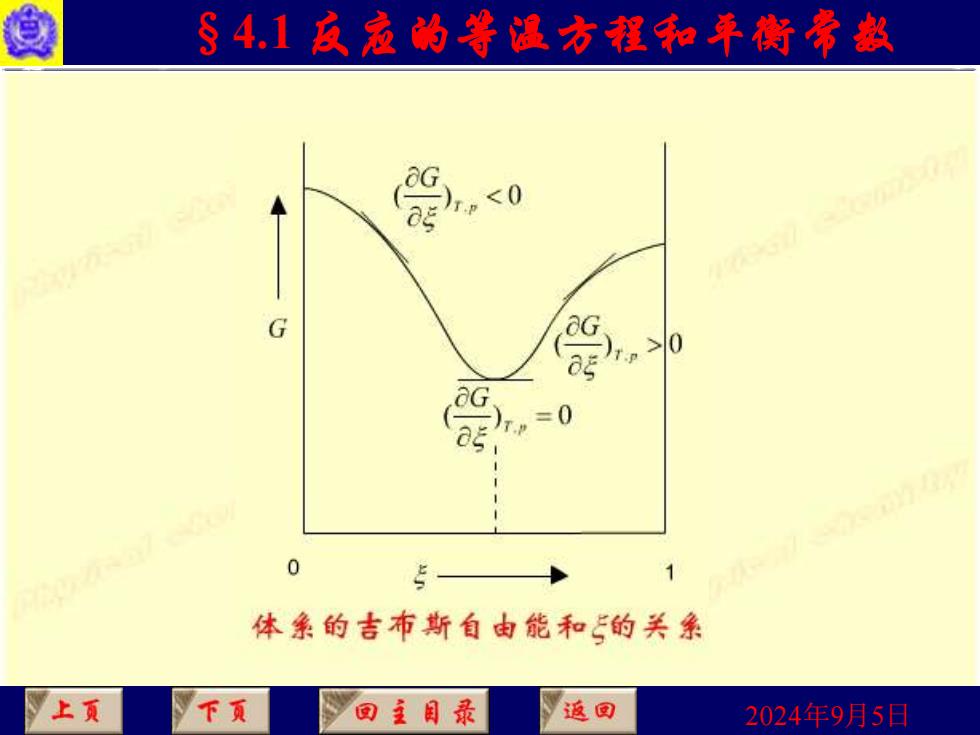
§4.1反寇的等温方程和年衡常赵 爱0 G 0 1 体亲的吉布斯自由能和的关系 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数

§4.1反寇的等温方程和平衡常赵 3.为什么会存在化学平衡? 在等温等压下,当反应物的化学势的总和大于产物化学势的总和 时反应自发向右进行,既然产物的化学势较低,为什么反应通常 不能进行到底,而是进行到一定程度达到平衡后就不再进行。 严格讲,反应物与产物处于同一体系的反应都是可逆的,不能进 行到底。只有逆反应与正反应相比小到可以忽略不计的反应,可 以粗略地认为可以进行到底。这主要是由于存在混合吉布斯自由 能的缘故。 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 3. 为什么会存在化学平衡? 在等温等压下,当反应物的化学势的总和大于产物化学势的总和 时反应自发向右进行,既然产物的化学势较低,为什么反应通常 不能进行到底,而是进行到一定程度达到平衡后就不再进行。 严格讲,反应物与产物处于同一体系的反应都是可逆的,不能进 行到底。只有逆反应与正反应相比小到可以忽略不计的反应,可 以粗略地认为可以进行到底。这主要是由于存在混合吉布斯自由 能的缘故