
西北大学化工原理 第二节 气液直接接触时的传热与传质 一、过程的分析 1、过程的方向 温度是传热方向的判据; 分压是传质方向的判据。 饱和湿空气 Pe=p 传质方向发生逆转的原因:Pe=f(t)但不饱和气体 的温度与水汽分压p是两个独立变量
西北大学化工原理 第二节 气液直接接触时的传热与传质 一、过程的分析 1、过程的方向 温度是传热方向的判据; 分压是传质方向的判据。 饱和湿空气 Pe=p 传质方向发生逆转的原因:Pe=f(t)但不饱和气体 的温度与水汽分压p是两个独立变量

西北大学化工原理 例题:温度为30℃,水汽分压为2kPa的湿空气与 50℃的水接触,判断热、质传递的方向
西北大学化工原理 例题:温度为30℃,水汽分压为2kPa的湿空气与 50℃的水接触,判断热、质传递的方向

西北大学化工原理 2、过程的速率 = α θ − tq )( 式中 q—传热速率,kJ/s.m2 α—气相对流给热系数,kJ/s.m2.℃ θi—气液界面温度,℃ t —气体温度,℃ 一般地, α液体>> α气体; θi≈θ tq )( = α θ i −
西北大学化工原理 2、过程的速率 = α θ − tq )( 式中 q—传热速率,kJ/s.m2 α—气相对流给热系数,kJ/s.m2.℃ θi—气液界面温度,℃ t —气体温度,℃ 一般地, α液体>> α气体; θi≈θ tq )( = α θ i −

西北大学化工原理 传质速率式 ( sgA −= ppkN 水汽) NA—传质速率,kmol/s.m2; kg—气相传质分系数, kmol/s.m2.kpa 湿度:单位质量的干气体带有的水汽量, kg水汽/kg干气 水汽 水汽 气 水 pp p M M H − ×= p—气相总压,kPa; M—摩尔质量。 对空气—水系统 水汽 水汽 pp p H − = 622.0
西北大学化工原理 传质速率式 ( sgA −= ppkN 水汽) NA—传质速率,kmol/s.m2; kg—气相传质分系数, kmol/s.m2.kpa 湿度:单位质量的干气体带有的水汽量, kg水汽/kg干气 水汽 水汽 气 水 pp p M M H − ×= p—气相总压,kPa; M—摩尔质量。 对空气—水系统 水汽 水汽 pp p H − = 622.0

西北大学化工原理 以湿度差为推动力的传质速率式 HHkN )( = SHA − kg/s.m2 kH—以湿度差为推动力的气相传质系数,kg/s.m2; Hs—气相中水汽分压等于水温下的饱和蒸汽压时气体的湿度; NA—单位时间、单位面积所传递的水分质量数,kg/s.m2。 S S S pp p H − = 622.0 pS—水温下的饱和蒸汽压
西北大学化工原理 以湿度差为推动力的传质速率式 HHkN )( = SHA − kg/s.m2 kH—以湿度差为推动力的气相传质系数,kg/s.m2; Hs—气相中水汽分压等于水温下的饱和蒸汽压时气体的湿度; NA—单位时间、单位面积所传递的水分质量数,kg/s.m2。 S S S pp p H − = 622.0 pS—水温下的饱和蒸汽压

西北大学化工原理 3、过程的极限 热、质同时传递时过程的极限与单一传热过 程的极限不同,分两种情况: 单一传热过程的极限是温度相等,达到热平 衡状态;但一传质过程的极限是气相分压与液相 平衡分压相等,达到相平衡状态。 (1)、液相状态固定不变,气相状态变化 一般来说,大量液体与少量气体接触的极限 为气体温度接近于液体温度,气相水蒸汽分压接 近饱和蒸汽压
西北大学化工原理 3、过程的极限 热、质同时传递时过程的极限与单一传热过 程的极限不同,分两种情况: 单一传热过程的极限是温度相等,达到热平 衡状态;但一传质过程的极限是气相分压与液相 平衡分压相等,达到相平衡状态。 (1)、液相状态固定不变,气相状态变化 一般来说,大量液体与少量气体接触的极限 为气体温度接近于液体温度,气相水蒸汽分压接 近饱和蒸汽压

西北大学化工原理 (2) 气相状态固定不变,液相状态变化 如果气体进口为未饱和状态,则不可能同时达到传 热、传质的平衡状态。如果θ=t,则p<pe,传质过程仍能进 行,传质过程(水分汽化)所伴随热效应必破坏已达成的热平 衡。相反地,如果p=pe,进口气相不是饱和状态,则必有 θ<t,继续传热,从而将改变液相温度,破坏原有的平衡。 结论:在气相状态固定不变,液相状态变化时,不能 同时达到热质传递平衡状态。但过程仍有极限
西北大学化工原理 (2) 气相状态固定不变,液相状态变化 如果气体进口为未饱和状态,则不可能同时达到传 热、传质的平衡状态。如果θ=t,则p<pe,传质过程仍能进 行,传质过程(水分汽化)所伴随热效应必破坏已达成的热平 衡。相反地,如果p=pe,进口气相不是饱和状态,则必有 θ<t,继续传热,从而将改变液相温度,破坏原有的平衡。 结论:在气相状态固定不变,液相状态变化时,不能 同时达到热质传递平衡状态。但过程仍有极限
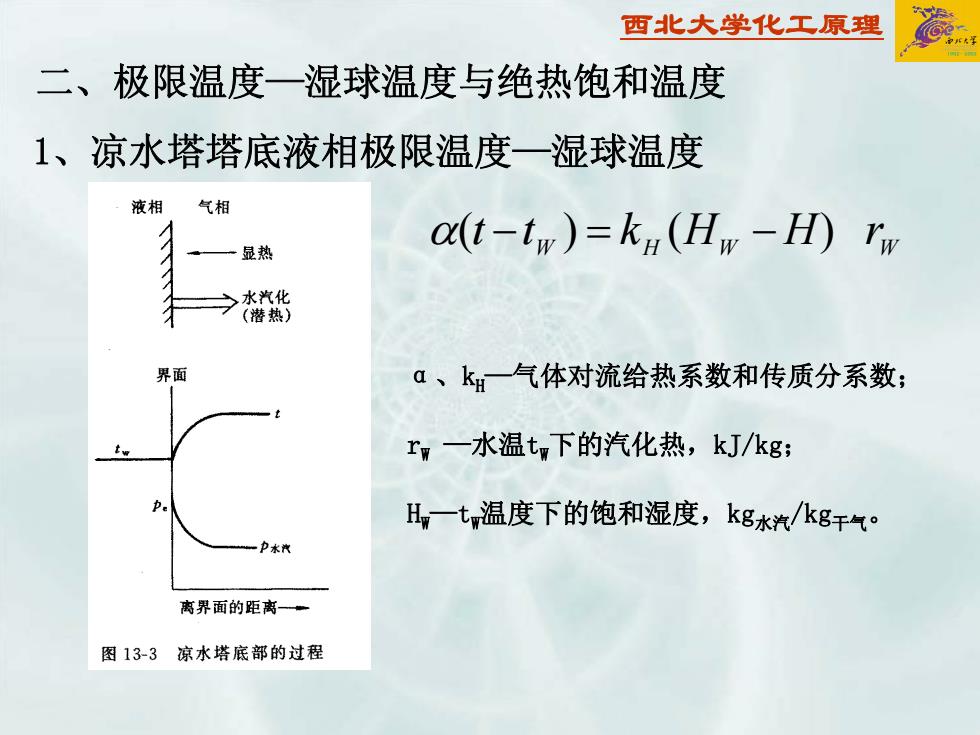
西北大学化工原理 二、极限温度—湿球温度与绝热饱和温度 W WH W α − = − )()( rHHktt 1、凉水塔塔底液相极限温度—湿球温度 α、kH—气体对流给热系数和传质分系数; rW —水温tW下的汽化热,kJ/kg; HW—tW温度下的饱和湿度,kg水汽/kg干气
西北大学化工原理 二、极限温度—湿球温度与绝热饱和温度 W WH W α − = − )()( rHHktt 1、凉水塔塔底液相极限温度—湿球温度 α、kH—气体对流给热系数和传质分系数; rW —水温tW下的汽化热,kJ/kg; HW—tW温度下的饱和湿度,kg水汽/kg干气

西北大学化工原理 液相的极限温度tW决定于三方面因素: (1)物系性质:rW、Ps=f(tW)及与αg、kH有关的物性; (2)气相状态:t、H或气相中的水气分压; (3)流动条件:影响α、 kH的流动参数。 s s w pp p H − = 622.0 w W H W rHH k tt −−= )( α
西北大学化工原理 液相的极限温度tW决定于三方面因素: (1)物系性质:rW、Ps=f(tW)及与αg、kH有关的物性; (2)气相状态:t、H或气相中的水气分压; (3)流动条件:影响α、 kH的流动参数。 s s w pp p H − = 622.0 w W H W rHH k tt −−= )( α

西北大学化工原理 当流速足够大时,热质传递均以对流为主,且满足: (PrRe023.0 )Pr 048.0 λμ λ αd Cp Nu = Nu = = (Re023.0 ) 33.08.0 D Sc Ddk Sh ShSc H ρμ = = = ≈ 09.1/ H α k ≈ 09.2~67.1/ H α k 这样,在温度不变、流速较大时, α与kH之比 值与流速无关,而只取决于物系性质与气体状态。 对空气-水系统 对于有机液体和空气系统 结论:对于一定物系,tW只取决于气相状态(H,t)
西北大学化工原理 当流速足够大时,热质传递均以对流为主,且满足: (PrRe023.0 )Pr 048.0 λμ λ αd Cp Nu = Nu = = (Re023.0 ) 33.08.0 D Sc Ddk Sh ShSc H ρμ = = = ≈ 09.1/ H α k ≈ 09.2~67.1/ H α k 这样,在温度不变、流速较大时, α与kH之比 值与流速无关,而只取决于物系性质与气体状态。 对空气-水系统 对于有机液体和空气系统 结论:对于一定物系,tW只取决于气相状态(H,t)