
第三章染色体制备与分析 实验一大白鼠骨髓细胞染色体的制备及观察 一、目的要求 (1)初步掌握大白鼠骨髓细胞染色体制作方法: (2)熟悉大白鼠染色体特征。 二、实验原理 用适量的秋水仙素溶液注入动物体内,抑制分裂细胞纺锤丝的形成,从 而积累大量的分裂中期的骨髓细胞。通过常规制片方法,观察大白鼠骨髓细 胞的染色体。 三、实验用品 1.材料:小鼠、蟾蜍、大白鼠、家兔染色体制片标本、染色体电视录 像片或勾灯片。 2器材:解剖板、解剖剪、大小镊子、吸管、离心管、注射器、离心 机、培养皿、恒温水浴锅、量筒、预冷载玻片、酒精灯、普通天平、香柏油、 二甲苯、擦镜纸。 3.试剂:200μgml秋水仙素、0.075MKC低渗液、甲醇、冰乙酸、 pH6.8磷酸盐缓冲液、Giemsa原液、生理盐水。 四、内容与方法 1 大白鼠骨髓细胞染色体制备及观察: (1)大白鼠骨髓细胞染色体标本的制备:选择体重在18~20g的健 康大白鼠,在实验前2~3小时,于腹腔注射200μgml秋水仙素(注射量按 2μgml秋水仙素4μgg体重计算)。 1)取材:用颈椎脱白法处死大白鼠,将其置于解剖板上,剪开后肢 皮肤和肌肉,取出完整的股骨(从髋关节至膝关节),然后剔除肌肉、肌腱, 用生理盐水洗净。 2)收集细胞:剪去股骨两头,用注射器针头吸入低渗液约1ml,插 入骨髓腔中,反复冲洗骨髓细胞于刻度离心管中,至骨髓发白为止。然后用
1 第三章 染色体制备与分析 实验一 大白鼠骨髓细胞染色体的制备及观察 一、目的要求 (1) 初步掌握大白鼠骨髓细胞染色体制作方法; (2) 熟悉大白鼠染色体特征。 二、实验原理 用适量的秋水仙素溶液注入动物体内,抑制分裂细胞纺锤丝的形成,从 而积累大量的分裂中期的骨髓细胞。通过常规制片方法,观察大白鼠骨髓细 胞的染色体。 三、实验用品 1. 材料:小鼠、蟾蜍、大白鼠、家兔染色体制片标本、染色体电视录 像片或幻灯片。 2. 器材:解剖板、解剖剪、大小镊子、吸管、离心管、注射器、离心 机、培养皿、恒温水浴锅、量筒、预冷载玻片、酒精灯、普通天平、香柏油、 二甲苯、擦镜纸。 3. 试剂:200μg/ml 秋水仙素、0.075M KCl 低渗液、甲醇、冰乙酸、 pH6.8 磷酸盐缓冲液、Giemsa 原液、生理盐水。 四、内容与方法 1. 大白鼠骨髓细胞染色体制备及观察: (1) 大白鼠骨髓细胞染色体标本的制备:选择体重在 18~20g 的健 康大白鼠,在实验前 2~3 小时,于腹腔注射 200μg/ml 秋水仙素(注射量按 2μg/ml 秋水仙素 4μg/g 体重计算)。 1) 取材:用颈椎脱臼法处死大白鼠,将其置于解剖板上,剪开后肢 皮肤和肌肉,取出完整的股骨(从髋关节至膝关节),然后剔除肌肉、肌腱, 用生理盐水洗净。 2) 收集细胞:剪去股骨两头,用注射器针头吸入低渗液约 1ml,插 入骨髓腔中,反复冲洗骨髓细胞于刻度离心管中,至骨髓发白为止。然后用

吸管吹打骨髓细胞使其分散。 3)低渗处理:假如预热37℃的低渗液至7m1,用吸管轻轻吹打混匀, 置于37℃恒温水浴锅中,保温30分钟后取出,然后加入1ml新配制的甲醇 冰醋酸(3:1固定液)预固定,混匀后以800~1000转/分离心8分钟。 4)固定:弃去上清液。留下沉淀物加入固定液5ml,用吸管吹打混匀, 室温放置30分钟,离心。 5)再固定:方法同4。 6)制备细胞悬液:弃去上清液,留下沉淀物,加入新鲜固定液0.2~ 0.4l(视细胞多少而定)混匀,制成细胞悬液。 7)滴片:用吸管吸取细胞悬液少许,滴在清洁预冷的载玻片上,每 片滴2~3滴(不要重叠),然后顺玻片斜面用口轻轻吹散,晾干或酒精等火 焰干燥。 8)染色:用Giemsa原液和磷酸盐缓冲液(pH6.8)l:9配成Giemsa 染液,在玻片标本上滴几滴Giemsa染液铺匀。染色约为10分钟,倒去染液, 用自来水缓缓冲洗干净,晾干。 (2)观察:将标本细胞面朝上,置于低倍镜下观察,可见有较大的 原形的间期细胞核,寻找染色体分散的中期分裂相,移至视野中央,然后转 换油镜观察。 细胞中染色体的计数:为了避免计数时重复和遗漏,在计数前应先按该 细胞的染色体自然分布状态,大致划分为几个区域,然后按顺序数出各区域 染色体的实际数目,最后加在一起,即为该细胞染色体的总数。大鼠二倍体 细胞染色体数目,2n=42。 2. 实验动物染色体核型的观察 家兔、大白鼠、大。蜍等动物常作为生物学和医学的实验动物,如肿瘤 致畸等都是以动物为模型。因此,医学学生了解这些实验动物的核型非常必 (1)家兔染色体核型:家兔二倍体细胞中染色体,2=44,其雄性染色 体为XY型,雌性为XX型,油镜下可见到细胞中有三种类型的染色体:即 中央着丝粒染色体、亚中着丝粒染色体和近端着丝粒染色体。按照染色体大 小和着丝粒的位置可将染色体分为五组。 组号 染色体号 形态大小 着丝粒位置 A组 1~2 最大 中央 B组 3-8+X 较大 亚中,X在5~6之间 C组 913 中等 9号中央,余为亚中 D组 1417 较小 中央 E组 18~21+y 最小 近端,Y在19~20之间
2 吸管吹打骨髓细胞使其分散。 3) 低渗处理:假如预热 37℃的低渗液至 7ml,用吸管轻轻吹打混匀, 置于 37℃恒温水浴锅中,保温 30 分钟后取出,然后加入 1ml 新配制的甲醇、 冰醋酸(3:1 固定液)预固定,混匀后以 800~1000 转/分离心 8 分钟。 4) 固定:弃去上清液。留下沉淀物加入固定液 5ml,用吸管吹打混匀, 室温放置 30 分钟,离心。 5) 再固定:方法同 4。 6) 制备细胞悬液:弃去上清液,留下沉淀物,加入新鲜固定液 0.2~ 0.4ml(视细胞多少而定)混匀,制成细胞悬液。 7) 滴片:用吸管吸取细胞悬液少许,滴在清洁预冷的载玻片上,每 片滴 2~3 滴(不要重叠),然后顺玻片斜面用口轻轻吹散,晾干或酒精等火 焰干燥。 8) 染色:用 Giemsa 原液和磷酸盐缓冲液(pH6.8)1:9 配成 Giemsa 染液,在玻片标本上滴几滴 Giemsa 染液铺匀。染色约为 10 分钟,倒去染液, 用自来水缓缓冲洗干净,晾干。 (2) 观察:将标本细胞面朝上,置于低倍镜下观察,可见有较大的 原形的间期细胞核,寻找染色体分散的中期分裂相,移至视野中央,然后转 换油镜观察。 细胞中染色体的计数:为了避免计数时重复和遗漏,在计数前应先按该 细胞的染色体自然分布状态,大致划分为几个区域,然后按顺序数出各区域 染色体的实际数目,最后加在一起,即为该细胞染色体的总数。大鼠二倍体 细胞染色体数目,2n=42。 2. 实验动物染色体核型的观察: 家兔、大白鼠、大蟾蜍等动物常作为生物学和医学的实验动物,如肿瘤, 致畸等都是以动物为模型。因此,医学学生了解这些实验动物的核型非常必 要。 (1)家兔染色体核型:家兔二倍体细胞中染色体,2n=44,其雄性染色 体为 XY 型,雌性为 XX 型,油镜下可见到细胞中有三种类型的染色体:即 中央着丝粒染色体、亚中着丝粒染色体和近端着丝粒染色体。按照染色体大 小和着丝粒的位置可将染色体分为五组。 组号 染色体号 形态大小 着丝粒位置 A 组 B 组 C 组 D 组 E 组 1~2 3~8+X 9~13 14~17 18~21+Y 最大 较大 中等 较小 最小 中央 亚中,X 在 5~6 之间 9 号中央,余为亚中 中央 近端,Y 在 19~20 之间
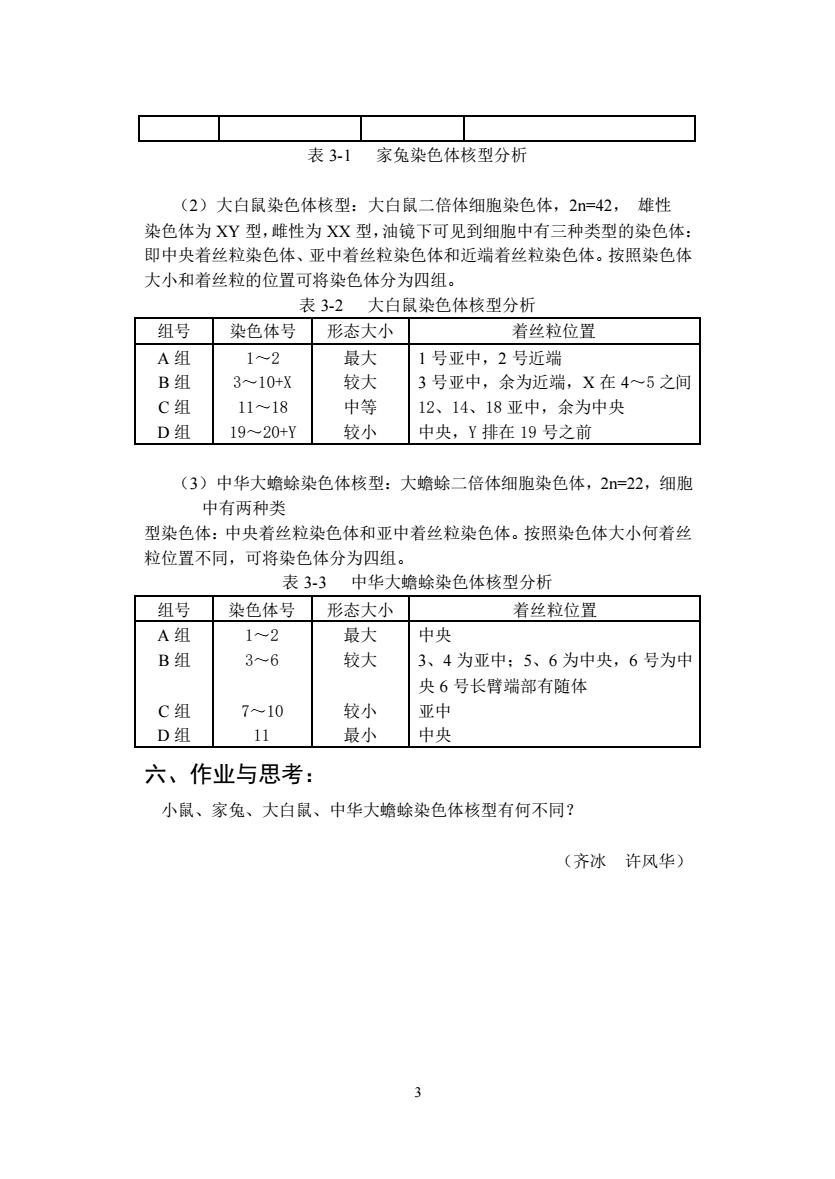
表3-1家免染色体核型分析 (2)大白鼠染色体核型:大白鼠二倍体细胞染色体,2=42,雄性 染色体为XY型,雕性为XX型,油镜下可见到细胞中有三种类型的染色体: 即中央着丝粒染色体、亚中着丝粒染色体和近端着丝粒染色体。按照染色体 大小和着丝粒的位置可将染色体分为四组。 表3-2大白鼠染色体核型分析 组号染色体号形态大小 若丝粒位罔 A组 1-2 最大 1号亚中,2号近端 B组 310+X 较大 3号亚中,余为近端,X在4~5之间 C组 11-18 中等 12、14、18亚中,余为中央 D组 19~20+Y 较小 中央,Y排在19号之前 (3)中华大蟾蜍染色体核型:大蟾蜍二倍体细胞染色体, 2n=22,细胞 中有两种类 型染色体:中央着丝粒染色体和亚中着丝粒染色体。按照染色体大小何着丝 粒位置不同,可将染色体分为四组。 表3-3中华大蟾蜍染色体核型分析 组号染色体号形态大小 着丝粒位置 A组 12 最大 中央 B组 3A-6 较大 3、4为亚中:5、6为中央,6号为中 央6号长臂端部有随体 C组 7~-10 较小 亚中 D组 11 最小 中央 六、作业与思考: 小鼠、家兔、大白鼠、中华大蟾蜍染色体核型有何不同? (齐冰许风华) 2
3 表 3-1 家兔染色体核型分析 (2)大白鼠染色体核型:大白鼠二倍体细胞染色体,2n=42, 雄性 染色体为 XY 型,雌性为 XX 型,油镜下可见到细胞中有三种类型的染色体: 即中央着丝粒染色体、亚中着丝粒染色体和近端着丝粒染色体。按照染色体 大小和着丝粒的位置可将染色体分为四组。 表 3-2 大白鼠染色体核型分析 (3)中华大蟾蜍染色体核型:大蟾蜍二倍体细胞染色体,2n=22,细胞 中有两种类 型染色体:中央着丝粒染色体和亚中着丝粒染色体。按照染色体大小何着丝 粒位置不同,可将染色体分为四组。 表 3-3 中华大蟾蜍染色体核型分析 六、作业与思考: 小鼠、家兔、大白鼠、中华大蟾蜍染色体核型有何不同? (齐冰 许风华) 组号 染色体号 形态大小 着丝粒位置 A 组 B 组 C 组 D 组 1~2 3~10+X 11~18 19~20+Y 最大 较大 中等 较小 1 号亚中,2 号近端 3 号亚中,余为近端,X 在 4~5 之间 12、14、18 亚中,余为中央 中央,Y 排在 19 号之前 组号 染色体号 形态大小 着丝粒位置 A 组 B 组 C 组 D 组 1~2 3~6 7~10 11 最大 较大 较小 最小 中央 3、4 为亚中;5、6 为中央,6 号为中 央 6 号长臂端部有随体 亚中 中央

实验二人类外周血淋巴细胞培养及染色体标本 制备 一、实验目的 1、了解人体外周血淋巴细胞短期培养的原理及方法。 2、初步掌握人外周血淋巴细胞染色体的制备技术。 二、实验原理 健康成年人体内的淋巴细胞总数约有500×10°,其中约有2%在外周血 中循环。在外周血的淋巴细胞中,以小淋巴细胞为主(每毫升血中的含量可 达13×10个)。在通常情况下,它们都处于间期的G或G期,所以很难 见到正在分裂的淋巴细胞。但是,Nowell(1960)发现,从芸豆(phaseolus vulgaris)中提取的能使红细胞凝集的物质一植物血球凝集素 (phytohemagglutinin,PHA)可以刺激淋巴细胞进行有丝分裂。在PHA的 作用下,处在G期的淋巴细胞可转化成淋巴母细胞,重新进入增殖周期进 行有丝分裂,当体外培养至72小时左右时,大多数淋巴细胞已处于第二增 殖周期内,此时用有丝分裂的阻断剂秋水仙素(colchicine)处理细胞可使 正在分裂的细胞都停止在中期,再经低渗、固定等处理,便可得到较多可供 分析的中期染色体。以外周血为材料制备淋巴细胞染色体标本具有取材方 便,用血量少(0.3~1.0咖1即可),培养简单等优点,故该方法在临床上 已得到广泛的应用。 三、实验用品 1、器材:超净工作台(或无菌接种箱)、光学显微镜(附照相装置) 隔水式恒温培养箱、干燥箱、水平式离心机、冰箱、恒温水浴箱、高压蒸气 消毒锅、真空泵(或电动吸引器)、10ml刻度离心管、10ml培养瓶(可用 环磷酰胺药瓶代)、2l注射器、吸管、滴管、试管架、三角烧瓶、染色缸、 酒精灯、各种试剂瓶、载玻片、镊子、吸水纸、洗耳球、塘瓷盘、铝制饭盒 消毒用酒精棉球与碘酒棉球等。 2、材料:人外周血 3、试剂:RPMI1640培养液(含1020%小牛血清)、碳酸氢钠(AR)、 PHA、青霉素、链霉素、肝素、5%NaHCO3溶液、lmol/LHC1、三蒸水或双 蒸水、0.075mol/LKC1、甲醇、冰乙酸、Giemsa原液,pH6.8的磷酸缓冲 液。 4
4 实验二 人类外周血淋巴细胞培养及染色体标本 制备 一、实验目的 1、了解人体外周血淋巴细胞短期培养的原理及方法。 2、初步掌握人外周血淋巴细胞染色体的制备技术。 二、实验原理 健康成年人体内的淋巴细胞总数约有 500×109,其中约有 2%在外周血 中循环。在外周血的淋巴细胞中,以小淋巴细胞为主(每毫升血中的含量可 达 1~3×106 个)。在通常情况下,它们都处于间期的 G0 或 G1 期,所以很难 见到正在分裂的淋巴细胞。但是,Nowell(1960)发现,从芸豆(phaseolus vulgaris)中提取的能使红细胞凝集的物质一植物血球凝集素 (phytohemagglutinin,PHA)可以刺激淋巴细胞进行有丝分裂。在 PHA 的 作用下,处在 G0 期的淋巴细胞可转化成淋巴母细胞,重新进入增殖周期进 行有丝分裂,当体外培养至 72 小时左右时,大多数淋巴细胞已处于第二增 殖周期内,此时用有丝分裂的阻断剂秋水仙素(colchicine)处理细胞可使 正在分裂的细胞都停止在中期,再经低渗、固定等处理,便可得到较多可供 分析的中期染色体。以外周血为材料制备淋巴细胞染色体标本具有取材方 便,用血量少(0.3~1.0ml 即可),培养简单等优点,故该方法在临床上 已得到广泛的应用。 三、实验用品 1、器材:超净工作台(或无菌接种箱)、光学显微镜(附照相装置)、 隔水式恒温培养箱、干燥箱、水平式离心机、冰箱、恒温水浴箱、高压蒸气 消毒锅、真空泵(或电动吸引器)、10ml 刻度离心管、10ml 培养瓶(可用 环磷酰胺药瓶代)、2ml 注射器、吸管、滴管、试管架、三角烧瓶、染色缸、 酒精灯、各种试剂瓶、载玻片、镊子、吸水纸、洗耳球、搪瓷盘、铝制饭盒、 消毒用酒精棉球与碘酒棉球等。 2、材料:人外周血 3、试剂:RPMI l640 培养液(含 10~20%小牛血清)、碳酸氢钠(AR)、 PHA、青霉素、链霉素、肝素、5%NaHCO3 溶液、1mol/L HCl、三蒸水或双 蒸水、0.075 mol/L KCl、甲醇、冰乙酸、Giemsa 原液,pH6.8 的磷酸缓冲 液

四、实验内容与方法 (一)器材的清洗 1、培养用瓶的清洗:将培养瓶放入肥皂水中煮沸30分钟,并趁热刷洗 瓶内,然后用自来水将皂液冲净,干后置硫酸一重铬酸钾洗液中浸泡24小 时左右,从洗液中取出的小瓶立即用自来水充分冲洗15次,接着用蒸馏水 冲洗5次,双蒸水神洗3次,然后将小瓶倒立在铝饭盒中,置于烤箱将其烤 干,最后盖上饭盒盖放入高压蒸气消毒锅中灭菌。其它玻璃器皿的清洗消毒 与上述操作基本相同. 2、玻璃除菌滤器的清洗:新购置的玻璃除菌滤器先用肥皂水刷洗并用 自来水冲洗干净:再将滤器安置在抽滤瓶上,倒满浓硫酸后进行抽滤,使浓 硫酸全部通过滤板,然后用蒸馏水多次抽滤,使残留的酸全部除去,再用双 蒸水滤过两次,置110℃烤箱中2小时(温度不要过高:以免使玻璃析出碱 性物质):取出后用牛皮纸包扎出入口置高压蒸气消毒锅中灭菌。抽滤过不 含血清的培养液的滤器可直接用蒸瘤水油滤洗涤。但油滤讨血清或P阳A的浅 器必须用浓硫酸浸泡一天(将滤器中盛满浓硫酸,不加负压)后,再将剩余 的硫酸抽完,然后用蒸馏水彻底冲洗。 3、橡胶瓶盖的清洗:橡皮塞清洗较简单:可直接放入肥皂水中煮沸30 分钟,然后用自来水充分冲洗,再用蒸溜水煮沸0分钟,取出后用蒸馏水、 双蒸水、各冲洗两次,放入100℃烤箱中烘干,置饭盒中:高压灭菌备用。 4、载波片的清洗:新载玻片先用肥皂水逐一洗一遍,用自来水彻底冲 洗干净,再逐一投入到95%的酒精中浸泡一夜(可在其中长期保存),用 前一小时捞出,然后放入蒸馏水中置入冰箱预冷。 (二)培养液及各种试剂的配制 1.青霉素液: 一瓶80万单位的青霉素,将其溶于40ml双蒸水中,即 成每毫升20000单位的使用液。在培养液中的最终浓度为100单位/ml。 2.链福茶液:取一瓶100万单位的硫酸链霉素粉剂,容于50m1双蒸水 中,即成每毫升20000单位的使用液。在培养液中的最终浓度为100单位/m1。 3.0.075mol1LKC1低渗液: 钾(KCI) 溶于500ml蒸馏水中 4.秋水仙素液:称取秋水仙素5mg溶于100ml0.85NaC1中,配制成50 μg/血l的原液,再用生理盐水稀释成5μg/ml的工作液,然后用G玻璃滤 器除菌,分装成小瓶置4℃冰箱避光。使用时,每5ml培养液用5号针头加 2滴(约0.05ml,相当于205μg),使培养液中秋水仙素的终浓度达0.05 μg/ml左右 5.肝素抗凝剂:肝素注射液1支(12500单位)用25ml灭菌生理盐水 在超净工作台中稀释成500单位/ml的使用液,使用时每毫升血加0.2ml开 素液(100单位肝素液一般可抗凝5ml血)。若购得的肝素为粉剂,可配成 4mg/m1的浓度,由于每毫克含125单位,故浓度也是500单位/ml。 6.pH6.8磷酸缓冲液:称取NaP0,.12H011.8g(或5.92g
5 四、实验内容与方法 (一)器材的清洗 1、培养用瓶的清洗:将培养瓶放入肥皂水中煮沸 30 分钟,并趁热刷洗 瓶内,然后用自来水将皂液冲净,干后置硫酸一重铬酸钾洗液中浸泡 24 小 时左右,从洗液中取出的小瓶立即用自来水充分冲洗 15 次,接着用蒸馏水 冲洗 5 次,双蒸水冲洗 3 次,然后将小瓶倒立在铝饭盒中,置于烤箱将其烤 干,最后盖上饭盒盖放入高压蒸气消毒锅中灭菌。其它玻璃器皿的清洗消毒 与上述操作基本相同. 2、玻璃除菌滤器的清洗:新购置的玻璃除菌滤器先用肥皂水刷洗并用 自来水冲洗干净;再将滤器安置在抽滤瓶上,倒满浓硫酸后进行抽滤,使浓 硫酸全部通过滤板,然后用蒸馏水多次抽滤,使残留的酸全部除去,再用双 蒸水滤过两次,置 110℃烤箱中 2 小时(温度不要过高;以免使玻璃析出碱 性物质);取出后用牛皮纸包扎出入口置高压蒸气消毒锅中灭菌。抽滤过不 含血清的培养液的滤器可直接用蒸馏水抽滤洗涤。但抽滤过血清或 PHA 的滤 器必须用浓硫酸浸泡一天(将滤器中盛满浓硫酸,不加负压)后,再将剩余 的硫酸抽完,然后用蒸馏水彻底冲洗。 3、橡胶瓶盖的清洗:橡皮塞清洗较简单;可直接放入肥皂水中煮沸 30 分钟,然后用自来水充分冲洗, 再用蒸溜水煮沸 30 分钟,取出后用蒸馏水、 双蒸水、各冲洗两次,放入 100℃烤箱中烘干,置饭盒中;高压灭菌备用。 4、载波片的清洗:新载玻片先用肥皂水逐一洗一遍,用自来水彻底冲 洗干净,再逐一投入到 95%的酒精中浸泡一夜(可在其中长期保存),用 前一小时捞出,然后放入蒸馏水中置入冰箱预冷。 (二)培养液及各种试剂的配制 1.青霉素液:取一瓶 80 万单位的青霉素,将其溶于 40ml 双蒸水中,即 成每毫升 20000 单位的使用液。在培养液中的最终浓度为 100 单位/ml。 2.链霉素液:取一瓶 100 万单位的硫酸链霉素粉剂,溶于 50ml 双蒸水 中,即成每毫升20000单位的使用液。在培养液中的最终浓度为100单位/ml。 3. 0.075 mol/ . L KCl 低渗液: 氯化钾(KCl) 2.79g 溶于 500ml 蒸馏水中。 4.秋水仙素液:称取秋水仙素 5mg 溶于 100ml 0.85NaCl 中,配制成 50 μg/ml 的原液,再用生理盐水稀释成 5μg/ml 的工作液,然后用 G5 玻璃滤 器除菌,分装成小瓶置 4 0 C 冰箱避光。使用时,每 5ml 培养液用 5 号针头加 2 滴(约 0.05ml,相当于 205μg),使培养液中秋水仙素的终浓度达 0.05 μg/ml 左右。 5. 肝素抗凝剂:肝素注射液 1 支(12500 单位)用 25ml 灭菌生理盐水 在超净工作台中稀释成 500 单位/ml 的使用液,使用时每毫升血加 0.2ml 肝 素液(100 单位肝素液一般可抗凝 5ml 血)。若购得的肝素为粉剂,可配成 4mg/ml 的浓度,由于每毫克含 125 单位,故浓度也是 500 单位/ml。 6. pH6.8 磷 酸 缓 冲 液 : 称 取 Na2HPO4 .12H20 11.8g ( 或 5.92g

视配 8.PHA溶液:取粉剂PH1支(10mg),溶于2ml无菌生理盐水中,使用 时每5ml培养液加0.2`0.3ml,使培养液中PHA的浓度达到200`300ug/ml (其他溶液配制参附录)。 (三)人微量外周血淋巴细胞培养 1、采血:用2.5m1一次性注射器抽取肝素使用液0.2m1:湿润针管, 然后将多余的肝素排除。常规消毒被检查者肘部皮肤,从肘部静脉采血】 毫升。 2、接种:在无菌室或超净工作台内按无菌操作将抽得的抗凝血分装于 2个含培养液的培养瓶中(可将针头直接插入培养瓶的橡皮塞注入血液 0.3~0.5ml)。轻轻摇匀。 3、培养:将接种了人血的培养瓶放入隔水式恒温培养箱中,37℃培养 72小时。 (四)染色体标本的制备 1、秋水仙素处理:在收获细胞前3~4小时用1ml注射器(装5号针头) 加入浓度为5μg/ml的秋水仙素2滴,使培养液中的秋水仙素终浓度为 0.05μg/ml。轻轻摇匀,放回培养箱中继续培养34小时 2、终止培养(收获细胞):取出培养瓶,用吸管将培养物混匀,并移 至10ml刻度离心管内,平衡后放入离心机,以1000r/min离心8~10分钟 吸弃上清液。 3、低渗处理:往离心管中加入8ml预温至37℃的0.075mol/L的KC1, 用吸管混合均匀,置37℃恒温水浴箱中低渗10~25分钟(精确的低渗时间 应自行摸索) 4、周定: ①预固定:低渗处理完成后,加入1l新配制的固定液并混合均匀,放 入离心机,以1000r/min离心8一10分钟。吸弃上清夜。 ②固定:加入81固定液,用吸管将沉淀的细胞轻轻混合成细胞悬液, 1000r/min离心8-10分钟。吸弃上清液. ③再固定:加入8ml固定液,用吸管轻轻吹打使细胞混匀,l000r/mi 离心810分钟,吸弃上清液。 5、制片:视离心管中沉淀(细胞)的多少加入0.2~0.4l左右的固 定液,用吸管轻轻混成细胞悬液(混合后固定液呈少许乳白色即表示细胞浓 度适当)。用吸管吸取细胞悬液以35cm高的距离滴至冷冻的载玻片上,每 片滴2~3滴,立即对准玻片吹一口气以助细胞的分散并立即将玻片在酒精 灯火焰上来回过几下(勿全烤干),空气中晾干。 6
6 Na2HPO4 .2H20),KH2PO4 4.50g 溶于 1000ml 蒸馏水中即成。 7.固定液:用 3 份甲醇和 1 份醋酸混合而成,现用现配。 8.PHA 溶液:取粉剂 PHA1 支(10mg),溶于 2ml 无菌生理盐水中,使用 时每 5ml 培养液加 0.2 ~ 0.3ml,使培养液中 PHA 的浓度达到 200 ~ 300ug/ml (其他溶液配制参附录)。 (三)人微量外周血淋巴细胞培养 1、采血:用 2.5ml 一次性注射器抽取肝素使用液 0.2ml;湿润针管, 然后将多余的肝素排除。常规消毒被检查者肘部皮肤,从肘部静脉采血 1 毫升。 2、接种:在无菌室或超净工作台内按无菌操作将抽得的抗凝血分装于 2 个含培养液的培养瓶中(可将针头直接插入培养瓶的橡皮塞注入血液 0.3~0.5 ml)。轻轻摇匀。 3、培养:将接种了人血的培养瓶放入隔水式恒温培养箱中,37℃培养 72 小时。 (四)染色体标本的制备 l、秋水仙素处理:在收获细胞前 3~4 小时用 lml 注射器(装 5 号针头) 加入浓度为 5μg/ml 的秋水仙素 2 滴,使培养液中的秋水仙素终浓度为 0.05μg/ml。轻轻摇匀,放回培养箱中继续培养 3~4 小时。 2、终止培养(收获细胞):取出培养瓶,用吸管将培养物混匀,并移 至 10ml 刻度离心管内,平衡后放入离心机,以 1000r/min 离心 8~10 分钟, 吸弃上清液。 3、低渗处理:往离心管中加入 8ml 预温至 37℃ 的 0.075mol/L 的 KCl, 用吸管混合均匀,置 37℃恒温水浴箱中低渗 10~25 分钟(精确的低渗时间 应自行摸索) 4、固定: ①预固定:低渗处理完成后,加入 lml 新配制的固定液并混合均匀,放 入离心机,以 1000r/min 离心 8~10 分钟。吸弃上清液。 ②固定:加入 8ml 固定液,用吸管将沉淀的细胞轻轻混合成细胞悬液, 1000r/min 离心 8~10 分钟。吸弃上清液。 ③再固定:加入 8ml 固定液,用吸管轻轻吹打使细胞混匀,1000r/min 离心 8~10 分钟,吸弃上清液。 5、制片:视离心管中沉淀(细胞)的多少加入 0.2~0.4 ml 左右的固 定液,用吸管轻轻混成细胞悬液(混合后固定液呈少许乳白色即表示细胞浓 度适当)。用吸管吸取细胞悬液以 35cm 高的距离滴至冷冻的载玻片上,每 片滴 2~3 滴,立即对准玻片吹一口气以助细胞的分散并立即将玻片在酒精 灯火焰上来回过几下(勿全烤干),空气中晾干

6、染色:如果所制备的标本用于染色体的非显带分析,则将晾干的玻 片标本用Giemsa染液(用l份Giemsa原液加9份plH6.8的磷酸缓冲液混合 而成)染色5~10分钟。在自来水管下用细水轻轻冲洗晾干。 7、镜检:将所制备人染色体玻片放到显微镜下,先用低倍镜寻找染色 体分散良好的中期分裂相转换油镜仔细观察(参考第七章中染色体照片)。 (五)注意事项 1.培养箱的温度应严格控制在37±0.5℃。 2.培养基的H值应调整到7.2~7.4之间,偏酸时细胞发有不良,偏 碱时细胞会出现轻度固缩。 3。在采血或接种时,注意不要使用太多的肝素,因为肝素过多会抑制 淋巴细胞的转化,但也不宜太少,否则出现凝血现象。如果培养物中出现膜 状凝块,可轻摇培养瓶使凝块散开。4.注意盖紧培养瓶口,以免培养过程中 培养液的山发生较大变化。如果培养液变黄,说明偏酸,此时可加入无菌 的2%aHC0,溶液或另加2~3毫升培养液进行调整。 5.PA的质与量是人体淋巴细胞培养成败的关键,一般使用量为每毫 升培养液200~300微克(市售10毫克安瓿装P用2毫升生理盐水稀释, 每瓶培养物加0.2~0.3毫升)。由于不同米源和保存时间不同的PH其效价 会有差异,所以,精确的其用量应自行摸索。PHA的量也不宜过大,否则会 导致红细胞疑集。 6.所用的玻璃器皿都应十分洁净,各种试剂尽量选用分析纯的 7.配制培养液等溶液所用的双蒸水宜用玻璃蒸馏器制备。 8.离心机最好用水平式的,速度宜用1000~2000pm,如太高,沉降 在管底的细胞团不宜打散:太低,分裂相容易丢失。如果低渗后离心速度过 高,则会使分裂细胞过早破裂,在最后制成的标本中,完整分裂相过少。 9.秋水仙素的处理时间和使用浓度,应随实验的要求而异。若从能得 到足够量的中期分裂相考虑,秋水仙素的处理时间宜长些,所用的浓度宜高 些:但从能得到较为细长的染色体(便于分带)考虑,处理时间宜短些,所 用浓度宜低些。应注意,秋水仙素用量过多或作用时间过长,会导致染色体 过分收缩或着丝粒分离,甚至染色体破碎。 10.收获前的所有操作过程应保持高度的无菌概念,严防细菌和病毒的 污染。 11.低渗时间的长短关系到染色体分散的好坏,精确的时间应自行摸 索。 12.固定液应现配现用,固定应彻底,吹打要均匀,用力不要过猛,以 避免细胞破裂,染色体丢失。 13.固定剂也可用乙醇和冰酷酸混合(3:1),但甲醇的使用较乙醇更 为广泛,因为甲醇可使标本更为清晰,但要注意的是这种固定剂应现配现用, 存放后会产生沉淀,影响固定的效果
7 6、染色:如果所制备的标本用于染色体的非显带分析,则将晾干的玻 片标本用 Giemsa 染液(用 1 份 Giemsa 原液加 9 份 pH6.8 的磷酸缓冲液混合 而成)染色 5~10 分钟。在自来水管下用细水轻轻冲洗晾干。 7、镜检:将所制备人染色体玻片放到显微镜下,先用低倍镜寻找染色 体分散良好的中期分裂相转换油镜仔细观察(参考第七章中染色体照片)。 (五)注意事项 1. 培养箱的温度应严格控制在 37±0.5℃。 2. 培养基的 pH 值应调整到 7.2~7.4 之间,偏酸时细胞发育不良,偏 碱时细胞会出现轻度固缩。 3. 在采血或接种时,注意不要使用太多的肝素,因为肝素过多会抑制 淋巴细胞的转化,但也不宜太少,否则出现凝血现象。如果培养物中出现膜 状凝块,可轻摇培养瓶使凝块散开。4.注意盖紧培养瓶口,以免培养过程中 培养液的 pH 发生较大变化。如果培养液变黄,说明偏酸,此时可加入无菌 的 2%NaHCO3 溶液或另加 2~3 毫升培养液进行调整。 5. PHA 的质与量是人体淋巴细胞培养成败的关键,一般使用量为每毫 升培养液 200~300 微克(市售 10 毫克安瓿装 PHA 用 2 毫升生理盐水稀释, 每瓶培养物加 0.2~0.3 毫升)。由于不同来源和保存时间不同的 PHA 其效价 会有差异,所以,精确的其用量应自行摸索。PHA 的量也不宜过大,否则会 导致红细胞凝集。 6. 所用的玻璃器皿都应十分洁净,各种试剂尽量选用分析纯的。 7. 配制培养液等溶液所用的双蒸水宜用玻璃蒸馏器制备。 8. 离心机最好用水平式的,速度宜用 1000~2000rpm,如太高,沉降 在管底的细胞团不宜打散;太低,分裂相容易丢失。如果低渗后离心速度过 高,则会使分裂细胞过早破裂,在最后制成的标本中,完整分裂相过少。 9. 秋水仙素的处理时间和使用浓度,应随实验的要求而异。若从能得 到足够量的中期分裂相考虑,秋水仙素的处理时间宜长些,所用的浓度宜高 些;但从能得到较为细长的染色体(便于分带)考虑,处理时间宜短些,所 用浓度宜低些。应注意,秋水仙素用量过多或作用时间过长,会导致染色体 过分收缩或着丝粒分离,甚至染色体破碎。 10. 收获前的所有操作过程应保持高度的无菌概念,严防细菌和病毒的 污染。 11. 低渗时间的长短关系到染色体分散的好坏,精确的时间应自行摸 索。 12. 固定液应现配现用,固定应彻底,吹打要均匀,用力不要过猛,以 避免细胞破裂,染色体丢失。 13. 固定剂也可用乙醇和冰醋酸混合(3:1),但甲醇的使用较乙醇更 为广泛,因为甲醇可使标本更为清晰,但要注意的是这种固定剂应现配现用, 存放后会产生沉淀,影响固定的效果

14.制片中如发现染色体分散不佳,可重复固定或延长固定时间。 15.滴片时如玻片冷却不够或有油污会影响细胞和染色体的分散.要使 染色体分散良好,还要注意细胞的浓度和滴片的技巧等。 16.培养失败的常见原因:①培养瓶等器材未清洗干净:②培养用水不 合要求:③H值不合适:④细菌污染:⑤PHA质量有问题:⑥细胞免疫水平 低下。 五、作业与思考 1.染色体制备的原理是什么? 2.染色体制备过程应注意哪些问题? 3.染色体制备过程有哪些是重要步骤? (刘京昇许风华)
8 14. 制片中如发现染色体分散不佳,可重复固定或延长固定时间。 15. 滴片时如玻片冷却不够或有油污会影响细胞和染色体的分散。要使 染色体分散良好,还要注意细胞的浓度和滴片的技巧等。 16. 培养失败的常见原因:①培养瓶等器材未清洗干净;②培养用水不 合要求;③pH 值不合适;④细菌污染;⑤PHA 质量有问题;⑥细胞免疫水平 低下。 五、作业与思考 1. 染色体制备的原理是什么? 2. 染色体制备过程应注意哪些问题? 3. 染色体制备过程有哪些是重要步骤? (刘京昇 许风华)

实验三人类非显带染色体核型分析 一、实验目的 1、熟悉人类染色体的数目及形态特征 2、掌握非显带染色体的核型分析方法。 二、实验原理 人类非显带染色体核型分析是染色体研究的一项基本内容。它的一般 程序是先利用显微镜照相装置拍摄人类非显带染色体的图像。并放大成染 名休昭片 然后按照国际上统一的标准。将人的46条染色体分成7个组 并编上号。然后将染色体剪贴到专门的报告单上制成染色体核型 (karyotype)图。并检查正常与否,这个过程就称为核型分折。利用核 型分析可以检查某人的染色体数目是否正常。并可发现较大的染色体结构 畸变以及判定性别等。 一个曲型的中期细色体都口纵裂成条伍单体,称地色单 体,由 个者丝粒相连 。每条染色体以着丝粒为界可分 为长 短两个臂 根据着丝粒位置的不同,可将人类的染色体分为中央着丝粒染色体、亚中 央着丝粒染色体和近端着丝粒染色体三类。 三、实验用品 1、器材:光学显微镜、小剪刀、小镊子、胶水、香柏油、擦镜纸 核型分析纸。 2、材料:常规制备的正常人体染色体标本。正常人中期染色体照 片。 四、实验内容与方法 (一)正常人体细胞染色体的观察及计数 取正常人染色体玻片放到显微镜下,先用低倍镜寻找染色体分散良好 的中期分裂相转换油镜仔细观察。 镜下可见,正常人的每一体细胞都含有46条染色体,其中有22对是 男女共有的:称为常染色体(autosome),另外1对则男女相差很大,称 为性染色体(sex some)。每个同学观察2~3个分裂相,并寻找 10个分散良好的分裂相进行染色体计数, 计数前,先按染色体自然分布的图形大致分为几个区域,分别计数 每区的染色体条数,然后加起来即为该细胞的染色体总数。 (二)显微镜下的核型分析 用低倍镜选择分散良好的中期分裂相,在高倍镜下再检查一下中期 分裂相的质量,分散差的、分散过度的 分散的圆形轮廓不太完整的 有染色体重叠的、染色体着色差的或与其它分裂相太靠近的都不要。转 9
9 实验三 人类非显带染色体核型分析 一、实验目的 1、熟悉人类染色体的数目及形态特征。 2、掌握非显带染色体的核型分析方法。 二、实验原理 人类非显带染色体核型分析是染色体研究的一项基本内容。它的一般 程序是先利用显微镜照相装置拍摄人类非显带染色体的图像。并放大成染 色体照片.然后按照国际上统一的标准。将人的 46 条染色体分成 7 个组 并编上号。然后将染色体剪贴到专门的报告单上制成染色体核型 (karyotype)图。并检查正常与否,这个过程就称为核型分折。利用核 型分析可以检查某人的染色体数目是否正常。并可发现较大的染色体结构 畸变以及判定性别等。 一个典型的中期细胞染色体都已纵裂成 2 条染色单体,称姐妹染色单 体,由一个着丝粒相连。每条染色体以着丝粒为界可分为长、短两个臂。 根据着丝粒位置的不同,可将人类的染色体分为中央着丝粒染色体、亚中 央着丝粒染色体和近端着丝粒染色体三类。 三、实验用品 1、器材:光学显微镜、小剪刀、小镊子、胶水、香柏油、擦镜纸、 核型分析纸。 2、材料:常规制备的正常人体染色体标本。正常人中期染色体照 片。 四、实验内容与方法 (一)正常人体细胞染色体的观察及计数 取正常人染色体玻片放到显微镜下,先用低倍镜寻找染色体分散良好 的中期分裂相转换油镜仔细观察。 镜下可见,正常人的每一体细胞都含有 46 条染色体,其中有 22 对是 男女共有的;称为常染色体(autosome),另外 1 对则男女相差很大,称 为性染色体(sex chromosome)。每个同学观察 2~3 个分裂相,并寻找 10 个分散良好的分裂相进行染色体计数。 计数前,先按染色体自然分布的图形大致分为几个区域,分别计数 每区的染色体条数,然后加起来即为该细胞的染色体总数。 (二)显微镜下的核型分析 用低倍镜选择分散良好的中期分裂相,在高倍镜下再检查一下中期 分裂相的质量,分散差的、分散过度的、分散的圆形轮廓不太完整的、 有染色体重叠的、染色体着色差的或与其它分裂相太靠近的都不要。转

换油镜对选择好的分裂相进行仔细观察。根据ISCN规定,人的46条染 色体中的44条男女共有的常染色体(autosome),配成2对,分为A B、C、D、E、F、G七个组。另外一对性染色体(sex chromosome).,也 根据形态大小归类,X染色体归到C组。Y染色体归到G组。 1、按显微镜中所看到的图像,在实验报告纸上描术出各垫色体的快 速线条图,在草图中,应保持各染色体的原有方位和相对长度。 2、按各组染色体的特征对染色体进行分组分 仔细地观察中期分裂 相,寻找1、2和3号染色体,并在草图上的染色体旁标上序号。然后找出 B组、G组(包括Y)、F组和D组染色体,并在各染色体旁标上相应的组号, 再进行E组的16、17和18号染色体的识别,最后鉴定出C组染色体,使草 图上每个染色体旁都标有序号或组号。各组染色体的特征(表3-4) 表3-4 人类染色体分组与形态特征 组别染色体编号大小 着丝粒位置 别痕 色 可鉴别程度 见 1-3 最大 中央着丝粒(1、3号)1号可 无 可鉴别 亚中央着丝粒(2号) 无 4-5 次大 亚中央着丝 难鉴别 见 6~12:X 亚中央着丝粒 9号可 无 粒 13-15 中等 近端着丝 难鉴别 16-18 较小 中央着丝粒(16号) 16号可 无 可鉴别 号) 1920 次小 中央着丝 无 难鉴别 粒 21~22:Y 最小 近端着 21、22有难鉴别 Y可见Y无
10 换油镜对选择好的分裂相进行仔细观察。根据 ISCN 规定,人的 46 条染 色体中的 44 条男女共有的常染色体(autosome),配成 22 对,分为 A、 B、C、D、E、F、G 七个组。另外一对性染色体(sex chromosome),也 根据形态大小归类,X 染色体归到 C 组。Y 染色体归到 G 组。 1、按显微镜中所看到的图像,在实验报告纸上描述出各染色体的快 速线条图,在草图中,应保持各染色体的原有方位和相对长度。 2、按各组染色体的特征对染色体进行分组分析。仔细地观察中期分裂 相,寻找 1、2 和 3 号染色体,并在草图上的染色体旁标上序号。然后找出 B 组、G 组(包括 Y)、F 组和 D 组染色体,并在各染色体旁标上相应的组号, 再进行 E 组的 16、17 和 18 号染色体的识别,最后鉴定出 C 组染色体,使草 图上每个染色体旁都标有序号或组号。各组染色体的特征(表 3-4) 表 3-4 人类染色体分组与形态特征 组别 染色体编号 大小 着丝粒位置 副缢痕 随 体 可鉴别程度 A 1~3 最大 中央着丝粒(1、3 号) 1 号可 见 无 可鉴别 亚中央着丝粒(2 号) 无 B 4~5 次大 亚中央着丝 粒 无 难鉴别 C 6~12;X 中等 亚中央着丝粒 9 号可 见 无 难鉴别 D 13~15 中等 近端着丝 粒 有 难鉴别 E 16~18 较小 中央着丝粒(16 号) 16 号可 见 无 可鉴别 亚中央着丝粒(17、18 号) 无 难鉴别 F 19~20 次小 中央着丝 粒 无 难鉴别 G 21~22;Y 最小 近端着丝 粒 21、22 有 难鉴别 Y 可见 Y 无