
16 沉淀法
16 沉淀法

⚫ 沉淀法是最古老的分离和纯化生物物质的方法, 目前仍广泛应用在工业上和实验室中。 ⚫ 由于其浓缩作用常大于纯化作用,因而沉淀法通 常作为初步分离的一种方法,用于从去除了菌体 或细胞碎片的发酵液中沉淀出生物物质,然后再 利用色层分离等方法进一步提高其纯度。 ⚫ 沉淀法由于成本低、收率高(不会使蛋白质等大分 子失活)、浓缩倍数高可达l0-50倍和操作简单等 优点,是下游加工过程中应用广泛的值得注意的 方法
⚫ 沉淀法是最古老的分离和纯化生物物质的方法, 目前仍广泛应用在工业上和实验室中。 ⚫ 由于其浓缩作用常大于纯化作用,因而沉淀法通 常作为初步分离的一种方法,用于从去除了菌体 或细胞碎片的发酵液中沉淀出生物物质,然后再 利用色层分离等方法进一步提高其纯度。 ⚫ 沉淀法由于成本低、收率高(不会使蛋白质等大分 子失活)、浓缩倍数高可达l0-50倍和操作简单等 优点,是下游加工过程中应用广泛的值得注意的 方法

定义 沉淀是物理环境的变化引起溶质的溶解度降低、 生成固体凝聚物的现象。 沉淀的种类 盐析 等电点沉淀 有机溶剂沉淀 非离子型聚合物沉淀法 聚电解质沉淀法 高价金属离子沉淀法 热沉淀法
定义 沉淀是物理环境的变化引起溶质的溶解度降低、 生成固体凝聚物的现象。 沉淀的种类 盐析 等电点沉淀 有机溶剂沉淀 非离子型聚合物沉淀法 聚电解质沉淀法 高价金属离子沉淀法 热沉淀法
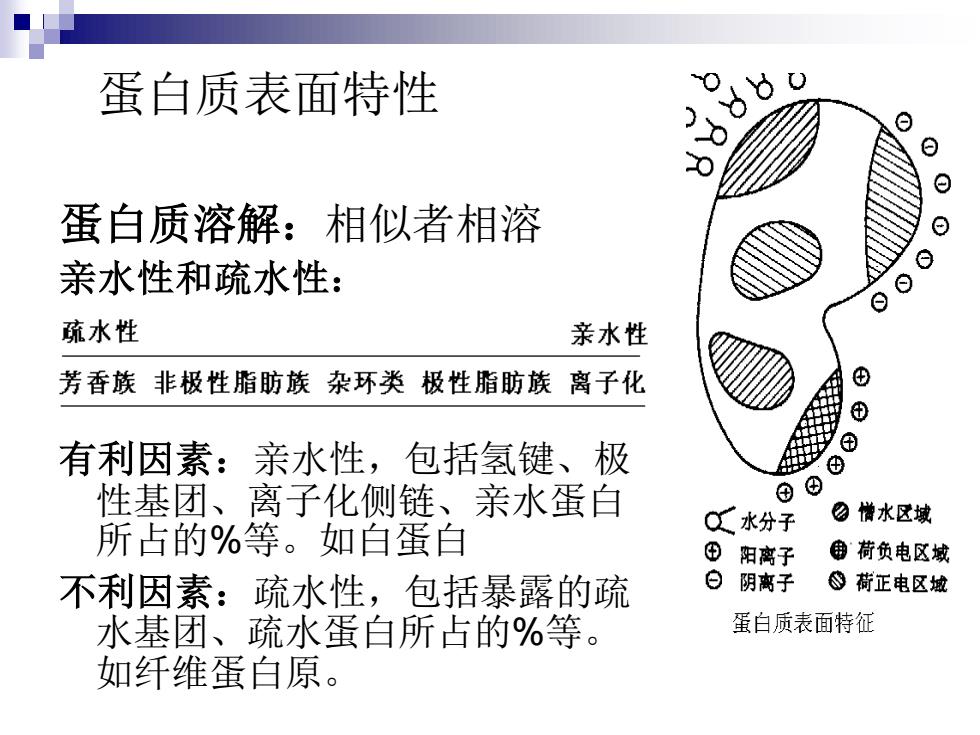
蛋白质表面特性 蛋白质溶解:相似者相溶 亲水性和疏水性: 有利因素:亲水性,包括氢键、极 性基团、离子化侧链、亲水蛋白 所占的%等。如白蛋白 不利因素:疏水性,包括暴露的疏 水基团、疏水蛋白所占的%等。 如纤维蛋白原
蛋白质表面特性 蛋白质溶解:相似者相溶 亲水性和疏水性: 有利因素:亲水性,包括氢键、极 性基团、离子化侧链、亲水蛋白 所占的%等。如白蛋白 不利因素:疏水性,包括暴露的疏 水基团、疏水蛋白所占的%等。 如纤维蛋白原

蛋白质溶液的稳定因素 1)、水化层(hydration shell) tight hydration shell(0.35g water/1g pro) loose hydration shell(2g water /1g pro) 2)、静电排斥 zeta电势 Nernst Potential—胶核表面电位(不可测) Stern Potential—(不可测) Potential—滑面电位(可测,mobility) 水化层 zeta电势 静电排斥 Tight hydration shell Protein core Loose hydration shell
蛋白质溶液的稳定因素 1)、水化层(hydration shell) tight hydration shell(0.35g water/1g pro) loose hydration shell(2g water /1g pro) 2)、静电排斥 zeta电势 Nernst Potential—胶核表面电位(不可测) Stern Potential—(不可测) Potential—滑面电位(可测,mobility) 水化层 zeta电势 静电排斥 Tight hydration shell Protein core Loose hydration shell

16.1 盐析沉淀 定义 蛋白质在高离子强度的溶液中溶解度降低、 发生沉淀的现象称为盐析。 原理 1.高浓度盐离子使蛋白质表面双电层厚度降 低,静电排斥作用减弱. 2.中性盐比蛋白质具更强的亲水性,因此将 与蛋白质争夺水分子
16.1 盐析沉淀 定义 蛋白质在高离子强度的溶液中溶解度降低、 发生沉淀的现象称为盐析。 原理 1.高浓度盐离子使蛋白质表面双电层厚度降 低,静电排斥作用减弱. 2.中性盐比蛋白质具更强的亲水性,因此将 与蛋白质争夺水分子
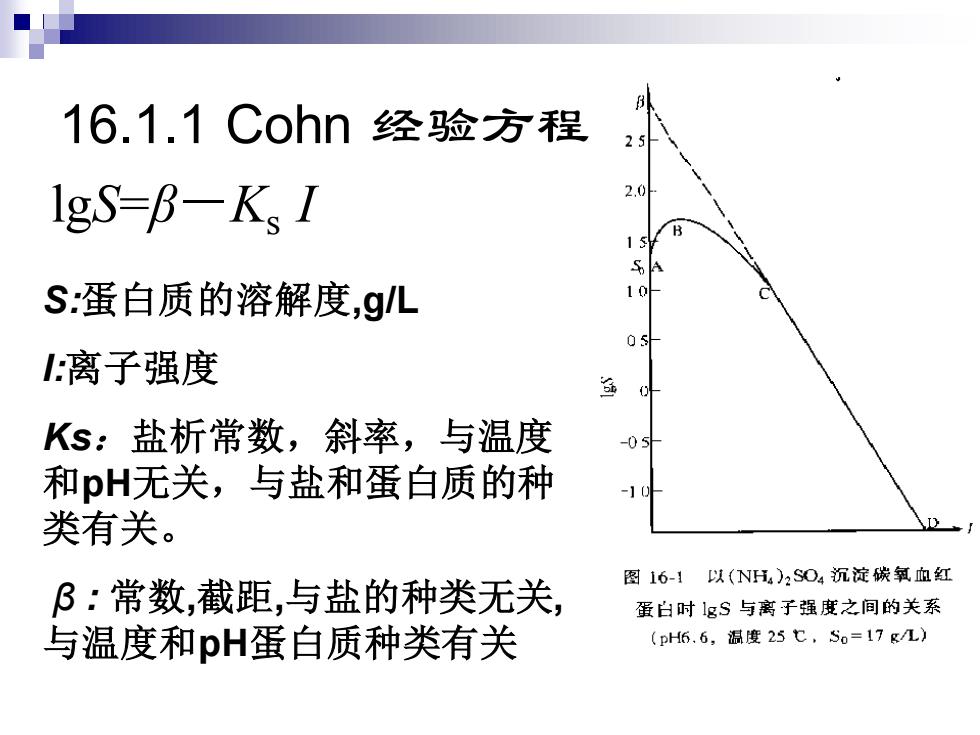
16.1.1 Cohn 经验方程 lgS=β-Ks I S:蛋白质的溶解度,g/L I:离子强度 Ks:盐析常数,斜率,与温度 和pH无关,与盐和蛋白质的种 类有关。 β : 常数,截距,与盐的种类无关, 与温度和pH蛋白质种类有关
16.1.1 Cohn 经验方程 lgS=β-Ks I S:蛋白质的溶解度,g/L I:离子强度 Ks:盐析常数,斜率,与温度 和pH无关,与盐和蛋白质的种 类有关。 β : 常数,截距,与盐的种类无关, 与温度和pH蛋白质种类有关

盐析用盐要求 盐析作用强 该盐有足够大的溶解度,适于低温操作 生物惰性 密度小 来源丰富
盐析用盐要求 盐析作用强 该盐有足够大的溶解度,适于低温操作 生物惰性 密度小 来源丰富

16.1.2 盐析的影响因素 蛋白质的种类 蛋白质的种类不同,Ks值会有所不同; 分子量越大,沉淀所需盐的量越少; 蛋白质分子不对称性越大,越容易沉淀
16.1.2 盐析的影响因素 蛋白质的种类 蛋白质的种类不同,Ks值会有所不同; 分子量越大,沉淀所需盐的量越少; 蛋白质分子不对称性越大,越容易沉淀

蛋白质的初始浓度 不同浓度的蛋白质溶液产生沉淀所要求的临 界盐浓度不同。 蛋白质浓度大时,中性盐的极限沉淀浓度低, 共沉作用强,分辨率低,但用盐量减少、蛋 白质的溶解损失小。 相反,蛋白质浓度低时,中性盐的极限沉淀 浓度高,共沉作用小,分辨率高,但用盐量 增大、蛋白质的回收率低
蛋白质的初始浓度 不同浓度的蛋白质溶液产生沉淀所要求的临 界盐浓度不同。 蛋白质浓度大时,中性盐的极限沉淀浓度低, 共沉作用强,分辨率低,但用盐量减少、蛋 白质的溶解损失小。 相反,蛋白质浓度低时,中性盐的极限沉淀 浓度高,共沉作用小,分辨率高,但用盐量 增大、蛋白质的回收率低