
第11章 电化学基础
第11章 电化学基础

11.1氧化还原反应 1.1.1氧化值和氧化态 氧化值 有电子得失或电子转移的反应,被称为氧 化还原反应。 Cu(aq)+Zn(s)-Zn (aq)+Cu( 得失电子 H2(g)+Cl,(g)=2HCI (g 电子偏移 氧化值:是指某元素的一个原子的荷电数,该荷电数是 假定把每一化学键中的电子指定给电负性更大的原子而求 得的
11.1.1氧化值和氧化态 氧化值:是指某元素的一个原子的荷电数,该荷电数是 假定把每一化学键中的电子指定给电负性更大的原子而求 得的。 有电子得失或电子转移的反应,被称为氧 化还原反应。 Cu (aq) Zn(s) Zn (aq) Cu(s) 2 2 + + 得失电子 + + H2 (g)+Cl2(g) 2HCl(g) 电子偏移 氧化值 11.1氧化还原反应

确定氧化值的规则: ①单质中,元素的氧化值为零。 ②在单原子离子中,元素的氧化值等于该离子所带的 电荷数。 ③在大多数化合物中,氢的氧化值为+1:只有在金 属氢化物中氢的氧化值为-1。 ④通常,氧在化合物中的氧化值为-2;但是在过氧化 物中,氧的氧化值为-1,在氟的氧化物中,如OF2和OF2 中,氧的氧化值分别为+2和+1
确定氧化值的规则: ①单质中,元素的氧化值为零。 ②在单原子离子中,元素的氧化值等于该离子所带的 电荷数 。 ③在大多数化合物中,氢的氧化值为 +1;只有在金 属氢化物中氢的氧化值为 -1。 ④通常,氧在化合物中的氧化值为-2;但是在过氧化 物中,氧的氧化值为-1,在氟的氧化物中,如OF2 和O2F2 中,氧的氧化值分别为+2和+1

11.1.2氧化还原半反应式 11.1.3氧化还原方程式的配平 配平原则: ①电荷守恒:氧化剂得电子数等于还原剂 失电子数。 ②质量守恒:反应前后各元素原子总数相 等
配平原则: ① 电荷守恒:氧化剂得电子数等于还原剂 失电子数。 ② 质量守恒:反应前后各元素原子总数相 等。 11.1.3氧化还原方程式的配平 11.1.2氧化还原半反应式
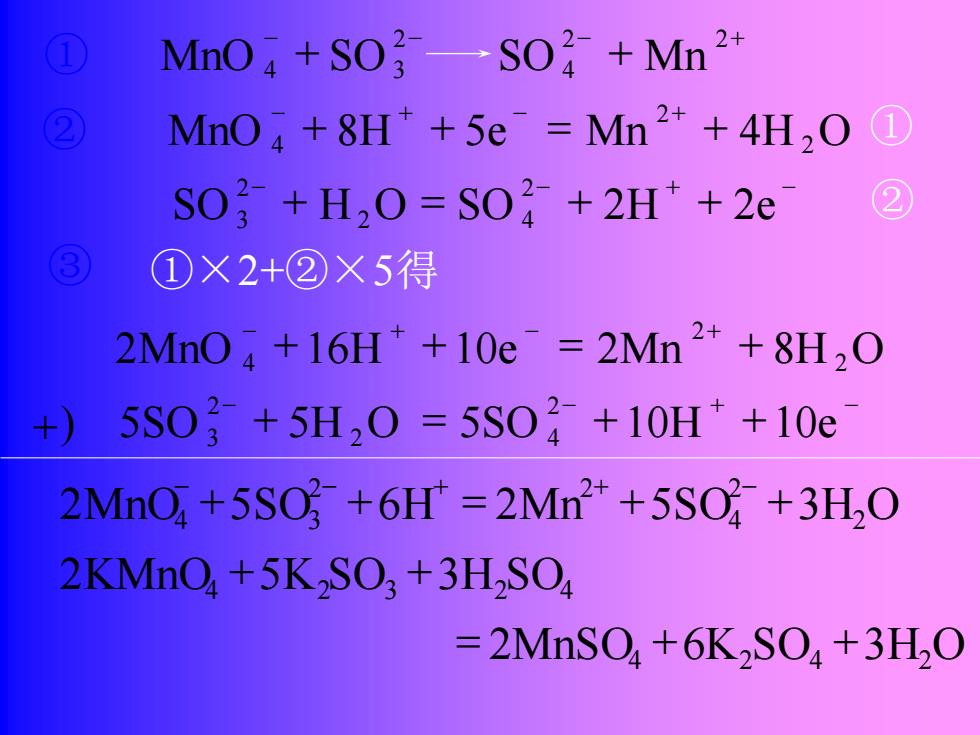
MnO+SO?SO2 +Mn 2* MnO+8H*+5e Mn2*+4H,O 1 S0+H20=S04+2H+2e 2 ①×2+②×5得 2Mn04+16H+10e=2Mn2++8H20 5S02+5H,0=5S02+10H++10e 2MnO+5S0+6H*=2Mn2*+5S0 +3H2O 2KMnO+5K,SO;+3H2SO =2MnSO+6K,SO+3H,O
+) 2 4 - - + - 5SO + 5H O = 5SO + 10H +10e 2 2 3 - + - + 2MnO + 16H + 10e = 2Mn + 8H 2O 2 4 - + - + ② MnO + 8H + 5e = Mn + 4H 2O 2 4 ① - - + - SO + H O = SO + 2H + 2e 2 2 4 2 3 ② ③ ①×2+②×5得 = 2MnSO4 +6K2SO4 +3H2O 2MnO 5SO 6H 2Mn 5SO 3H2O 2 4 2 2 4 3 + + = + + - - + + - - - - + ① MnO + SO SO + Mn 2 2 4 2 4 3 2KMnO4 5K SO3 3H SO2 4 + + 2

配平步骤: ①用离子式写出主要反应物和产物(气体、纯液体、固体和弱电解 质则写分子式)。 ②分别写出氧化剂被还原和还原剂被氧化的半反应。 ③分别配平两个半反应方程式,等号两边的各种元素的原子总数各 自相等且电荷数相等。 ④确定两半反应方程式得、失电子数目的最小公倍数。将两个半反 应方程式中各项分别乘以相应的系数,使得、失电子数日相同。然后, 将两者合并,就得到了配平的氧化还原反应的离子方程式。有时根据 需要可将其改为分子方程式。 配平反应方程式 KMnO (aq)+K,SO,(aq) 性m夜当MhS0,(aq)+K,S0, aq)
例1:配平反应方程式 MnSO (aq) K SO (aq) KMnO (aq) K SO (aq) 4 2 4 酸性溶液中 4 2 3 ⎯⎯ ⎯→ + + ④确定两半反应方程式得、失电子数目的最小公倍数。将两个半反 应方程式中各项分别乘以相应的系数,使得、失电子数目相同。然后, 将两者合并,就得到了配平的氧化还原反应的离子方程式。有时根据 需要可将其改为分子方程式。 配平步骤: ①用离子式写出主要反应物和产物(气体、纯液体、固体和弱电解 质则写分子式)。 ②分别写出氧化剂被还原和还原剂被氧化的半反应。 ③分别配平两个半反应方程式,等号两边的各种元素的原子总数各 自相等且电荷数相等
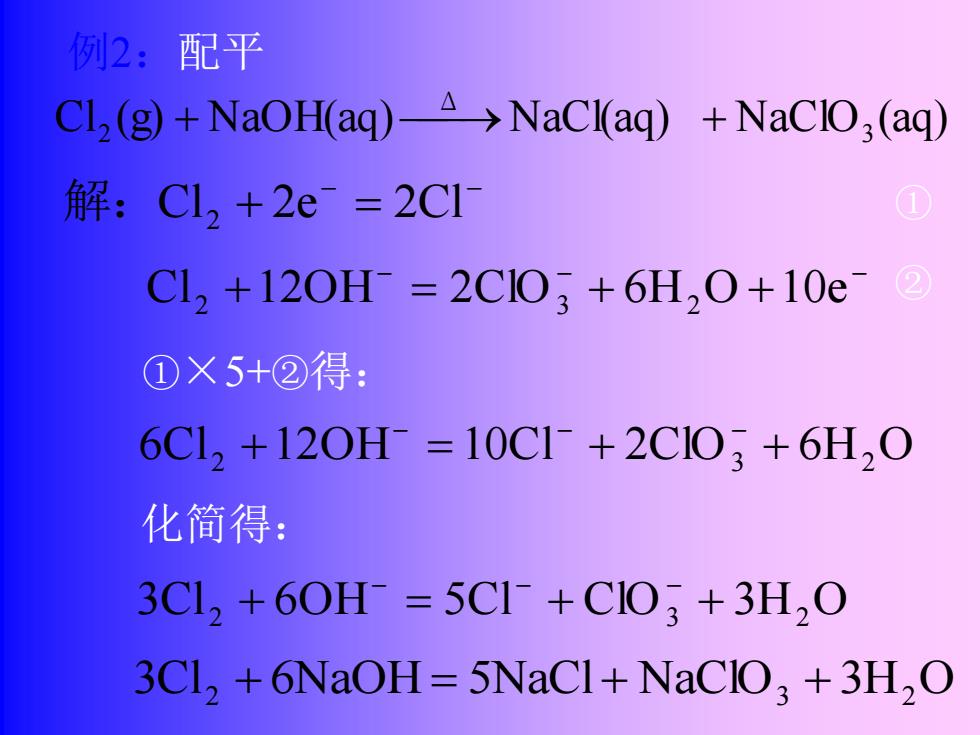
例2:配平 Cl (g)+NaOH(aq)-A>NaCl(aq)+NaCIO3 (aq) 解:CL2+2e=2C1 ① Cl2+120H=2C103+6H,0+10e ② ①×5+②得: 6C12+120H=10C1+2C103+6H,0 化简得: 3C12+60H=5C1+C10;+3H20 3C1,+6NaOH=5NaCl+NaClO3+3H2O
例 2 :配平 Cl (g) NaOH(aq) NaCl(aq) NaClO (aq) 3 Δ 2 + ⎯→ + ① ×5+ ②得: ①② 3Cl 2 + 6NaOH = 5NaCl + NaClO 3 + 3H 2 O 3Cl 2 + 6OH = 5Cl + ClO 3 + 3H 2 O - - - 6Cl 2 +12OH = 10Cl + 2ClO 3 + 6H 2 O - - - - - - Cl +12OH = 2ClO + 6H O +10e 2 3 2 - - Cl + 2e = 2Cl 解: 2 化简得:

例3:配平方程式 As,S;(s)+HNO;(aq)->H;AsO(aq)+H2SOa(aq)+NO(g) 解:As,S3+NO→HAsO4+SO?+NO NO:+4H*+3e=NO+2H,O As,S,+6H*+20H,O =2H3As04+3S02+40H+28e 即As,S,+20H,0=2H3As04+3S0}+34H+28e ①×28+②×3得 28N0+3As2S3+4H20+10H =6H3As04+9S04+28NO 3As2S3+28HN03+4H,O =6H3As04+9H2S04+28NO
As S (s) HNO (aq) H AsO (aq) H SO (aq) NO(g) 2 3 + 3 → 3 4 + 2 4 + ①×28+②×3得 ② ① 例3:配平方程式 6H AsO 9H SO 28NO 3As S 28HNO 4H O 3 4 2 4 2 3 3 2 = + + + + 6H AsO 9SO 28NO 28NO 3As S 4H O 10H 2 3 4 4 3 2 3 2 = + + + + + - - + - + - 即 As S + 20H O = 2H AsO + 3SO + 34H + 28e 2 2 3 2 3 4 4 - + - + = + + + + + 2H AsO 3SO 40H 28e As S 6H 20H O 2 3 4 4 2 3 2 NO3 + 4H + 3e = NO + 2H2 O - + - 解 As S N O H AsO SO N O 2 2 3 + 3 → 3 4 + 4 + : - -

11.2原电池 11.2.1珈伐尼电池伏打电堆丹尼尔电池 伏打电 列氧 盐C桥 X 绿 Cu2*SO
11.2原电池 11.2.1珈伐尼电池·伏打电堆·丹尼尔电池 伏打电池 在CuSO4溶液中放入一片Zn,将发生下列氧 化还原反应: Zn(s) + Cu2+(aq) Zn2+(aq) + Cu(s) 在溶液中电子直接从Zn片传递给Cu2+,使 Cu2+在Zn片上还原而析出金属Cu,同时Zn氧 化为Zn2+ 。这个反应同时有热量放出,这是化 学能转化为电能的结果

11.2.2半电池原电池符号·电极的分类 电池符号 (-)M,M1(c)lMK(e)M2(+) ”表示界面,“”表示盐桥 Cu-Zn原电池可表示为 (-)Zn Zn2+(1mol.L-)Cu2+(1mol.L-)Cu (+ 或者 ()Zn|Zn SO,(1mol.L-)Cuso (1molL-)Cu( 气体要注明分压,如 (-)Zn|Zn2+(1mol.L-)H(1mol.L-)|H,(101kPa)P)(+)
11.2.2半电池·原电池符号·电极的分类 (–) M1│M1 n+(c1 ) M2 K+(c2 )│M2 (+) “ │”表示界面, “ ” 表示盐桥. Cu-Zn原电池可表示为: (–) Zn│Zn2+(1mol.L–1 ) Cu2+(1mol.L–1 )│Cu (+) 或者 (–) Zn│Zn SO4 (1mol.L–1 ) CuSO 4 (1mol.L–1 )│Cu (+) 气体要注明分压, 如 (–) Zn│Zn2+(1mol.L–1 ) H+ (1mol.L–1 )│H2 (101kPa)(Pt) (+) 电池符号