
第二章化学反应速率与化学平衡 教学目标:通过学习使学生不但要掌握化学反应进行的快慢,而且还要掌握 化学反应进行的完全程度,以便能更好的为工农业生产服务。 知识技能:理解勒沙特列原理的含义,掌握浓度、温度、压强等条件对化学 平衡移动的影响:掌握化学反应速率改变与化学平衡移动的关系。 能力培养:通过对化学反应速率与化学平衡知识的运用,培养学生将化学信 息,按题设情境抽象归纳,逻辑地统摄成规律,并能运用此规律,进行推理的创 造能力。 重点、难点化学反应速率与化学平衡知识间的联系:化学知识及相关能力 在实际中的运用。 2.1化学反应速率 一、化学反应速率的表示方法 化学反应速率是指在一定条件下,化学反应中反应物转变为生成物的速率 往往用单位时间内反应物或生成物浓度变化的正值(绝对值)表示,单位:ol.L-1. 时间。时间可以为s、min或其他时间单位。 反应速率=浓度变化 变化所需时间 通过上式计算得出的实际上是平均速率,当时间间隔趋于0时,平均速率即 转化为瞬时速率。如图 产物(P d[R] 反应物(R) 时间1 反应物和产物的浓度随时间的变化
1 第二章 化学反应速率与化学平衡 教学目标:通过学习使学生不但要掌握化学反应进行的快慢,而且还要掌握 化学反应进行的完全程度,以便能更好的为工农业生产服务。 知识技能:理解勒沙特列原理的含义,掌握浓度、温度、压强等条件对化学 平衡移动的影响;掌握化学反应速率改变与化学平衡移动的关系。 能力培养:通过对化学反应速率与化学平衡知识的运用,培养学生将化学信 息,按题设情境抽象归纳,逻辑地统摄成规律,并能运用此规律,进行推理的创 造能力。 重点、难点 化学反应速率与化学平衡知识间的联系;化学知识及相关能力 在实际中的运用。 2.1 化学反应速率 一、化学反应速率的表示方法 化学反应速率是指在一定条件下,化学反应中反应物转变为生成物的速率, 往往用单位时间内反应物或生成物浓度变化的正值(绝对值)表示,单位:mol.L-1. 时间。时间可以为 s、min 或其他时间单位。 反应速率 = 变化所需时间 浓度变化 即 通过上式计算得出的实际上是平均速率,当时间间隔趋于 0 时,平均速率即 转化为瞬时速率。如图

在浓度随时间变化的图上,某时刻的速率即该时刻切线的斜率。以后提到的 速率均指瞬时速率。显然,反应刚开始,速率大,然后不断减小,体现了反应速 率变化的实际情况。 2.2化学反应速率理论简介 1、化学反应历程(机理) 一个化学反应,在一定条件下,反应物变成生成物实际经过的途径。 基元反应:在反应中反应物分子直接转化成生成物的反应一简单反应 复杂反应:在反应中反应物分子经过多步才转化成生成物的反应—一非基元 反应。 基元反应 CO(g)+NOz(g)=COz(g)+NO(g) 非基元反应 H2(g)+I2(g)=2HI(g 12(g)=2I(g) 快 H2(g)+2I(g)=2HI(g)慢 2、化学反应速率理论 (1)有效碰撞理论 化学反应发生的必要条件是反应物分子(或原子、离子)间的碰撞。 只有极少数活化分子的碰撞才能发生化学反应,称“有效碰撞”:活化分子 是反应物分子中能量较高的分子,其比例很小 理论要点: ※有效碰撞:能发生反应的碰撞: ※活化分子:具有较大的动能并且能发生有效碰撞的分子: ※活化能:活化分子所具有的最低能量与反应物分子的平均能量之差: ※其他条件相同时,活化能越低的化学反应,反应速率越高。 活化能()是化学反应的“能垒”,越高,反应越慢:越低,反应越 快。可以通过实验测定。 般化学反应的活化能约在40~400灯.mo1之间:
2 在浓度随时间变化的图上,某时刻的速率即该时刻切线的斜率。以后提到的 速率均指瞬时速率。显然,反应刚开始,速率大,然后不断减小,体现了反应速 率变化的实际情况。 2.2 化学反应速率理论简介 1、化学反应历程(机理) 一个化学反应,在一定条件下,反应物变成生成物实际经过的途径。 基元反应:在反应中反应物分子直接转化成生成物的反应—简单反应。 复杂反应:在反应中反应物分子经过多步才转化成生成物的反应-非基元 反应。 基元反应 CO(g) + NO2(g) = CO2(g) + NO(g) 非基元反应 H2(g) + I2(g) = 2HI(g I2(g) =2 I(g) 快 H2(g) + 2I(g) = 2HI(g) 慢 2、化学反应速率理论 (1)有效碰撞理论 化学反应发生的必要条件是反应物分子(或原子、离子)间的碰撞。 只有极少数活化分子的碰撞才能发生化学反应,称“有效碰撞”;活化分子 是反应物分子中能量较高的分子,其比例很小; 理论要点: ※有效碰撞:能发生反应的碰撞; ※ 活化分子:具有较大的动能并且能发生有效碰撞的分子; ※ 活化能:活化分子所具有的最低能量与反应物分子的平均能量之差; ※ 其他条件相同时,活化能越低的化学反应,反应速率越高。 活化能(Ea)是化学反应的“能垒”,Ea越高,反应越慢;Ea越低,反应越 快。Ea可以通过实验测定。 一般化学反应的活化能约在40~400 kj.mol-1之间;

多数化学反应的活化能约在60~250K灯.mol1之间: 反应的活化能小于40k.mo1时,反应速度很快: 反应的活化能大于400kj.mo时,反应速度很慢: 中和化学反应的活化能约在13~25k灯.mo1之间。 (2)过渡状态理论 化学反应并不是通过反应物分子的简单碰撞完成的,在反应物到产物的转 变过程中,先形成一种过渡状态,即反应物分子活化形成配合物的中间状态 如A+BC- →「AB.CJ →ABC 2.3影响化学反应速率的主要因素 内因:反应的活化能 外因:浓度、温度、催化剂 、浓度或分压对反应速率的影响 1,基元反应:对于简单反应,反应物分子在有效碰撞中经过一次化学变化就能 转化为产物的反应。 2.基元反应的化学反应速率方程式:可由质量作用定律描述。 在一定温度下,对某一基元反应,反应速率与各反应物浓度(以化学方程 式中该物质的计量数为指数)的乘积成正比 如:aA+bB=gG+dD为基元反应, 则:v=kC(A)C(B) 称作质量作用定律数学表达式。 而对于非基元反应,有: v=kc"(A).c"(B) 称作反应速率方程式。其中m、n要通过实验来确定。 (a+b)或(mtn)称为反应级数 例1S.0,+3T=2S0+1非基元反应 v=k(S,0,r) 该反应为2级反应。 k称为反应速率常数,可用来表征反应的速率
3 多数化学反应的活化能约在60~250 kj.mol-1之间; 反应的活化能小于 40 kj.mol-1时,反应速度很快; 反应的活化能大于 400 kj.mol-1时,反应速度很慢; 中和化学反应的活化能约在13~25 kj.mol-1之间。 (2)过渡状态理论 化学反应并不是通过反应物分子的简单 碰撞完成的,在反应物到产物的转 变过程中,先形成一种过渡状态,即反应物分子活化形成配合物的中间状态。 如 A + BC 「A.B.C」 ABC 2.3 影响化学反应速率的主要因素 内因:反应的活化能 外因:浓度、温度、催化剂 一、浓度或分压对反应速率的影响 1.基元反应: 对于简单反应,反应物分子在有效碰撞中经过一次化学变化就能 转化为产物的反应。 2.基元反应的化学反应速率方程式:可由质量作用定律描述。 在一定温度下,对某一基元反应, 反应速率与各反应物浓度(以化学方程 式中该物质的计量数为指数)的乘积成正比 如:aA + bB = gG + dD 为基元反应, 则: v kc (A) c (B) a b = 称作质量作用定律数学表达式。 而对于非基元反应,有: v kc (A) c (B) m n = 称作反应速率方程式。其中m、n要通过实验来确定。 (a+b)或(m+n)称为反应级数。 例1 S2O8 2- + 3I- = 2SO4 2- + I3 - 非基元反应 该反应为2级反应。 k 称为反应速率常数, 可用来表征反应的速率。 ( )( ) 2 2 8 − − v = k S O I

k与温度、催化剂有关,而与浓度无关。对于n级反应其单位是(mol'dm-s 反应级数的意义: ①表示了反应速率与物质的量浓度的关系; ②零级反应表示了反应速率与反应物浓度无关 速率常数的单位 零级反应:v=k(c)° k的量纲为mol·dn·s 级反应:U=kC: k的量纲为s1 二级反应:D=k(c) k的量纲为mol3·dn·s 气体反应可用气体分压表示 2N0.→2N0+0: v=kcNo2,2:或v=kP0oa:hc≠& 二、温度对反应速率的影响 范特霍夫规则 般情况下:在一定温度范围内,对化学反应温度每升高10度反应速率大约 增加到原来的24倍。 温度升高使反应速率显著提高的原因是:升温是反应物分子的能量增加,大 量的非活化分子获得能量后变成活化分子,单位体积内活化分子的百分数大大增 加,由小碰撞次数增多,从而反应速率明显增大。 三、催化剂对反应速率的影响 催化剂能改变反应速率的作用叫催化作用。 正催化:加速反应速率负催化:减慢反应速率 1.催化剂影响反应速率的原因 催化作用的实质是改变了反应的机理,降低了反应的活化能,因而提高了反 应速率。不改变反应前后物质的组成和质量,也不改变平衡常数K:缩短平衡到 达的时间,加快平衡的到来。 2.特点
4 k与温度、催化剂有关,而与浓度无关。对于n级反应其单位是(moldm-3 ) (n-1)s -1 反应级数的意义: ① 表示了反应速率与物质的量浓度的关系; ②零级反应表示了反应速率与反应物浓度无关 速率常数的单位 零级反应: = k(cA) 0 k的量纲为mol·dm-3·s -1 一级反应: = kcA; k的量纲为s -1 二级反应: = k(cA) 2 k的量纲为mol3·dm-1·s -1 气体反应可用气体分压表示 2NO2 ⎯⎯⎯⎯→ 2NO + O2; v = kc c(NO2 ) 2 ;或 v = kpp(NO2 ) 2 ; kc kP 二、温度对反应速率的影响 范特霍夫规则 一般情况下:在一定温度范围内,对化学反应温度每升高10度反应速率大约 增加到原来的2~4倍。 温度升高使反应速率显著提高的原因是:升温是反应物分子的能量增加,大 量的非活化分子获得能量后变成活化分子,单位体积内活化分子的百分数大大增 加,由小碰撞次数增多,从而反应速率明显增大。 三、催化剂对反应速率的影响 催化剂能改变反应速率的作用叫催化作用。 正催化:加速反应速率 负催化:减慢反应速率 1.催化剂影响反应速率的原因 催化作用的实质是改变了反应的机理,降低了反应的活化能,因而提高了反 应速率。不改变反应前后物质的组成和质量,也不改变平衡常数K;缩短平衡到 达的时间,加快平衡的到来。 2.特点:
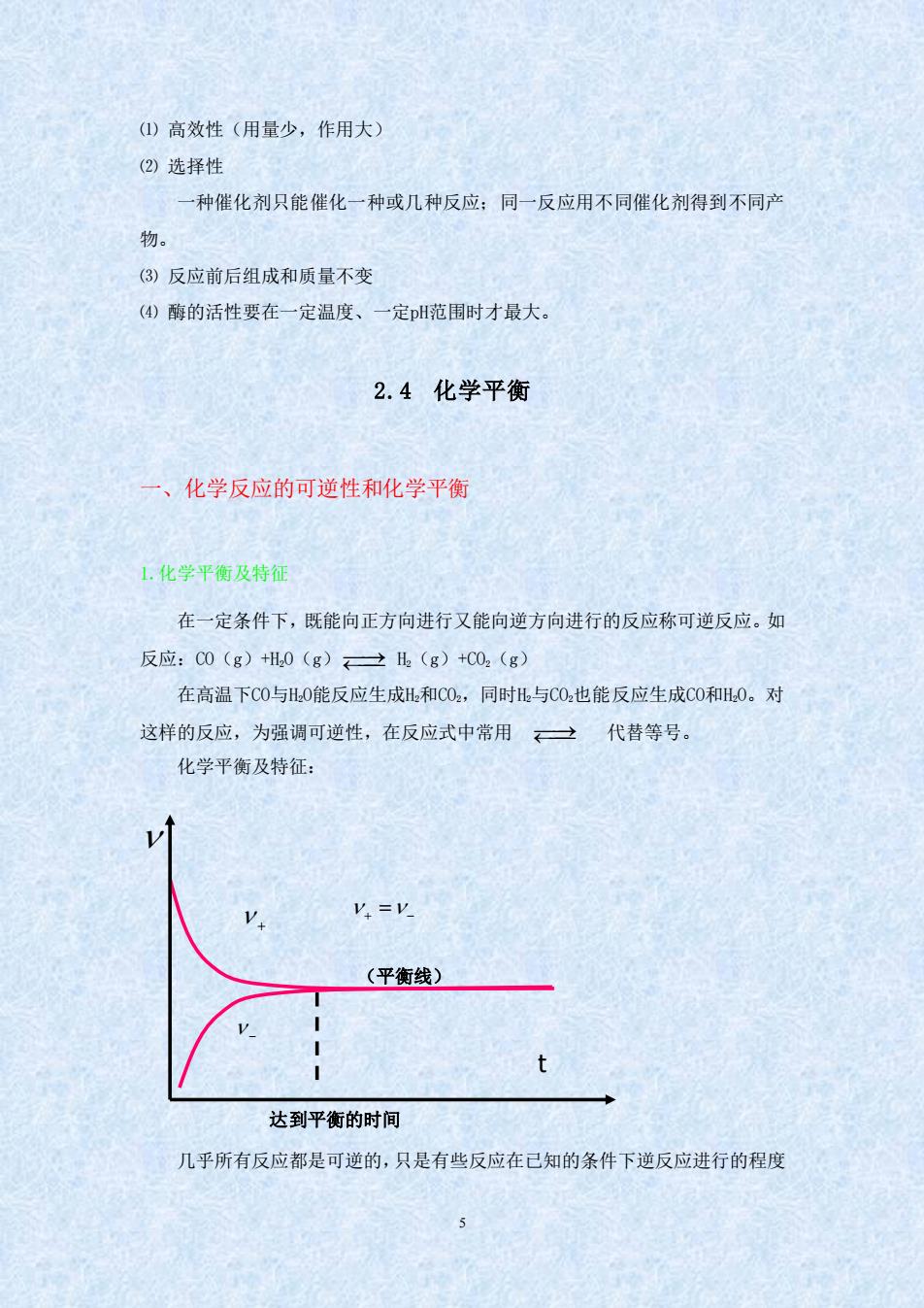
(①)高效性(用量少,作用大) (②)选择性 一种催化剂只能催化一种或几种反应:同一反应用不同催化剂得到不同产 物。 (3)反应前后组成和质量不变 (④)酶的活性要在一定温度、一定H范围时才最大, 2.4化学平衡 ·、化学反应的可逆性和化学平衡 1。化学平衡及特征 在一定条件下,既能向正方向进行又能向逆方向进行的反应称可逆反应。如 反应:00(g)H.0(g)→l(g)+C0,(g 在高温下C0与H0能反应生成H和C0.,同时H与C0也能反应生成C0和H0。对 这样的反应,为强调可逆性,在反应式中常用一代替等号。 化学平衡及特征: V.=V (平衡线) 达到平衡的时间 几乎所有反应都是可逆的,只是有些反应在已知的条件下逆反应进行的程度
5 ⑴ 高效性(用量少,作用大) ⑵ 选择性 一种催化剂只能催化一种或几种反应;同一反应用不同催化剂得到不同产 物。 ⑶ 反应前后组成和质量不变 ⑷ 酶的活性要在一定温度、一定pH范围时才最大。 2.4 化学平衡 一、化学反应的可逆性和化学平衡 1.化学平衡及特征 在一定条件下,既能向正方向进行又能向逆方向进行的反应称可逆反应。如 反应:CO(g)+H2O(g) ⎯⎯⎯⎯→ H2(g)+CO2(g) 在高温下CO与H2O能反应生成H2和CO2,同时H2与CO2也能反应生成CO和H2O。对 这样的反应,为强调可逆性,在反应式中常用 ⎯⎯⎯⎯→ 代替等号。 化学平衡及特征: 几乎所有反应都是可逆的,只是有些反应在已知的条件下逆反应进行的程度 − 达到平衡的时间 + + − = (平衡线) t

极为微小,以致可以忽略,这样的反应通常称之为不可逆。如KC10,加热分解便 是不可逆反应的例子。 可逆反应在进行到一定程度,便会建立起平衡。例如,一定温度下,将一定 量的C0和H0加入到一个密闭容器中。反应开始时,C0和H0的浓度较大,正 反应速率较大。一日有C0和k生成,就产生逆反应。开始时逆反应速率较小, 随者反应进行,反应物的浓度减少,生成物的浓度逐渐增大。正反应速率逐渐减 少,逆反应速率逐渐增大。当正、逆反应速率相等时,即达到平衡状态。正、逆 反应速率相等时的状态叫做化学平衡。 化学平衡有两个特征: (1)化学平衡是一种动态平衡。表面上看来反应似乎已停止,实际上正逆 反应仍在进行,只是单位时间内,反应物因正反应消耗的分子数恰等于由逆反应 生成的分子数。 (2)化学平衡是暂时的、有条件的平衡。当外界条件改变时,原有的平衡 即被破坏,直到在新的条件下建立新的平衡。 2.化学平衡常数 (1)实验平衡常数 在一定温度下液相达平衡时,都能建立如下的关系式 aA bB dD eE K. K。为浓度平衡常数。 对气体反应,还可用气体的分压代替浓度。平衡常数表达式可写成 K,=P(DYR(E P(4)'P(B) K。、统称为实验平衡常数
6 极为微小,以致可以忽略,这样的反应通常称之为不可逆。如 KClO3加热分解便 是不可逆反应的例子。 可逆反应在进行到一定程度,便会建立起平衡。例如,一定温度下,将一定 量的 CO 和 H2O 加入到一个密闭容器中。反应开始时,CO 和 H2O 的浓度较大,正 反应速率较大。一旦有 CO2和 H2生成,就产生逆反应。开始时逆反应速率较小, 随着反应进行,反应物的浓度减少,生成物的浓度逐渐增大。正反应速率逐渐减 少,逆反应速率逐渐增大。当正、逆反应速率相等时,即达到平衡状态。正、逆 反应速率相等时的状态叫做化学平衡。 化学平衡有两个特征: (1)化学平衡是一种动态平衡。表面上看来反应似乎已停止,实际上正逆 反应仍在进行,只是单位时间内,反应物因正反应消耗的分子数恰等于由逆反应 生成的分子数。 (2)化学平衡是暂时的、有条件的平衡。当外界条件改变时,原有的平衡 即被破坏,直到在新的条件下建立新的平衡。 2. 化学平衡常数 (1)实验平衡常数 在一定温度下液相达平衡时,都能建立如下的关系式 aA + bB dD + eE d e c a b ( ) ( ) K ( ) ( ) c D c E c A c B = K c为浓度平衡常数。 对气体反应,还可用气体的分压代替浓度。平衡常数表达式可写成 K p, d e p a b p( ) p( ) K p( ) p( ) D E A B = K c 、K p 统称为实验平衡常数

(2)标准平衡常数(热力学平衡常数 ·标准平衡常数表达式 对溶液中的反应:aA(S)+bB一eE+D KcDeEe (固体A不参与此式的书写) c(Bc 对气相反应要用分压表示 (3)书写和应用平衡常数的几点说明: ①平衡常数表达式需与计量方程式相对应,同一化学反应用不同计量方程式 表示时,平衡常数表达式不同,得到的数值也不同。 例N(g)+3H(g)=2NH(g) K=1.60×10- 1/2N(g)+3/2H(g)=NH(g) 元=3.87×10 K≠龙,= ②纯固体与纯液态及水溶液中参加反应的水的浓度在平衡常数表达式中不 出现:k 例:Ca0(s=ca0(s)+c0,7k-pC0) ③写入平衡常数表达式中各物质的浓度或分压,必须是在系统达到平衡状 态时相应的值。气体只可用分压表示。 ④温度发生改变,化学反应的平衡常数也随之改变,因此,在使用时须注 意相应的温度。 ●平衡常数的意义 ①平衡常数是可逆反应的特征常数。对同类反应来说k°越大,反应进行得 越完全。 ②由平衡常数可以判断反应是否处于平衡态和非平衡态时反应进行的方向。 >
7 (2)标准平衡常数(热力学平衡常数) ⚫ 标准平衡常数表达式 对溶液中的反应:aA(S)+bB eE+ dD d e c b c( ) / c c(E) / c c(B)/c K D = (固体 A 不参与此式的书写) 对气相反应要用分压表示 (3)书写和应用平衡常数的几点说明: ①平衡常数表达式需与计量方程式相对应,同一化学反应用不同计量方程式 表示时,平衡常数表达式不同,得到的数值也不同。 例 N2 (g) + 3 H2 (g) 2NH3 (g) K 1 = 1.60 10 −5 1/2N2 (g) + 3/2 H2 (g) NH3 (g) K2 = 3.87 10 −2 K1 K2 , K1 = K2 2 ②纯固体与纯液态及水溶液中参加反应的水的浓度在平衡常数表达式中不 出现; k 例: Ca2CO3 (s) CaO(s) + CO2 ③ 写入平衡常数表达式中各物质的浓度或分压,必须是在系统达到平衡状 态时相应的值。气体只可用分压表示。 ④ 温度发生改变,化学反应的平衡常数也随之改变,因此,在使用时须注 意相应的温度。 ●平衡常数的意义 ①平衡常数是可逆反应的特征常数。对同类反应来说 k 越大,反应进行得 越完全。 ②由平衡常数可以判断反应是否处于平衡态和非平衡态时反应进行的方向。 2 p CO ( ) K p =

●多种平衡的平衡常数 多重平衡的规则:在相同条件下,如有连个反应方程式相加或相减得到第 个反应方程式,则第三个反应方程式的平衡常数为前两个反应方程式平衡常数之 积或之商。 即K=KXK或K=K/K 3,平衡常数与平衡转化率 转化率: a=某反应物己转化的量/某反应物的重量×100% 若反应前后体积不变,反应的量可以用浓度表示 a=(某反应物的起始浓度-某反应物的平衡浓度)/某反应物的起始浓度× 100% 2.5化学平衡的移动 一、浓度对化学平衡的影响 在其它条件不变的情况下,增加反应物的浓度或减少生成物的浓度,化学平 衡向着正反应方向移动:增加生成物的浓度或减少反应物的浓度,化学平衡向着 逆反应的方向移动 在可逆反应中,为了尽可能利用某一反应物,经常用过量的另一种物质和它 作用。 不断将生成物从反应体系中分离出来,则平衡将不断向生成产物的方向移 动。 二、压力对化学平衡的影响 等温下,增大总压强,平衡向气体分子数减少的方向移动:减压; 则平衡向气体分子数增加的方向移动。如: 673K时反应:N(g)+3H(g)△2NH(g 如果气态反应物的总分子数和气态生成物总分子数相等,在等温 下,增加或降低总压强,对平衡没有影响。如:
8 ●多种平衡的平衡常数 多重平衡的规则:在相同条件下,如有连个反应方程式相加或相减得到第三 个反应方程式,则第三个反应方程式的平衡常数为前两个反应方程式平衡常数之 积或之商。 即 K3 = K1 × K2 或 K3 = K1/K2 3 .平衡常数与平衡转化率 转化率 : a = 某反应物已转化的量/某反应物的重量×100% 若反应前后体积不变,反应的量可以用浓度表示 a =(某反应物的起始浓度 - 某反应物的平衡浓度)/某反应物的起始浓度× 100% 2.5 化学平衡的移动 一、浓度对化学平衡的影响 在其它条件不变的情况下,增加反应物的浓度或减少生成物的浓度,化学平 衡向着正反应方向移动;增加生成物的浓度或减少反应物的浓度,化学平衡向着 逆反应的方向移动。 在可逆反应中,为了尽可能利用某一反应物,经常用过量的另一种物质和它 作用。 不断将生成物从反应体系中分离出来,则平衡将不断向生成产物的方向移 动。 二、压力对化学平衡的影响 等温下,增大总压强,平衡向气体分子数减少的方向移动;减压, 则平衡向气体分子数增加的方向移动。如: 673K 时反应:N2(g)+3H2(g)2NH3(g) 如果气态反应物的总分子数和气态生成物总分子数相等,在等温 下,增加或降低总压强,对平衡没有影响。如:

773K时反应C0+H,0=+C0: 三、温度对化学平衡的影响 升高温度,使平衡向吸热方向移动:降低温度,使平衡向放热方向移动。 体系放热时4,H0为负值,吸热时为正值。 四、催化剂与化学平衡 催化剂不会使平衡发生移动,但使用催化剂能降低反应的活化能,加快反应 速率,缩短达到平衡的时间。 五、平衡移动原理一一吕·查德里原理 2.6反应速率与化学平衡的综合利用 1、是一种价廉易得的反应物过量,以提高里一种原料的转化率 2、升高温度能增大反应速率,对于吸热反应还能增加转化率。 3、对于气体反应,增加压力会使反应速率加快,对分子数减少的反应还能提高 转化率。 4、选用催化剂时,须考虑催化剂的催化性、活化温度、价格等,对容易中毒的 催化剂须注意原料的纯化
9 773K 时反应 CO+H2O H2+CO2 三、温度对化学平衡的影响 升高温度,使平衡向吸热方向移动;降低温度,使平衡向放热方向移动。 体系放热时 r H 为负值,吸热时为正值。 四、催化剂与化学平衡 催化剂不会使平衡发生移动,但使用催化剂能降低反应的活化能,加快反应 速率,缩短达到平衡的时间。 五、平衡移动原理——吕·查德里原理 2.6 反应速率与化学平衡的综合利用 1、是一种价廉易得的反应物过量,以提高里一种原料的转化率。 2、升高温度能增大反应速率,对于吸热反应还能增加转化率。 3、对于气体反应,增加压力会使反应速率加快,对分子数减少的反应还能提高 转化率。 4、选用催化剂时,须考虑催化剂的催化性、活化温度、价格等,对容易中毒的 催化剂须注意原料的纯化