
抗生素与耐药菌 摘要 过去的几十年里,许多疾病好像结核和肺炎,由于抗生素的有效应用,几乎己经销声 匿迹或已对人类健康不构成重大威胁。随着感染性疾病的爆发和耐药菌株的增长,又一次 向全人类的健康布下了苍白的阴影。事实上,我们正在步入所谓的“后抗生素时代”一一 在抗生素被发现之前,人们经历了无法控制感染类疾病的黑暗时代,而今天,己经有数种 细菌对几乎所有抗生素耐药。中国是世界上滥用抗生素最为严重的国家之一,由此造成的 细菌耐药性问题尤为突出。临床分离的一些细菌对某些药物的耐药性己居世界首位,尤其 值得注意的是,人们对其危害性的了解远远不足够。 本文介绍了常见抗生素的作用机制及耐药机制,以及有关最新进展,希望人们重视耐 药菌的危害,促进抗生素的合理使用。 关键词:抗生素,耐药菌,耐药机制 常用抗生素的作用机制 Cell wall syntheais DNA gyrase Nalidc acid orloxacin-(quinolones bact DNA-directed RNA polymerase Rifamoin 88 PABA Cytoplasmic membrane structure Polymyxins- Nitrofurans Puromycir THF,Tetrahydrofolate:DHE dihydrofolate:mRNA n 细菌结构及抗生素作用位点示意图
抗生素与耐药菌 摘要 过去的几十年里,许多疾病好像结核和肺炎,由于抗生素的有效应用,几乎已经销声 匿迹或已对人类健康不构成重大威胁。随着感染性疾病的爆发和耐药菌株的增长,又一次 向全人类的健康布下了苍白的阴影。事实上,我们正在步入所谓的“后抗生素时代”—— 在抗生素被发现之前,人们经历了无法控制感染类疾病的黑暗时代,而今天,已经有数种 细菌对几乎所有抗生素耐药。中国是世界上滥用抗生素最为严重的国家之一,由此造成的 细菌耐药性问题尤为突出。临床分离的一些细菌对某些药物的耐药性已居世界首位,尤其 值得注意的是,人们对其危害性的了解远远不足够。 本文介绍了常见抗生素的作用机制及耐药机制,以及有关最新进展,希望人们重视耐 药菌的危害,促进抗生素的合理使用。 关键词:抗生素,耐药菌,耐药机制 一 常用抗生素的作用机制 细菌结构及抗生素作用位点示意图
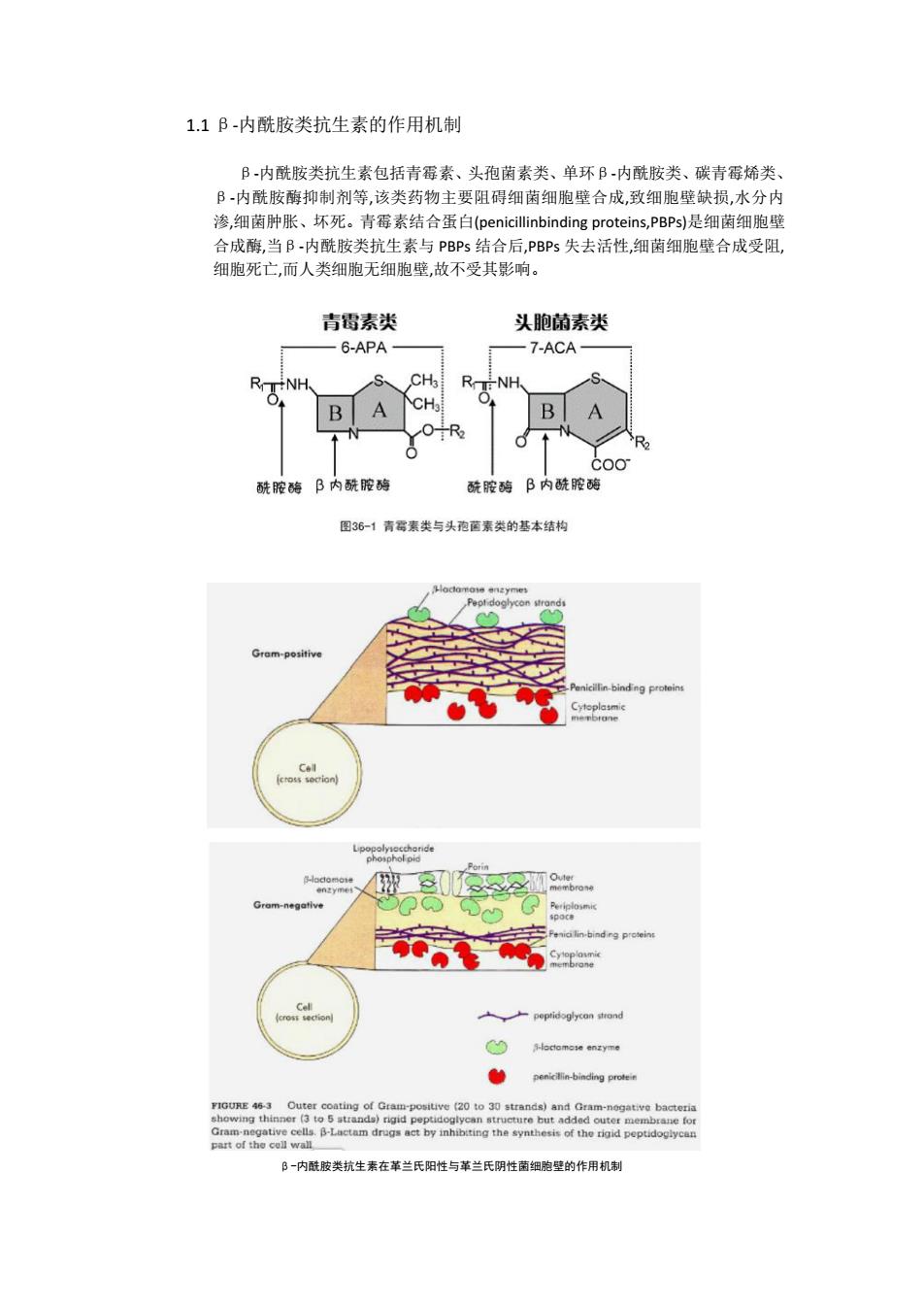
1.1β-内酰胺类抗生素的作用机制 B内酰胺类抗生素包括青霉素、头孢菌素类、单环B-内酰胺类、碳青霉烯类、 B-内酰胺酶抑制剂等,该类药物主要阻碍细菌细胞壁合成,致细胞壁缺损,水分内 渗,细菌肿胀、坏死。青霉素结合蛋白(penicillinbinding proteins,PBPs)是细菌细胞壁 合成酶,当B-内酰胺类抗生素与PBPs结合后,PBPs失去活性,细菌细胞壁合成受阻, 细胞死亡,而人类细胞无细胞壁,故不受其影响。 青霉素类 头胞菌素类 6-APA 7-ACA- CH3 RT:-NH. B A 酰胺酶β内酰胺酶 酰胺酶β内酰胺酶 图36-1青霉素类与头孢菌素类的基本结构 ocamose enzymes Gram-positive -Penicillin-binding proteins (cross socian) S-locomone Gram-negative eilin-binding proteint membrane o S-loctamese enzyme o penicillin-binding prote FIGURE 46-3 Outer coating of Gram-positive (20 to 30 strands)and Gram-negative bacteria showing thinner(3to5strands)rigid peptidoglycan structure but added outer membrane for Gram-negative cells.B-Lactam drugs act by inhibiting the synthesis of the rigid peptidoglycan part of the cell wall B一内酰胺类抗生素在革兰氏阳性与革兰氏阴性菌细胞壁的作用机制
1.1 β-内酰胺类抗生素的作用机制 β-内酰胺类抗生素包括青霉素、头孢菌素类、单环β-内酰胺类、碳青霉烯类、 β-内酰胺酶抑制剂等,该类药物主要阻碍细菌细胞壁合成,致细胞壁缺损,水分内 渗,细菌肿胀、坏死。青霉素结合蛋白(penicillinbinding proteins,PBPs)是细菌细胞壁 合成酶,当β-内酰胺类抗生素与 PBPs 结合后,PBPs 失去活性,细菌细胞壁合成受阻, 细胞死亡,而人类细胞无细胞壁,故不受其影响。 β-内酰胺类抗生素在革兰氏阳性与革兰氏阴性菌细胞壁的作用机制
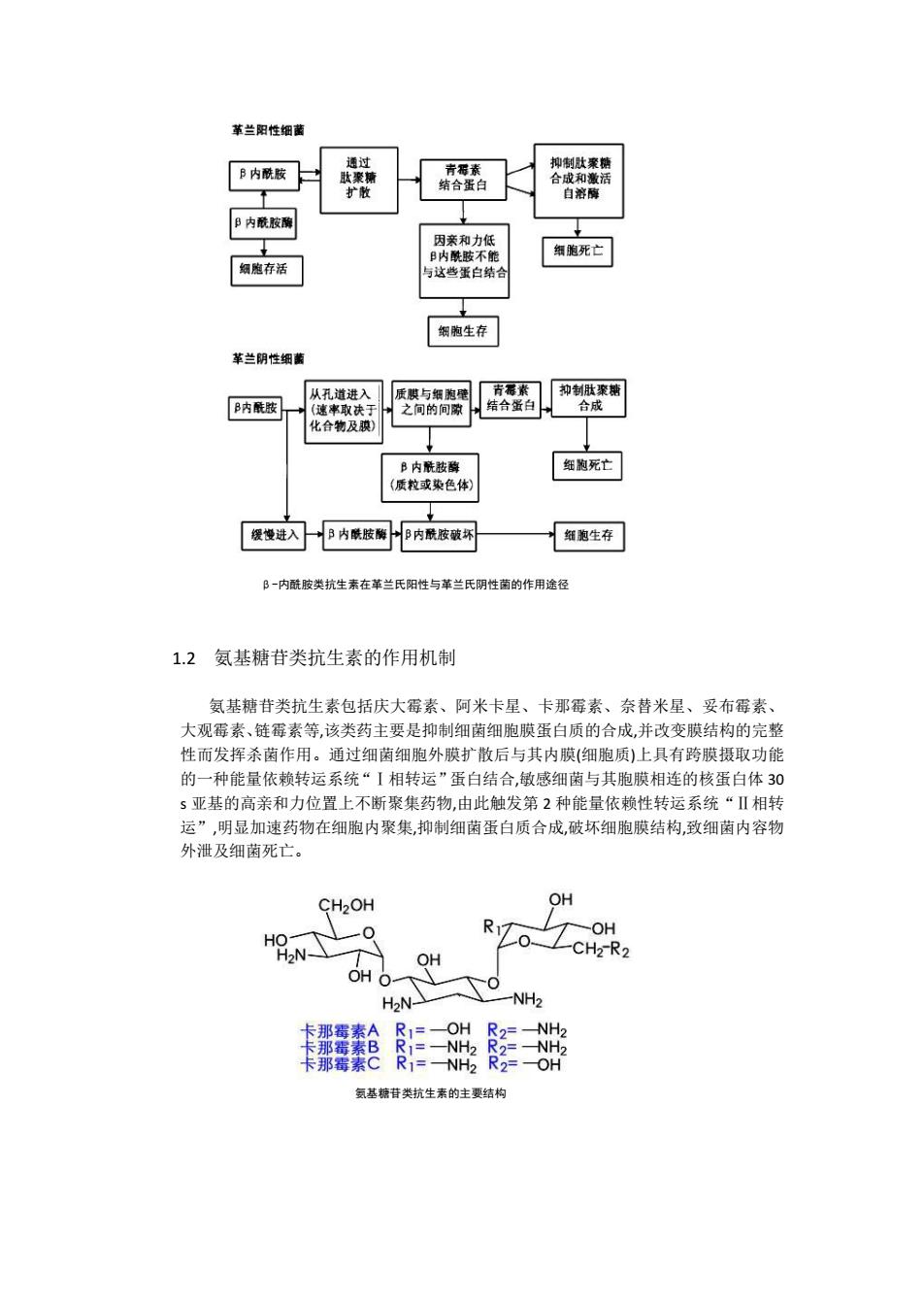
革兰阳性细菌 通过 B内酰胺 青形素 抑制肽聚糖 肽聚糖 结合蛋白 合成和激活 扩散 自溶酶 阝内酰胺酶 因亲和力低 B内酰胺不能 细胞死亡 细胞存活 与这些蛋白结合 细胞生存 革兰阴性细薰 从孔道进入 质膜与细胞壁 青稀素 抑制肚聚糖 B内酰胺 (速率取决于 之间的间隙 结合蛋白 合成 化合物及膜) B内酰胺酶 细胞死亡 (质粒或染色体) 缓慢进入 B内酰胺酶 B内酰胺破坏 细胞生存 B一内酰胺类抗生素在革兰氏阳性与革兰氏阴性菌的作用途径 1.2氨基糖苷类抗生素的作用机制 氨基糖苷类抗生素包括庆大霉素、阿米卡星、卡那霉素、奈替米星、妥布霉素、 大观霉素、链霉素等,该类药主要是抑制细菌细胞膜蛋白质的合成,并改变膜结构的完整 性而发挥杀菌作用。通过细菌细胞外膜扩散后与其内膜(细胞质)上具有跨膜摄取功能 的一种能量依赖转运系统“I相转运”蛋白结合,敏感细菌与其胞膜相连的核蛋白体30 s亚基的高亲和力位置上不断聚集药物,由此触发第2种能量依赖性转运系统“Ⅱ相转 运”,明显加速药物在细胞内聚集,抑制细菌蛋白质合成,破坏细胞膜结构,致细菌内容物 外泄及细菌死亡。 CH2OH oH R OH HO H2N CH2-R2 OH OH O H2N- -NH2 卡那霉素A R1=-OH R2=-NH2 卡那霉素B R1=-NH2 R2=-NH2 卡那霉素C R1=-NH2 R2=0H 氨基糖昔类抗生素的主要结构
β-内酰胺类抗生素在革兰氏阳性与革兰氏阴性菌的作用途径 1.2 氨基糖苷类抗生素的作用机制 氨基糖苷类抗生素包括庆大霉素、阿米卡星、卡那霉素、奈替米星、妥布霉素、 大观霉素、链霉素等,该类药主要是抑制细菌细胞膜蛋白质的合成,并改变膜结构的完整 性而发挥杀菌作用。通过细菌细胞外膜扩散后与其内膜(细胞质)上具有跨膜摄取功能 的一种能量依赖转运系统“Ⅰ相转运”蛋白结合,敏感细菌与其胞膜相连的核蛋白体 30 s 亚基的高亲和力位置上不断聚集药物,由此触发第 2 种能量依赖性转运系统“Ⅱ相转 运”,明显加速药物在细胞内聚集,抑制细菌蛋白质合成,破坏细胞膜结构,致细菌内容物 外泄及细菌死亡。 氨基糖苷类抗生素的主要结构
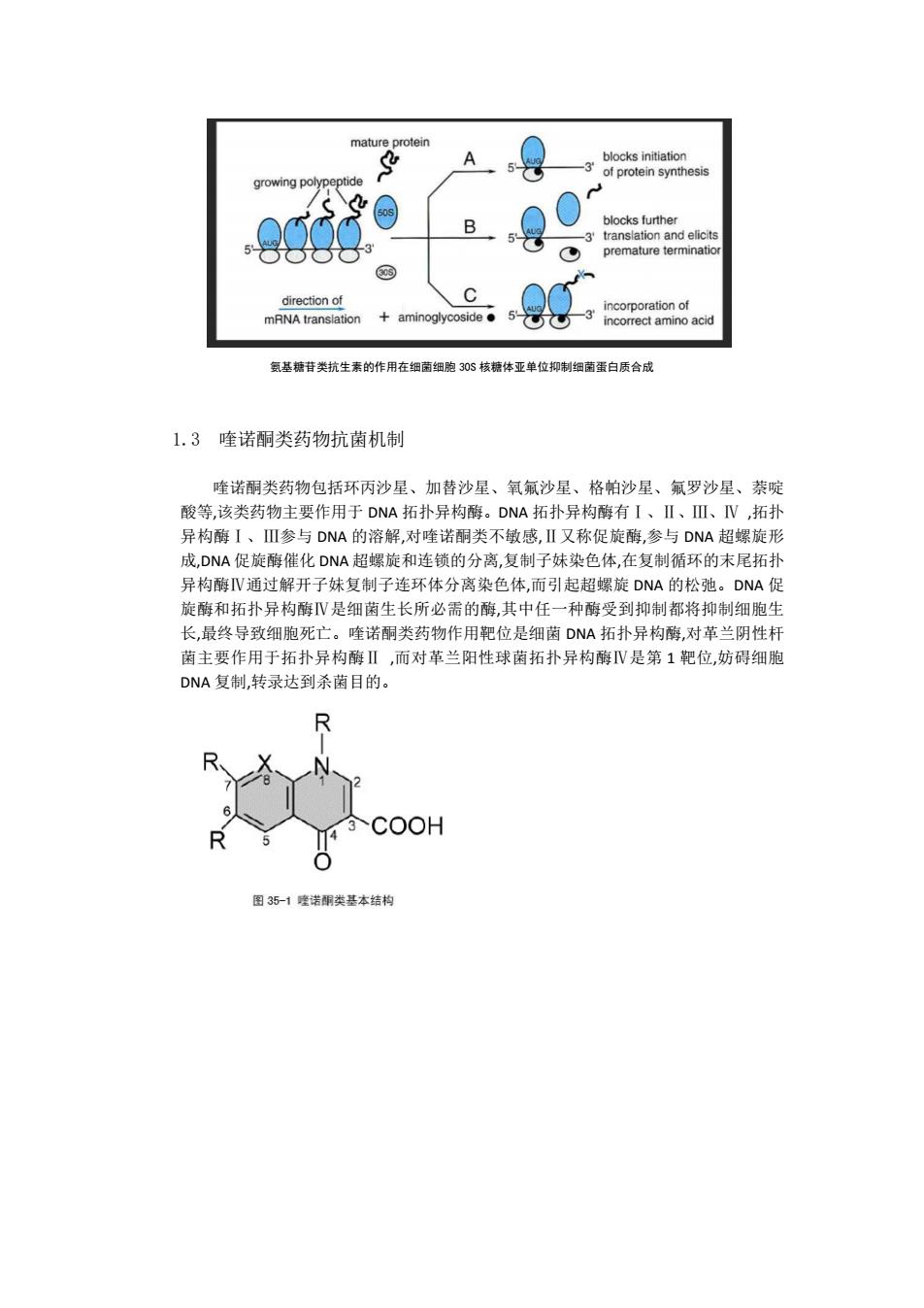
mature protein blocks initiation 5 of protein synthesis growing polypeptide 0 B blocks further 5 translation and elicits premature terminatior direction of incorporation of mRNA translation +aminoglycoside● incorrect amino acid 氨基糖苷类抗生素的作用在细菌细胞30$核糖体亚单位抑制细菌蛋白质合成 1.3喹诺酮类药物抗菌机制 喹诺酮类药物包括环丙沙星、加替沙星、氧氟沙星、格帕沙星、氟罗沙星、萘啶 酸等,该类药物主要作用于DNA拓扑异构酶。DNA拓扑异构酶有I、Ⅱ、Ⅲ、N,拓扑 异构酶I、I参与DNA的溶解,对喹诺酮类不敏感,Ⅱ又称促旋酶,参与DNA超螺旋形 成,DNA促旋酶催化DNA超螺旋和连锁的分离,复制子妹染色体,在复制循环的末尾拓扑 异构酶IV通过解开子妹复制子连环体分离染色体,而引起超螺旋DNA的松弛。DNA促 旋酶和拓扑异构酶Ⅳ是细菌生长所必需的酶,其中任一种酶受到抑制都将抑制细胞生 长,最终导致细胞死亡。喹诺酮类药物作用靶位是细菌DNA拓扑异构酶,对革兰阴性杆 菌主要作用于拓扑异构酶Ⅱ,而对革兰阳性球菌拓扑异构酶Ⅳ是第1靶位,妨碍细胞 DNA复制,转录达到杀菌目的。 COOH 图35-1童诺酮类基本结构
氨基糖苷类抗生素的作用在细菌细胞 30S 核糖体亚单位抑制细菌蛋白质合成 1.3 喹诺酮类药物抗菌机制 喹诺酮类药物包括环丙沙星、加替沙星、氧氟沙星、格帕沙星、氟罗沙星、萘啶 酸等,该类药物主要作用于 DNA 拓扑异构酶。DNA 拓扑异构酶有Ⅰ、Ⅱ、Ⅲ、Ⅳ ,拓扑 异构酶Ⅰ、Ⅲ参与 DNA 的溶解,对喹诺酮类不敏感,Ⅱ又称促旋酶,参与 DNA 超螺旋形 成,DNA 促旋酶催化 DNA 超螺旋和连锁的分离,复制子妹染色体,在复制循环的末尾拓扑 异构酶Ⅳ通过解开子妹复制子连环体分离染色体,而引起超螺旋 DNA 的松弛。DNA 促 旋酶和拓扑异构酶Ⅳ是细菌生长所必需的酶,其中任一种酶受到抑制都将抑制细胞生 长,最终导致细胞死亡。喹诺酮类药物作用靶位是细菌 DNA 拓扑异构酶,对革兰阴性杆 菌主要作用于拓扑异构酶Ⅱ ,而对革兰阳性球菌拓扑异构酶Ⅳ是第 1 靶位,妨碍细胞 DNA 复制,转录达到杀菌目的
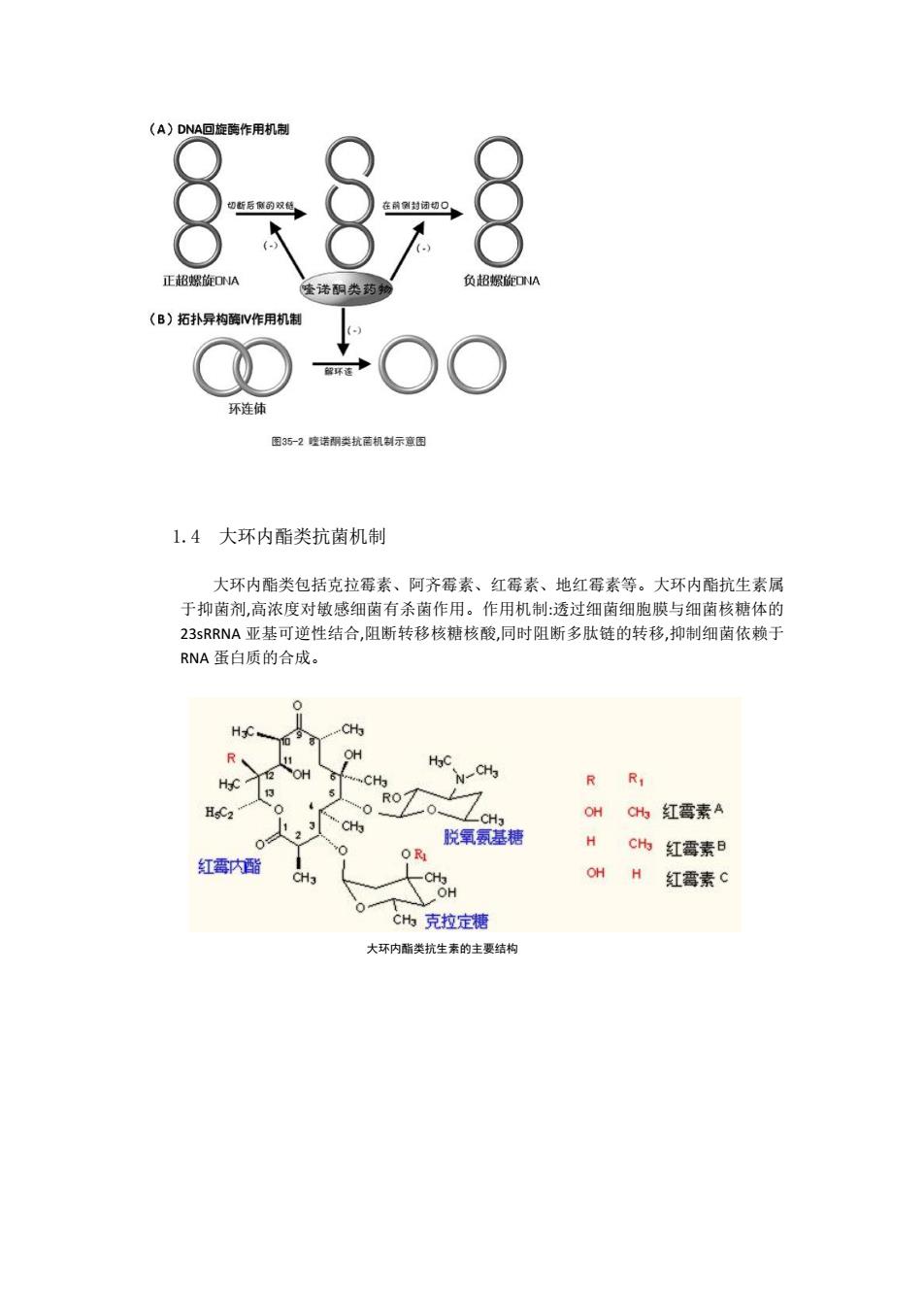
88 (A)DNA回旋酶作用机制 正超螺旋ONA 招螺旋ONA 喹诺阴类药物 (B)拓扑异构酶V作用机制 环连体 图35-2喷诺酮类抗随机制示章图 1.4大环内酯类抗菌机制 大环内酯类包括克拉霉素、阿齐霉素、红霉素、地红霉素等。大环内酯抗生素属 于抑菌剂,高浓度对敏感细菌有杀菌作用。作用机制:透过细菌细胞膜与细菌核糖体的 23 SRRNA亚基可逆性结合,阻断转移核糖核酸,同时阻断多肽链的转移,抑制细菌依赖于 RNA蛋白质的合成。 CHa CHa R R1 RO HsC2 0 CH3 OH C州红霉素A 0 脱氧氨基糖 H Ch红霉素B 红霉内酯 CHa OH H 红霉素C OH CH克拉定糖 大环内酯类抗生素的主要结构
1.4 大环内酯类抗菌机制 大环内酯类包括克拉霉素、阿齐霉素、红霉素、地红霉素等。大环内酯抗生素属 于抑菌剂,高浓度对敏感细菌有杀菌作用。作用机制:透过细菌细胞膜与细菌核糖体的 23sRRNA 亚基可逆性结合,阻断转移核糖核酸,同时阻断多肽链的转移,抑制细菌依赖于 RNA 蛋白质的合成。 大环内酯类抗生素的主要结构

macrolides fMet Arg 8 888 GGA 大环内酯类结合到细菌核糖体50S亚基上,阻断转肽作用及mRNA位移,抑制蛋白质合成 2细菌的耐药机制 2.1遗传性耐药 2.1.1固有耐药 在长期进化过程中,为适应不利环境,经过优胜劣汰,微生物己获得抵抗多种不利 因素的能力。一些微生物如放线菌、真菌等可以合成适量抗生素以杀灭周边的细菌 而获得更有利于自己生存的环境,周边的细菌也为了适应环境,在长期抗生素压力下 通过诱导突变,对抗生素产生了抵抗力,这种耐药有特异性,耐药基因存在于染色体 上。如绿脓杆菌、醋酸不动杆菌、假单胞菌属及大多数G杆菌耐万古霉素和甲氧 西林:肠球菌耐头孢菌素;厌氧菌耐氨基糖苷类药物;铜绿假单胞菌耐头孢氨苄、头孢 克洛、头孢噻肟、头孢呋辛、四环素;嗜麦牙假单胞菌耐泰能等。 2.1.2染色体突变耐药 染色体突变是细菌耐药性产生的原始遗传基础,质粒的产生和传播是细菌扩散耐 药性、新菌株获得耐药性的一种快捷方式。突变可发生于DNA分子,可发生于质粒 和转痤子的基因上。耐药菌株在长期进化过程中可能通过染色体断裂或缺失,使带有 耐药基因的DNA片段脱离形成耐药质粒,通过质粒的转移和插入累计,使耐药性在不 同菌株间传播,使同一菌株的抗菌谱扩大。 2.2获得性耐药 2.2.1灭活酶和钝化酶的产生 细菌可产生灭活酶和钝化酶,这些酶通过修饰、水解乙酰化、磷酸化等破坏抗生 素从而使其失去抗菌作用。目前发现的酶类主要有B内酰胺酶、氨基糖苷类钝化酶、 红霉素类药物钝化酶以及氯霉素乙酰转移酶
大环内酯类结合到细菌核糖体 50S 亚基上,阻断转肽作用及 mRNA 位移,抑制蛋白质合成 2 细菌的耐药机制 2.1 遗传性耐药 2.1.1 固有耐药 在长期进化过程中,为适应不利环境,经过优胜劣汰,微生物已获得抵抗多种不利 因素的能力。一些微生物如放线菌、真菌等可以合成适量抗生素以杀灭周边的细菌 而获得更有利于自己生存的环境,周边的细菌也为了适应环境,在长期抗生素压力下 通过诱导突变,对抗生素产生了抵抗力,这种耐药有特异性,耐药基因存在于染色体 上。如绿脓杆菌、醋酸不动杆菌、假单胞菌属及大多数 G-杆菌耐万古霉素和甲氧 西林;肠球菌耐头孢菌素;厌氧菌耐氨基糖苷类药物;铜绿假单胞菌耐头孢氨苄、头孢 克洛、头孢噻肟、头孢呋辛、四环素;嗜麦牙假单胞菌耐泰能等。 2.1.2 染色体突变耐药 染色体突变是细菌耐药性产生的原始遗传基础,质粒的产生和传播是细菌扩散耐 药性、新菌株获得耐药性的一种快捷方式。突变可发生于 DNA 分子,可发生于质粒 和转痤子的基因上。耐药菌株在长期进化过程中可能通过染色体断裂或缺失,使带有 耐药基因的 DNA 片段脱离形成耐药质粒,通过质粒的转移和插入累计,使耐药性在不 同菌株间传播,使同一菌株的抗菌谱扩大。 2.2 获得性耐药 2.2.1 灭活酶和钝化酶的产生 细菌可产生灭活酶和钝化酶,这些酶通过修饰、水解乙酰化、磷酸化等破坏抗生 素从而使其失去抗菌作用。目前发现的酶类主要有β-内酰胺酶、氨基糖苷类钝化酶、 红霉素类药物钝化酶以及氯霉素乙酰转移酶

(1)B-内酰胺酶:是数量最多,最为复杂的一种酶,是大多数条件致病菌对B-内酰 胺类抗生素耐药的主要原因,该酶的产生主要是由染色体上的耐药基因和质粒上的 耐药基因介导,目前己达190余种,通过水解或非水解方式破坏B-内酰胺环使抗生素 失活。对其分类有多种,最常用的是Ambler根据酶末端氨基酸序列及编码基因的位 点将B-内酰胺酶按照分子生物学分类分为A、B、C、D4类:A类为丝氨酸酶,由质粒 编码;B类为金属酶,由染色体编码;C类为丝氨酸酶,由染色体编码;D类为丝氨酸酶,由 质粒编码。 Periplasmic spaoe ②as Beta-Lactamases Outer Membrane Cell wall GT TP Ciass D.Senne Inner Membrane ③Beta-Lactam B-内酰胺类抗生素的耐药机制 (1)产生B-内酰胺酶使抗生素水解失活 (2)PBPs靶蛋白与抗生素亲和力降低、PBPs增多或产生新的PBPs使抗生素失去抗菌作用 (3)细菌将抗生素泵出,使抗生素失去抗菌作用 (2)氨基糖苷类钝化酶:氨基糖苷类钝化酶的产生是临床上细菌对氨基糖苷类抗生 素耐药的主要机制,许多G菌、金黄色葡萄球菌和肠球菌均可产生此酶。已发现的氨 基糖苷酶有20种以上,此类酶按机制不同分为3类:乙酰转移酶(AAC)、核苷转移酶 (ANT)及磷酸转移酶(APH)。其中AAC可以使游离羟基乙酰化;ANT可以使游离羟基核 苷化;APH可以使游离羟基磷酸化。它们的作用使药物不容易进入细菌体内,也不易与 细菌内靶位结合,从而失去抑制细菌蛋白质合成的能力。 (3)大环内酯类(MSL)药物钝化酶:编码MSL钝化酶的基因主要位于质粒上,可水解红 霉素的大环内脂结构。林可霉素类钝化酶在很多葡萄球菌和乳酸杆菌中被发现,该 酶使抗生素分子的羟基磷酸化或者核苷酰化。 (4)氯霉素乙酰转移酶(CAT):由CAT基因编码,产生乙酰基转移酶,使氯霉素转化成无 活性的代谢产物而失去抗菌活性。 2.2.2抗生素作用靶位的改变 细菌在抗生素作用下产生诱导酶对菌体进行化学修饰,使抗生素结合的有效靶 位发生改变,从而阻止抗生素对细菌的作用,如青霉素结合蛋白编码的基因突变致 PBPs构象改变,与B-内酰胺类药物结合降低而耐药;拓扑异构酶Ⅳ编码基因突变,编 码促旋酶的GYRA、GYRB基因及编码拓扑异构酶V的PARC、PARE基因突变,其表达 产物的构象改变即可致细菌对喹诺酮类耐药
(1)β-内酰胺酶:是数量最多,最为复杂的一种酶,是大多数条件致病菌对β-内酰 胺类抗生素耐药的主要原因,该酶的产生主要是由染色体上的耐药基因和质粒上的 耐药基因介导,目前已达 190 余种,通过水解或非水解方式破坏β-内酰胺环使抗生素 失活。对其分类有多种,最常用的是 Ambler 根据酶末端氨基酸序列及编码基因的位 点将β-内酰胺酶按照分子生物学分类分为 A、B、C、D 4 类:A 类为丝氨酸酶,由质粒 编码;B 类为金属酶,由染色体编码;C 类为丝氨酸酶,由染色体编码;D 类为丝氨酸酶,由 质粒编码。 β-内酰胺类抗生素的耐药机制 (1)产生β-内酰胺酶使抗生素水解失活 (2)PBPs 靶蛋白与抗生素亲和力降低、PBPs 增多或产生新的 PBPs 使抗生素失去抗菌作用 (3)细菌将抗生素泵出,使抗生素失去抗菌作用 (2)氨基糖苷类钝化酶:氨基糖苷类钝化酶的产生是临床上细菌对氨基糖苷类抗生 素耐药的主要机制,许多 G-菌、金黄色葡萄球菌和肠球菌均可产生此酶。已发现的氨 基糖苷酶有 20 种以上,此类酶按机制不同分为 3 类:乙酰转移酶(AAC)、核苷转移酶 (ANT)及磷酸转移酶(APH)。其中 AAC 可以使游离羟基乙酰化;ANT 可以使游离羟基核 苷化;APH 可以使游离羟基磷酸化。它们的作用使药物不容易进入细菌体内,也不易与 细菌内靶位结合,从而失去抑制细菌蛋白质合成的能力。 (3)大环内酯类(MSL)药物钝化酶:编码 MSL钝化酶的基因主要位于质粒上,可水解红 霉素的大环内脂结构。林可霉素类钝化酶在很多葡萄球菌和乳酸杆菌中被发现,该 酶使抗生素分子的羟基磷酸化或者核苷酰化。 (4)氯霉素乙酰转移酶(CAT):由 CAT 基因编码,产生乙酰基转移酶,使氯霉素转化成无 活性的代谢产物而失去抗菌活性。 2.2.2 抗生素作用靶位的改变 细菌在抗生素作用下产生诱导酶对菌体进行化学修饰,使抗生素结合的有效靶 位发生改变,从而阻止抗生素对细菌的作用,如青霉素结合蛋白编码的基因突变致 PBPs 构象改变,与β-内酰胺类药物结合降低而耐药;拓扑异构酶Ⅳ编码基因突变,编 码促旋酶的 GYRA、GYRB 基因及编码拓扑异构酶Ⅳ的 PARC、PARE 基因突变,其表达 产物的构象改变即可致细菌对喹诺酮类耐药

2.2.3细菌细胞膜通透性的改变 细菌细胞膜是一种具有高度选择性的通透屏障,抗生素大多通过膜上的一类水 溶性通道蛋白进入菌体内部发挥作用,这类蛋白叫做膜孔蛋白或多膜蛋白,重要有 OMPF、OMPC、OMPE3种。疏水性强的药物如甲氧西林易对G-菌产生耐药,带负电 多的抗生素分子不易通过外膜通道蛋白,这些机制都使某些细菌对相应药物产生耐 药。由于某些细菌发生基因突变,可以使其通道蛋白关闭或消失,于是对相应抗生素 产生明显耐药,如铜绿假单胞菌失去特异性外膜蛋白D2后对原来敏感的亚胺培南 发生耐药。 2.2.4细菌的主动泵出功能 细菌的外膜上存在特殊的药物泵出系统,这一机能是细菌对四环素、大环内酯类 抗生素耐药的重要机制,也是金黄色葡萄球菌对喹诺酮类药物耐药的重要机制。如铜 绿假单胞菌存在多种外排系统,如MexAB-oprm、MexCD-opr」、MexEF-oprN、 Mexxy-oprM、MexJk-oprM、Mex-Hl-opmD和Mexwr-oprM,是其固有耐药性或获得性 多重耐药性形成的主要原因。 两性药物日 外膜通道 铺助蛋白 外膜 周质 外排转运器 质膜 细菌的外排机制 2.2.5细菌生物被膜的形成 生物被膜的理论首先由Coste-rton等在1978年提出,它是细菌为适应生存环境,生长 过程中黏附于固体或有机腔道表面,形成微菌落,并分泌细胞外多糖蛋白复合物将自身包 裹其中而形成的膜状物,其形成后可减少抗生素的渗透,吸附抗生素钝化酶促进药物分解。 生物膜的形成使细菌在一定程度上逃避了机体对其的免疫杀伤作用,致使细菌对该类药 物产生高度耐药。 附录: 细菌耐药机制拟研究思路:可从B-内酰胺酶、外膜蛋白、外排泵等不同方面着手
2.2.3 细菌细胞膜通透性的改变 细菌细胞膜是一种具有高度选择性的通透屏障,抗生素大多通过膜上的一类水 溶性通道蛋白进入菌体内部发挥作用,这类蛋白叫做膜孔蛋白或多膜蛋白,重要有 OMPF、OMPC、OMPE 3 种。疏水性强的药物如甲氧西林易对 G-菌产生耐药,带负电 多的抗生素分子不易通过外膜通道蛋白,这些机制都使某些细菌对相应药物产生耐 药。由于某些细菌发生基因突变,可以使其通道蛋白关闭或消失,于是对相应抗生素 产生明显耐药,如铜绿假单胞菌失去特异性外膜蛋白 D2 后对原来敏感的亚胺培南 发生耐药。 2.2.4 细菌的主动泵出功能 细菌的外膜上存在特殊的药物泵出系统,这一机能是细菌对四环素、大环内酯类 抗生素耐药的重要机制,也是金黄色葡萄球菌对喹诺酮类药物耐药的重要机制。如铜 绿 假单 胞菌 存在 多种 外 排系 统,如 MexAB-oprm 、 MexCD-oprJ、 MexEF-oprN 、 Mexxy-oprM、MexJk-oprM、Mex-HI-opmD 和 Mexwr-oprM,是其固有耐药性或获得性 多重耐药性形成的主要原因。 细菌的外排机制 2.2.5 细菌生物被膜的形成 生物被膜的理论首先由 Coste-rton 等在 1978 年提出,它是细菌为适应生存环境,生长 过程中黏附于固体或有机腔道表面,形成微菌落,并分泌细胞外多糖蛋白复合物将自身包 裹其中而形成的膜状物,其形成后可减少抗生素的渗透,吸附抗生素钝化酶促进药物分解。 生物膜的形成使细菌在一定程度上逃避了机体对其的免疫杀伤作用,致使细菌对该类药 物产生高度耐药。 附录: 细菌耐药机制拟研究思路: 可从β-内酰胺酶、外膜蛋白、外排泵等不同方面着手

分析该菌株的耐药机制。可从表型和基因型分析菌株是否表达B-内酰胺酶、用聚丙烯 酰胺凝胶电泳(SDS-PAGE)和二维聚丙烯酰胺凝胶电泳(2-DE)分析该耐药菌的外膜蛋白与 标准菌相比有无差异表达、PC扩增分析有无该外排泵的基因型、通过外排泵协同抑制 实验进一步分析菌株中是否有外排泵的过表达、以及整合子的基因型分析这一系列实验 来明确该菌株中所具有的耐药机制。同时,从分子水平着手,通过电击转化方法将一段己 知序列的转座子插入到细菌的基因组中,通过表型筛选获得突变株。获得含有转座子及 其两侧的序列的片段,并将这段片段转入大肠杆菌中。筛选得到阳性克隆,再通过反式 PC技术获得转座子两侧的序列以分析细菌有可能的耐药机制。 [1]潘劲草,刘克洲整合子在革兰阴性菌获得性耐药形成机制中的作用U国外医学流 行病学传染学分册,2004,31(5):289-291. [2]Xiong ZZ,Zhu DM,Wang FA.Klebsiella pneumoniaeproducing three kinds of class AB-lactamases encoded by single plasmid iso-lated from a patient in Huashan Hospital,Shanghai,China[J].Int J Antimicrob Agents,2004,23(3):262-267. [3]Rosser SJ,Young HK.Identification and characterization ofclass 1 integrons in bacteria from an aquatic environment[J].J Antimicrob Chemother,1999,44(1):11-18. [4]Rowe-Magnus DA,Guerout AM,Mazel D.Bacterial resist-ance evolution by recruitment of super-integron gene cassettes[J].Mol Microbiol,2002,43(6):1657-1669. [5]Leverstein-van Hall MA,Blok MHE,Donders TAR,et al.Multidrug resistance among Enterobacteriaceae is strongly as-sociated with the presence of integrons and is independent of species or isolate origin[].J Infect Dis,2003,187(2):251-259 [6) Tsakris A,Pournaras S,Woodford N,etal.Outbreak of in-fections caused byPseudomonas aerugiosaproducing VIM-1carbapenemase in Greece[J].J Clin Microbiol,2000,38(3:1290-1292. [7)曹彬,王辉,朱元珏,等.多药耐药铜绿假单胞菌医院感染危险因素及预后因素分析). 中华结核和呼吸杂志,2004,27(1):31-35 [8)王辉,陈民钧.碳青酶烯酶:未来困扰我们的难题).中华内科杂 志,2003,42(5):354-356. [9]赵云峰,罗永艾.耐药结核病的现状及防治).中国实用内科杂志,2004,24(8):451-454. [10]Yu WL,Chuang YC,Jones RN.A pragmatic approach toidentify extended-spectrum beta-lactamase-producingKleb-siella pneumoniaein Taiwan:in vitroactivity of newer andestablished antimicrobial agents[J].Diagn Microbiol Infect Dis,2004,48(4):277-282. [11] Ubukata K,Nonoguchi R,Matschashi M,et al.Expressionand inducibility inStaphylococcus aureusof the meca gene,which encodes a methicillin-resistantS.aureus-specificpeni-cillin-bindingprotein[J].JBacteriol,1989,171( 5):2882-2885. [12]马越,李景云,姚蕾,等.住院患者分离的金黄色葡萄球菌耐药率比较分析].中华医 学杂志,2003,83(5)382-384. [13]Murray BE.Vancomycin-resistant enterococcal infections[J].N Engl J Med,2000,342(10):710-721. [14]沈洪.急诊危重病合并感染的降阶梯治疗策略U].中国危重病急救医 学,2004,14(8):451-452. [15]孟甄,金建玲,刘玉庆,等.细菌耐药性的诱导与消除.中华药理学通
分析该菌株的耐药机制。可从表型和基因型分析菌株是否表达β-内酰胺酶、用聚丙烯 酰胺凝胶电泳(SDS-PAGE)和二维聚丙烯酰胺凝胶电泳(2-DE)分析该耐药菌的外膜蛋白与 标准菌相比有无差异表达、PCR 扩增分析有无该外排泵的基因型、通过外排泵协同抑制 实验进一步分析菌株中是否有外排泵的过表达、以及整合子的基因型分析这一系列实验 来明确该菌株中所具有的耐药机制。同时,从分子水平着手,通过电击转化方法将一段已 知序列的转座子插入到细菌的基因组中,通过表型筛选获得突变株。获得含有转座子及 其两侧的序列的片段,并将这段片段转入大肠杆菌中。筛选得到阳性克隆,再通过反式 PCR 技术获得转座子两侧的序列以分析细菌有可能的耐药机制。 [1] 潘劲草,刘克洲.整合子在革兰阴性菌获得性耐药形成机制中的作用[J].国外医学流 行病学传染学分册,2004,31(5):289-291. [2] Xiong ZZ, Zhu DM, Wang FA.Klebsiella pneumoniaeproducing three kinds of class Aβ-lactamases encoded by single plasmid iso-lated from a patient in Huashan Hospital,Shanghai,China[J].Int J Antimicrob Agents,2004,23(3):262-267. [3] Rosser SJ, Young HK.Identification and characterization ofclass 1 integrons in bacteria from an aquatic environment[J].J Antimicrob Chemother,1999,44(1):11-18. [4] Rowe-Magnus DA,Guerout AM,Mazel D.Bacterial resist-ance evolution by recruitment of super-integron gene cassettes[J].Mol Microbiol,2002,43(6):1657-1669. [5] Leverstein-van Hall MA,Blok MHE,Donders TAR,et al.Multidrug resistance among Enterobacteriaceae is strongly as-sociated with the presence of integrons and is independent of species or isolate origin[J].J Infect Dis,2003,187(2):251-259. [6] Tsakris A, Pournaras S, Woodford N, etal. Outbreak of in-fections caused byPseudomonas aerugiosaproducing VIM-1carbapenemase in Greece[J].J Clin Microbiol,2000,38(3):1290-1292. [7] 曹彬,王辉,朱元珏,等.多药耐药铜绿假单胞菌医院感染危险因素及预后因素分析[J]. 中华结核和呼吸杂志,2004,27(1):31-35. [8] 王 辉 , 陈 民 钧 . 碳 青 酶 烯 酶 : 未 来 困 扰 我 们 的 难 题 [J]. 中 华 内 科 杂 志,2003,42(5):354-356. [9] 赵云峰,罗永艾.耐药结核病的现状及防治[J].中国实用内科杂志,2004,24(8):451-454. [10] Yu WL, Chuang YC, Jones RN.A pragmatic approach toidentify extended-spectrum beta-lactamase-producingKleb-siella pneumoniaein Taiwan:in vitroactivity of newer andestablished antimicrobial agents[J].Diagn Microbiol Infect Dis,2004,48(4):277-282. [11] Ubukata K,Nonoguchi R,Matschashi M,et al.Expressionand inducibility inStaphylococcus aureusof the mecA gene,which encodes a methicillin-resistantS.aureus-specificpeni-cillin-bindingprotein[J].JBacteriol,1989,171( 5):2882-2885. [12] 马越,李景云,姚蕾,等.住院患者分离的金黄色葡萄球菌耐药率比较分析[J].中华医 学杂志,2003,83(5):382-384. [13] Murray BE.Vancomycin-resistant enterococcal infections[J].N Engl J Med,2000,342(10):710-721. [14] 沈 洪 . 急 诊 危 重 病 合 并 感 染 的 降 阶 梯 治 疗 策 略 [J]. 中 国 危 重 病 急 救 医 学,2004,14(8):451-452. [15] 孟 甄 , 金 建 玲 , 刘 玉 庆 , 等 . 细 菌 耐 药 性 的 诱 导 与 消 除 [J]. 中 华 药 理 学 通

报,2003,19(9:1047-1050. [16]Niitsuma K,Saitoh M,Kojimabara M,etal.Antimicrobial sus-ceptibility ofPseudomonas aeruginosaisolated in Fukushima Prefecture[J].Jpn J Antibiot,2001,54(2):79-87
报,2003,19(9):1047-1050. [16] Niitsuma K,Saitoh M,Kojimabara M,etal.Antimicrobial sus-ceptibility ofPseudomonas aeruginosaisolated in Fukushima Prefecture[J].Jpn J Antibiot,2001,54(2):79-87