
第 七 章 气 液 质 量 传 递
第 七 章 气 液 质 量 传 递

◆ 微生物反应体系中气液传质举例 需氧培养中的氧传递 以气态烃为碳源的微生物的培养 光合微生物培养中O2和CO2 的传递 氢利用菌中H2、O2、CO2的传递 固氮微生物对N2的利用 在好气性微生物反应中,传质的关键性问题是氧 的传递
◆ 微生物反应体系中气液传质举例 需氧培养中的氧传递 以气态烃为碳源的微生物的培养 光合微生物培养中O2和CO2 的传递 氢利用菌中H2、O2、CO2的传递 固氮微生物对N2的利用 在好气性微生物反应中,传质的关键性问题是氧 的传递

第一节 氧的溶解和微生物的耗氧
第一节 氧的溶解和微生物的耗氧

一、 氧在液体中的溶解 1、溶解氧(DO; Dissolved Oxygen) ◇ 作为环境因素对微生物反应有直接影响; ◇ 被好氧性微生物吸收消耗,并直接参与生长代谢过程, 可视为一种营养性底物
一、 氧在液体中的溶解 1、溶解氧(DO; Dissolved Oxygen) ◇ 作为环境因素对微生物反应有直接影响; ◇ 被好氧性微生物吸收消耗,并直接参与生长代谢过程, 可视为一种营养性底物

◆ 难溶:25°C、一个大气压,空气中的O2在纯水 中的溶解度仅0.25mol/m3。发酵液中含有各种成分, 其溶解度更低。 ◆ 对于菌体浓度为1015个/m3的发酵液,假定每个菌体的 体积为10-16 m3,细胞的呼吸强度为2.6×10-3 molO2/(kgs), 菌体密度为1000 kg/m3,含水量80%,则每立方米培养液的 需氧量为: 10-16×1015×1000×0.2 × 2.6×10-3 =0.052 molO2/(m3·s) ◆ 0.25 ÷ 0.052 = 4.8 (s) 培养液中的溶解氧最多可用4.8秒,因此必须连续通气
◆ 难溶:25°C、一个大气压,空气中的O2在纯水 中的溶解度仅0.25mol/m3。发酵液中含有各种成分, 其溶解度更低。 ◆ 对于菌体浓度为1015个/m3的发酵液,假定每个菌体的 体积为10-16 m3,细胞的呼吸强度为2.6×10-3 molO2/(kgs), 菌体密度为1000 kg/m3,含水量80%,则每立方米培养液的 需氧量为: 10-16×1015×1000×0.2 × 2.6×10-3 =0.052 molO2/(m3·s) ◆ 0.25 ÷ 0.052 = 4.8 (s) 培养液中的溶解氧最多可用4.8秒,因此必须连续通气

氧的饱和浓度单位:mmol O2/L, mg O2/L, ppm 或大气压 气体和溶液接触一定时间后,气体分子在气-液二相中的 浓度,就会达到动态平衡,此时溶解到溶液中的气体分子 数等于逸出溶液的气体分子数。若外界条件不变,气体在 溶液中的浓度就不再随时间而变化,此浓度为饱和浓度或 平衡浓度 2、饱和浓度
氧的饱和浓度单位:mmol O2/L, mg O2/L, ppm 或大气压 气体和溶液接触一定时间后,气体分子在气-液二相中的 浓度,就会达到动态平衡,此时溶解到溶液中的气体分子 数等于逸出溶液的气体分子数。若外界条件不变,气体在 溶液中的浓度就不再随时间而变化,此浓度为饱和浓度或 平衡浓度 2、饱和浓度

3、影响饱和浓度值的因素 1)温度 随着温度升高,气体分 子运动加快,使饱和浓 度下降。 在1个大气压及不同温度 下纯氧在水中的溶解度(mmol/L) 温度 (ºC) 溶解度 0 2.18 10 1.70 15 1.54 20 1.38 25 1.26 30 1.16 35 1.09 40 1.03
3、影响饱和浓度值的因素 1)温度 随着温度升高,气体分 子运动加快,使饱和浓 度下降。 在1个大气压及不同温度 下纯氧在水中的溶解度(mmol/L) 温度 (ºC) 溶解度 0 2.18 10 1.70 15 1.54 20 1.38 25 1.26 30 1.16 35 1.09 40 1.03

当纯水与一个大气压的空气相平衡时,温度对氧 饱和浓度的影响也可用下列经验公式来计算(适用 浓度为4~33ºC) C* = 14.68/ (31.6 + t) C* -与1个大气压空气相平衡的水中氧的饱和浓度,mol/m3 t-溶液的温度,ºC
当纯水与一个大气压的空气相平衡时,温度对氧 饱和浓度的影响也可用下列经验公式来计算(适用 浓度为4~33ºC) C* = 14.68/ (31.6 + t) C* -与1个大气压空气相平衡的水中氧的饱和浓度,mol/m3 t-溶液的温度,ºC
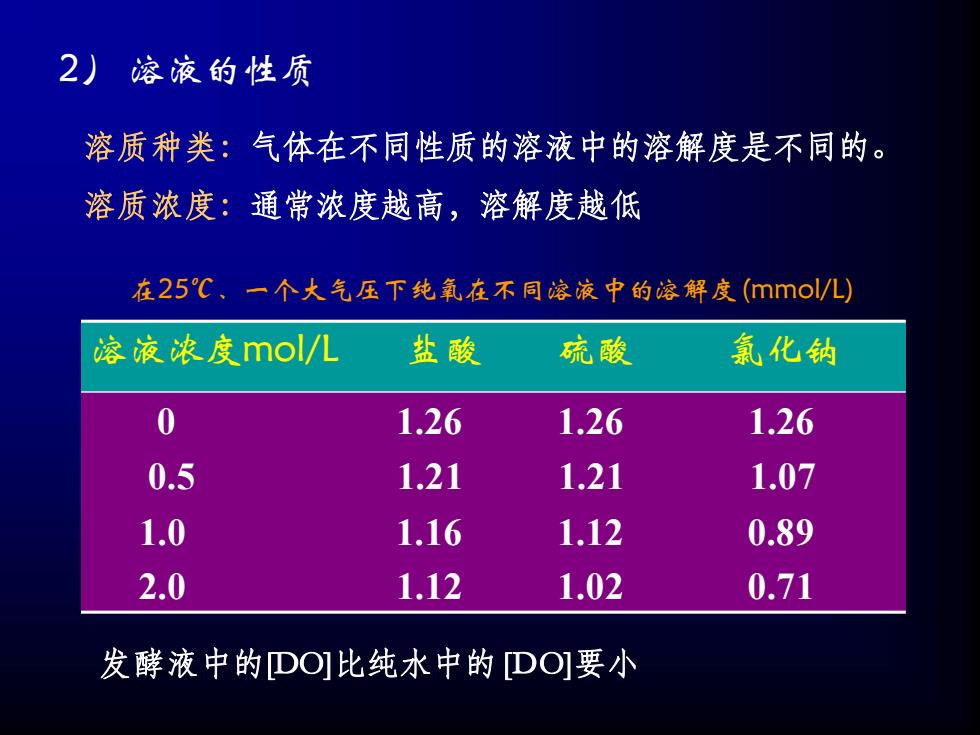
2) 溶液的性质 溶质种类:气体在不同性质的溶液中的溶解度是不同的。 溶质浓度:通常浓度越高,溶解度越低 溶液浓度mol/L 盐酸 硫酸 氯化钠 0 1.26 1.26 1.26 0.5 1.21 1.21 1.07 1.0 1.16 1.12 0.89 2.0 1.12 1.02 0.71 在25℃、一个大气压下纯氧在不同溶液中的溶解度(mmol/L) 发酵液中的[DO]比纯水中的[DO]要小
2) 溶液的性质 溶质种类:气体在不同性质的溶液中的溶解度是不同的。 溶质浓度:通常浓度越高,溶解度越低 溶液浓度mol/L 盐酸 硫酸 氯化钠 0 1.26 1.26 1.26 0.5 1.21 1.21 1.07 1.0 1.16 1.12 0.89 2.0 1.12 1.02 0.71 在25℃、一个大气压下纯氧在不同溶液中的溶解度(mmol/L) 发酵液中的[DO]比纯水中的[DO]要小

在系统总分压小于5个大气压的情况下,氧的溶解度与总 压和其他气体的分压无关,只与氧分压成直线相关,可用 Henry定律表示: C* = PO2/H 3)氧分压 C* — 与气相PO2达平衡时溶液中的氧浓度,mmolO2/L PO2 — 氧分压, Pa H — Henry常数(与溶液性质、温度等有关),Pa·L/mmolO2 气相中氧浓度增加,溶液中溶氧浓度亦随之增加,必 要时可向发酵液中通入纯氧以提高溶氧
在系统总分压小于5个大气压的情况下,氧的溶解度与总 压和其他气体的分压无关,只与氧分压成直线相关,可用 Henry定律表示: C* = PO2/H 3)氧分压 C* — 与气相PO2达平衡时溶液中的氧浓度,mmolO2/L PO2 — 氧分压, Pa H — Henry常数(与溶液性质、温度等有关),Pa·L/mmolO2 气相中氧浓度增加,溶液中溶氧浓度亦随之增加,必 要时可向发酵液中通入纯氧以提高溶氧