
环境监测实验指导书 农学院资源与环境系生态组编 2015年
环境监测实验指导书 农学院资源与环境系生态组编 2015 年

实验一滴定分析基本操作练习 一、实验目的 1,学会配制标准溶液并能准确测定其浓度。 2.掌握滴定基本操作。 二、实验原理 滴定分析是将一种已知准确浓度的标准溶液滴加到被测试样的溶液中,直到 化学反应完全为止,然后根据标准溶液的浓度和体积求得被测试样中组份含量的 一种方法。 三、仪器及试剂 1.50mL酸式滴定管 2.50mL碱式滴定管 3.250mL容量瓶 4.Na0H固体 5.浓HC1 6.酚酞:0.2%乙醇溶液 7.甲基橙:0.1%水溶液 8,百里酚蓝-甲酚红混合指示剂:0.1%的百里酚蓝水溶液三份与0.1%的 甲酚红水溶液一份混合而成。 四、操作练习 1.0.1mol/LHC1的配制:用量简量取浓HC1约9mL,倒入试剂瓶中,加水 稀释至1L,盖塞后摇匀。注意浓HC1易挥发,应在通风橱中操作。 2.0.1mol/LNa0H的配制:称取固体Na0H4g,置于250mL烧杯中,马上 加入蒸馏水使之溶解,稍冷却后转入试剂瓶中,加水稀释至1L,用橡皮塞塞好 瓶口,充分摇匀。 3.酸碱溶液的相互滴定: (1)用滴定剂清洗滴定管2~3次,每次用5~10mL溶液润洗。然后将滴定剂 倒入滴定管中,将滴定管液面调节至0.00刻度。 (2)在250mL锥形瓶中加入约20mL的Na0H溶液,2滴甲基橙指示剂,用酸式 滴定管中的C1溶液进行滴定操作练习,溶液由黄色变为橙色即为终点,准确 读取滴定管上的读数,准确至0.01mL。练习过程中,可以不断补充Na0H和HC1, 反复进行,直至操作熟练后,再进行下面的实验
实验一 滴定分析基本操作练习 一、实验目的 1.学会配制标准溶液并能准确测定其浓度。 2.掌握滴定基本操作。 二、实验原理 滴定分析是将一种已知准确浓度的标准溶液滴加到被测试样的溶液中,直到 化学反应完全为止,然后根据标准溶液的浓度和体积求得被测试样中组份含量的 一种方法。 三、仪器及试剂 1.50mL 酸式滴定管 2.50mL 碱式滴定管 3.250mL 容量瓶 4.NaOH 固体 5.浓 HCl 6.酚酞 : 0.2%乙醇溶液 7.甲基橙 : 0.1%水溶液 8.百里酚蓝-甲酚红混合指示剂:0.1%的百里酚蓝水溶液三份与 0.1%的 甲酚红水溶液一份混合而成。 四、操作练习 1.0.1mol/L HCl 的配制:用量筒量取浓 HCl 约 9mL,倒入试剂瓶中,加水 稀释至 1L,盖塞后摇匀。注意浓 HCl 易挥发,应在通风橱中操作。 2.0.1mol/L NaOH 的配制: 称取固体 NaOH4g,置于 250mL 烧杯中,马上 加入蒸馏水使之溶解,稍冷却后转入试剂瓶中,加水稀释至 1L,用橡皮塞塞好 瓶口,充分摇匀。 3.酸碱溶液的相互滴定: ⑴用滴定剂清洗滴定管 2~3 次, 每次用 5~10mL 溶液润洗。然后将滴定剂 倒入滴定管中,将滴定管液面调节至 0.00 刻度。 ⑵在 250mL 锥形瓶中加入约 20mL 的 NaOH 溶液,2 滴甲基橙指示剂,用酸式 滴定管中的 HCl 溶液进行滴定操作练习, 溶液由黄色变为橙色即为终点,准确 读取滴定管上的读数,准确至 0.01mL。练习过程中,可以不断补充 NaOH 和 HCl, 反复进行,直至操作熟练后,再进行下面的实验
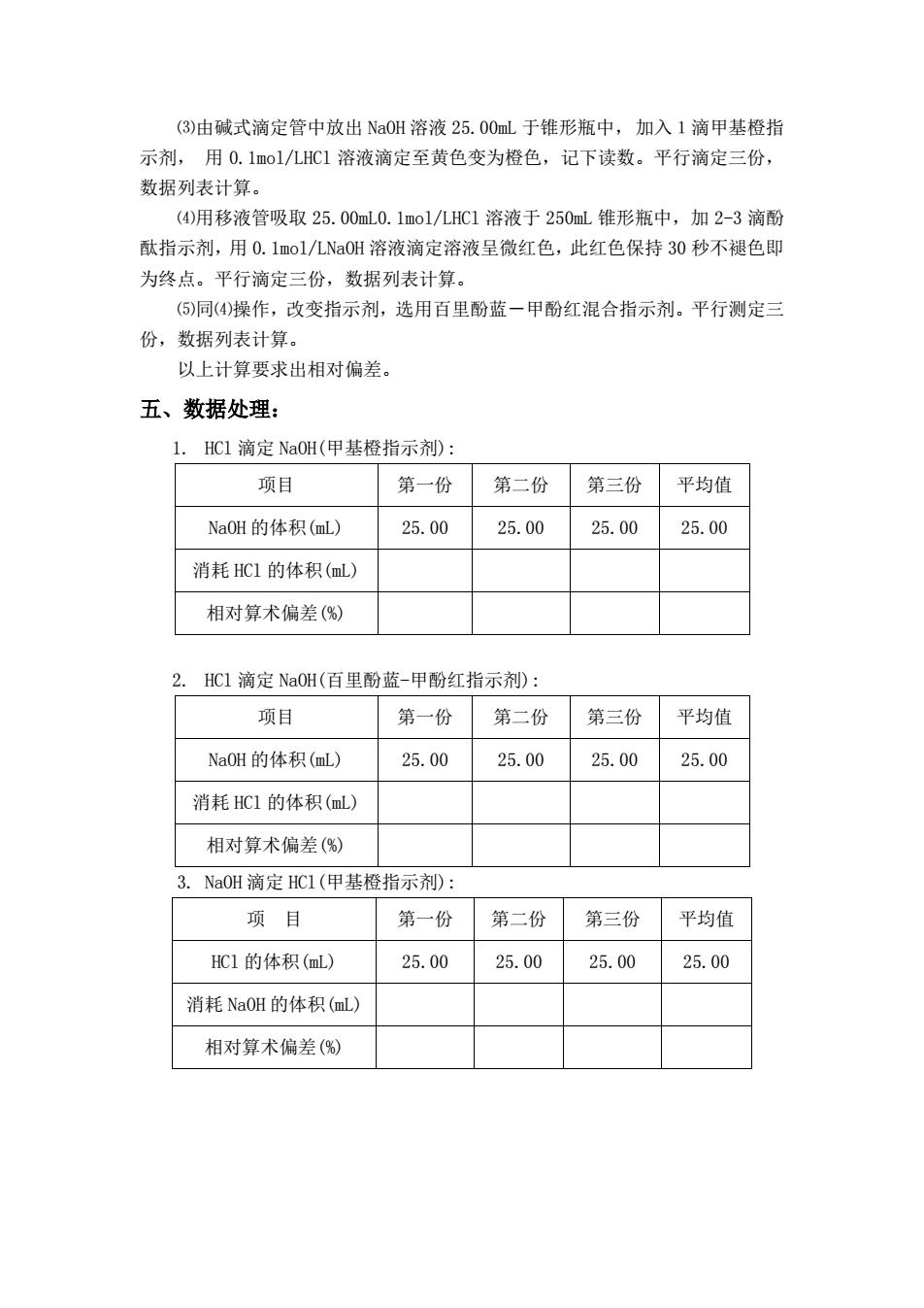
(3)由碱式滴定管中放出Na0H溶液25.00mL于锥形瓶中,加入1滴甲基橙指 示剂,用0.1mol/几HC1溶液滴定至黄色变为橙色,记下读数。平行滴定三份, 数据列表计算。 (④)用移液管吸取25.00mL0.1mo1/LHC1溶液于250mL锥形瓶中,加2-3滴酚 酞指示剂,用0.1mol/LNa0H溶液滴定溶液呈微红色,此红色保持30秒不褪色即 为终点。平行滴定三份,数据列表计算。 (⑤)同(4)操作,改变指示剂,选用百里酚蓝一甲酚红混合指示剂。平行测定三 份,数据列表计算。 以上计算要求出相对偏差。 五、数据处理: 1.HC1滴定NaOH(甲基橙指示剂) 项目 第一份 第二份第三份 平均值 NaOH的体积(mL) 25.00 25.00 25.00 25.00 消耗HC1的体积(mL) 相对算术偏差() 2.HC1滴定NaOH(百里酚蓝-甲酚红指示剂): 项目 第一份第二份 第三份 平均值 NaOH的体积(mL) 25.0025.00 25.00 25.00 消耗HC1的体积(mL) 相对算术偏差() 3.NaOH滴定HCI(甲基橙指示剂) 项目 第一份 第二份 第三份 平均值 HC1的体积(mL) 25.00 25.00 25.00 25.00 消耗NaOH的体积(mL) 相对算术偏差()
⑶由碱式滴定管中放出 NaOH 溶液 25.00mL 于锥形瓶中,加入1滴甲基橙指 示剂, 用 0.1mol/LHCl 溶液滴定至黄色变为橙色,记下读数。平行滴定三份, 数据列表计算。 ⑷用移液管吸取 25.00mL0.1mol/LHCl 溶液于 250mL 锥形瓶中,加 2-3 滴酚 酞指示剂,用 0.1mol/LNaOH 溶液滴定溶液呈微红色,此红色保持 30 秒不褪色即 为终点。平行滴定三份,数据列表计算。 ⑸同⑷操作,改变指示剂,选用百里酚蓝-甲酚红混合指示剂。平行测定三 份,数据列表计算。 以上计算要求出相对偏差。 五、数据处理: 1. HCl 滴定 NaOH(甲基橙指示剂): 项目 第一份 第二份 第三份 平均值 NaOH 的体积(mL) 25.00 25.00 25.00 25.00 消耗 HCl 的体积(mL) 相对算术偏差(%) 2. HCl 滴定 NaOH(百里酚蓝-甲酚红指示剂): 项目 第一份 第二份 第三份 平均值 NaOH 的体积(mL) 25.00 25.00 25.00 25.00 消耗 HCl 的体积(mL) 相对算术偏差(%) 3. NaOH 滴定 HCl(甲基橙指示剂): 项 目 第一份 第二份 第三份 平均值 HCl 的体积(mL) 25.00 25.00 25.00 25.00 消耗 NaOH 的体积(mL) 相对算术偏差(%)
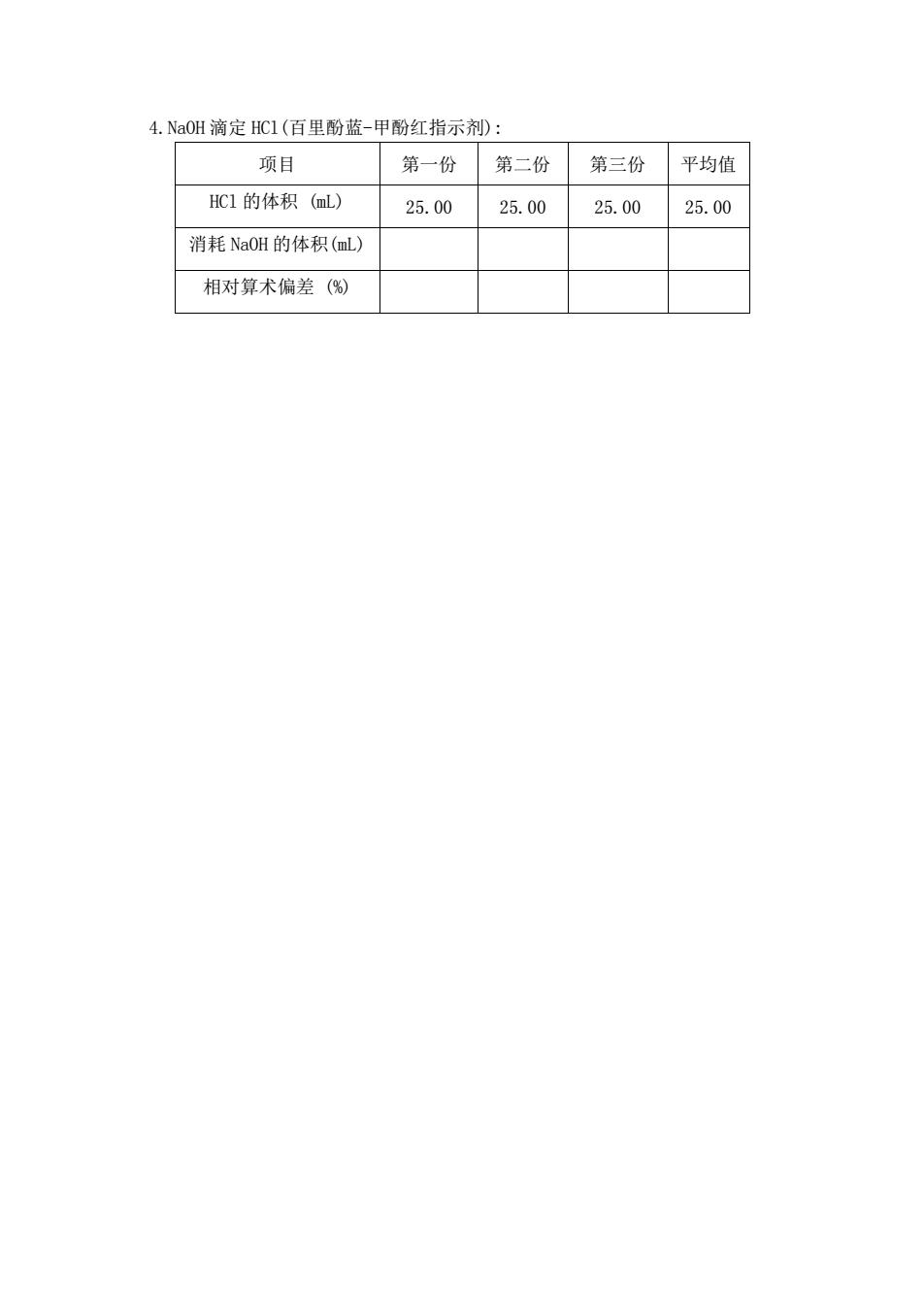
4.NaOH滴定HC1(百里酚蓝-甲酚红指示剂): 项目 第一份第二份第三份 平均值 HC1的体积(mL) 25.0025.00 25.00 25.00 消耗NaOH的体积(mL) 相对算术偏差()
4.NaOH 滴定 HCl(百里酚蓝-甲酚红指示剂): 项目 第一份 第二份 第三份 平均值 HCl 的体积 (mL) 25.00 25.00 25.00 25.00 消耗 NaOH 的体积(mL) 相对算术偏差 (%)

实验二废水悬浮固体和浊度的测定 一、实验目的和要求 掌握悬浮固体和浊度的测定方法。 实验前复习第二章残渣和浊度的有关内容。 二、悬浮固体的测定 (一)原理 悬浮固体系指剩留在滤料上并于103一105℃烘至恒重的固体。测定的方法 是将水样通过滤料后,烘干固体残留物及滤料,将所称重量减去滤料重量,即为 悬浮固体(总不可滤残渣)。 (二)仪器 1.烘箱 2.分析天平。 3.干架器。 4.孔径为0.45μm滤膜及相应的滤器或中速定量滤纸 5.玻璃漏斗。 6.内径为30一50m称量瓶。 (三)测定步骤 1.将滤膜放在称量瓶中,打开瓶盖,在103一105℃烘干2h,取出冷却后盖 好瓶盖称重,直至恒重(两次称量相差不超过0.0005g) 2.去除漂浮物后振荡水样,量取均匀适量水样(使悬浮物大于2.5mg),通 过上面称至恒重的滤膜过滤:用蒸馏水洗残渣3一5次。如样品中含油脂,用10m 石油醚分两次淋洗残渣。 3.小心取下滤膜,放入原称量瓶内,在103一105℃烘箱中,打开瓶盖烘2h, 冷却后盖好盖称重,直至恒重为止。 (四)计算 悬浮固体(mg/L)=A-B)×1000X100 式中:A一一悬浮固体+滤膜及称量瓶重(g); B一一滤膜及称量瓶重(g): V一一水样体积(l)
实验二 废水悬浮固体和浊度的测定 一 、实验目的和要求 掌握悬浮固体和浊度的测定方法。 实验前复习第二章残渣和浊度的有关内容。 二、悬浮固体的测定 (一)原理 悬浮固体系指剩留在滤料上并于 103—105℃烘至恒重的固体。测定的方法 是将水样通过滤料后,烘干固体残留物及滤料,将所称重量减去滤料重量,即为 悬浮固体(总不可滤残渣)。 (二)仪器 1.烘箱。 2.分析天平。 3.干燥器。 4.孔径为 0.45μm 滤膜及相应的滤器或中速定量滤纸。 5.玻璃漏斗。 6.内径为 30—50mm 称量瓶。 (三)测定步骤 1.将滤膜放在称量瓶中,打开瓶盖,在 103—105℃烘干 2h,取出冷却后盖 好瓶盖称重,直至恒重(两次称量相差不超过 0.0005g)。 2.去除漂浮物后振荡水样,量取均匀适量水样(使悬浮物大于 2.5mg),通 过上面称至恒重的滤膜过滤;用蒸馏水洗残渣 3—5 次。如样品中含油脂,用 10mL 石油醚分两次淋洗残渣。 3.小心取下滤膜,放入原称量瓶内,在 103—105℃烘箱中,打开瓶盖烘 2h, 冷却后盖好盖称重,直至恒重为止。 (四)计算 式中:A——悬浮固体+滤膜及称量瓶重(g); B——滤膜及称量瓶重(g); V——水样体积(mL)

(五)注意事项: 1.树叶、木棒、水草等杂质应先从水中除去。 2.废水粘度高时,可加2一4倍蒸馏水稀释,振荡均匀,待沉淀物下降后再 过滤。 3.也可采用石棉坩埚进行过滤。 三、浊度 (一)原理 浊度是表现水中悬浮物对光线透过时所发生的阻碍程度。水中含有泥土、粉 砂、微细有机物、无机物、浮游动物和其他微生物等悬浮物和胶体物都可使水样 呈现浊度。水的浊度大小不仅和水中存在颗粒物含量有关,而且和其粒径大小、 形状、颗粒表面对光散射特性有密切关系。 将水样和硅藻土(或白陶土)配制的浊度标准液进行比较。相当于1g一定 粘度的硅藻土(白陶土)在1000mL水中所产生的浊度,称为1度。 (二)仪器 1.100mL具塞比色管 2.1L容量瓶。 3.750mL具塞无色玻璃瓶,玻璃质量和直径均需一致。 41L量筒。 (三)试剂 浊度标准液 1、称取10g通过0.1m筛孔(150目)的硅藻土,于研钵中加入少许蒸馏 水调成糊状并研细,移至1000mL量筒中,加水至刻度。充分搅拌,静置24h, 用虹吸法仔细将上层800mL悬浮液移至第二个1000mL量筒中。向第二个量筒内 加水至1000mL,充分搅拌后再静置24h。 虹吸出上层含较细颗粒的800mL悬浮液,弃去。下部沉积物加水稀释至 1000mL。充分搅拌后贮于具塞玻璃瓶中,作为浑浊度原液。其中含硅藻土颗粒直 径大约为400μm左右。 取上述悬浊液50mL置于己恒重的蒸发皿中,在水浴上蒸干。于105℃烘箱 内烘2h,置干燥器中冷却30min,称重。重复以上操作,即,烘1h,冷却,称 重,直至恒重。求出每毫升悬浊液中含硅藻土的重量(g)。 2、吸取含250mg硅藻土的悬浊液,置于1000mL容量瓶中,加水至刻度,摇 匀。此溶液浊度为250度。 3、吸取浊度为250度的标准液100mL置于250mL容量瓶中,用水稀释至标 线,此溶液浊度为100度的标准液。 于上述原液和各标准液中加入1g氯化汞,以防菌类生长
(五)注意事项: 1.树叶、木棒、水草等杂质应先从水中除去。 2.废水粘度高时,可加 2—4 倍蒸馏水稀释,振荡均匀,待沉淀物下降后再 过滤。 3.也可采用石棉坩埚进行过滤。 三、浊度 (一)原理 浊度是表现水中悬浮物对光线透过时所发生的阻碍程度。水中含有泥土、粉 砂、微细有机物、无机物、浮游动物和其他微生物等悬浮物和胶体物都可使水样 呈现浊度。水的浊度大小不仅和水中存在颗粒物含量有关,而且和其粒径大小、 形状、颗粒表面对光散射特性有密切关系。 将水样和硅藻土(或白陶土)配制的浊度标准液进行比较。相当于 1mg 一定 粘度的硅藻土(白陶土)在 1000mL 水中所产生的浊度,称为 1 度。 (二)仪器 1.100mL 具塞比色管。 2.1L 容量瓶。 3.750mL 具塞无色玻璃瓶,玻璃质量和直径均需一致。 4.1L 量筒。 (三)试剂 浊度标准液 1、称取 10g 通过 0.1mm 筛孔(150 目)的硅藻土,于研钵中加入少许蒸馏 水调成糊状并研细,移至 1000mL 量筒中,加水至刻度。充分搅拌,静置 24h, 用虹吸法仔细将上层 800mL 悬浮液移至第二个 1000mL 量筒中。向第二个量筒内 加水至 1000mL,充分搅拌后再静置 24h。 虹吸出上层含较细颗粒的 800mL 悬浮液,弃去。下部沉积物加水稀释至 1000mL。充分搅拌后贮于具塞玻璃瓶中,作为浑浊度原液。其中含硅藻土颗粒直 径大约为 400μm 左右。 取上述悬浊液 50mL 置于已恒重的蒸发皿中,在水浴上蒸干。于 105℃烘箱 内烘 2h,置干燥器中冷却 30min,称重。重复以上操作,即,烘 1h,冷却,称 重,直至恒重。求出每毫升悬浊液中含硅藻土的重量(mg)。 2、吸取含 250mg 硅藻土的悬浊液,置于 1000mL 容量瓶中,加水至刻度,摇 匀。此溶液浊度为 250 度。 3、吸取浊度为 250 度的标准液 100mL 置于 250mL 容量瓶中,用水稀释至标 线,此溶液浊度为 100 度的标准液。 于上述原液和各标准液中加入 1g 氯化汞,以防菌类生长

(四)测定步骤 1.浊度低于10度的水样 (1)吸取浊度为100度的标准液0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、 8.0、9.0及10.0mL于100mL比色管中,加水稀释至标线,混匀。其浊度依次为 0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0度的标准液。 (2)取100mL摇匀水样置于100mL比色管中,与浊度标准液进行比较。可在 黑色底板上,由上往下垂直观察。 2.浊度为10度以上的水样 (1)吸取浊度为250度的标准液0、10、20、30、40、50、60、70、80、90 及100mL置于250mL的容量瓶中,加水稀释至标线,混匀。即得浊度为0、10、 20、30、40、50、60、70、80、90和100度的标准液,移入成套的250mL具塞 玻璃瓶中,每瓶加入1g氯化汞,以防菌类生长,密塞保存。 (2)取250mL摇匀水样,置于成套的250mL具塞玻璃瓶中,瓶后放一有黑 线的白纸作为判别标志,从瓶前向后观察,根据目标清晰程度,选出与水样产生 视觉效果相近的标准液,记下其浊度值。 (3)水样浊度超过100度时,用水稀释后测定。 计算同上
(四)测定步骤 1.浊度低于 10 度的水样 (1)吸取浊度为 100 度的标准液 0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、 8.0、9.0 及 10.0mL 于 100mL 比色管中,加水稀释至标线,混匀。其浊度依次为 0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0 度的标准液。 (2)取 100mL 摇匀水样置于 100mL 比色管中,与浊度标准液进行比较。可在 黑色底板上,由上往下垂直观察。 2.浊度为 10 度以上的水样 (1)吸取浊度为 250 度的标准液 0、10、20、30、40、50、60、70、80、90 及 100mL 置于 250mL 的容量瓶中,加水稀释至标线,混匀。即得浊度为 0、10、 20、30、40、50、60、70、80、90 和 100 度的标准液,移入成套的 250mL 具塞 玻璃瓶中,每瓶加入 1g 氯化汞,以防菌类生长,密塞保存。 (2)取 250mL 摇匀水样,置于成套的 250mL 具塞玻璃瓶中,瓶后放一有黑 线的白纸作为判别标志,从瓶前向后观察,根据目标清晰程度,选出与水样产生 视觉效果相近的标准液,记下其浊度值。 (3)水样浊度超过 100 度时,用水稀释后测定。 计算同上

实验三颜色的测定 天然和轻度污染水可用铂钴比色法测定色度,对工业有色废水常用稀释倍数 法辅以文字描述。 一、实验目的和要求 1、掌握铂钴比色法和稀释倍数法测定水和废水颜色方法,不同方法所适用范围。 2、预习第二章有关色度的内容,了解颜色测定的其它方法及各自特点。 二、铂钴比色法 水是无色透明的,当水中存在某些物质时,会表现出一定的颜色。溶解性的 有机物,部分无机离子和有色悬浮微粒均可使水着色。 H值对色度有较大的影响,在测定色度的同时,应测量溶液的p值。 (一)原理 用氯铂酸钾与氯化钻配成标准色列,与水样进行目视比色。每升水中含有 1mg铂和0.5mg钴时所具有的颜色,称为1度,作为标准色度单位。 如水样浑浊,则放置澄清,亦可用离心法或用孔径为0.45μm滤膜过滤以去 除悬浮物,但不能用滤纸过滤,因滤纸可吸附部分溶解于水的颜色 (二)仪器和试剂 1、50mL具塞比色管,其刻线高度应一致。 2、铂钴标准溶液:称取1.246g氯铂酸钾(K2PtC16)(相当于500mg铂) 及1.000g氯化钻(C0C26,0)(相当于250mg钴),溶于100mL水中,加 100mL盐酸,用水定容至1000mL。此溶液色度为500度,保存在密塞玻璃瓶中, 存放暗处。 (三)测定步臻 1、标准色列的配制:向50mL比色管中加入0、0.50、1.00、1.50、2.00、2.50 3.00、3.50、4.00、4.50、5.00、6.00及7.00mL铂钴标准溶液,用水稀释至标线, 混匀。各管的色度依次为0、5、10、15、20、25、30、35、40、45、50、60和 70度。密塞保存。 2、水样的测定 (1)分取50.0mL澄清透明水样于比色管中,如水样色度较大,可酌情少取 水样,用水稀释至50.0mL。 (2)将水样与标准色列进行目视比较。观察时,可将比色管置于白瓷板或 白纸上,使光线从管底部向上透过液柱,目光自管口垂直向下观察,记下与水样 色度相同的铂结标准色列的色度。 (四)计算
实验三 颜色的测定 天然和轻度污染水可用铂钴比色法测定色度,对工业有色废水常用稀释倍数 法辅以文字描述。 一、实验目的和要求 1、掌握铂钴比色法和稀释倍数法测定水和废水颜色方法,不同方法所适用范围。 2、预习第二章有关色度的内容,了解颜色测定的其它方法及各自特点。 二、铂钴比色法 水是无色透明的,当水中存在某些物质时,会表现出一定的颜色。溶解性的 有机物,部分无机离子和有色悬浮微粒均可使水着色。 pH 值对色度有较大的影响,在测定色度的同时,应测量溶液的 pH 值。 (一)原理 用氯铂酸钾与氯化钴配成标准色列,与水样进行目视比色。每升水中含有 1mg 铂和 0.5mg 钴时所具有的颜色,称为 1 度,作为标准色度单位。 如水样浑浊,则放置澄清,亦可用离心法或用孔径为 0.45μm 滤膜过滤以去 除悬浮物,但不能用滤纸过滤,因滤纸可吸附部分溶解于水的颜色。 (二)仪器和试剂 1、50mL 具塞比色管,其刻线高度应一致。 2、铂钴标准溶液:称取 1.246g 氯铂酸钾(K2PtC16)(相当于 500mg 铂) 及 1.000g 氯化钴(COCl2·6H2O)(相当于 250mg 钴),溶于 100mL 水中,加 100mL 盐酸,用水定容至 1000mL。此溶液色度为 500 度,保存在密塞玻璃瓶中, 存放暗处。 (三)测定步骤 1、标准色列的配制:向 50mL 比色管中加入 0、0.50、1.00、1.50、2.00、2.50、 3.00、3.50、4.00、4.50、5.00、6.00 及 7.00mL 铂钴标准溶液,用水稀释至标线, 混匀。各管的色度依次为 0、5、10、15、20、25、30、35、40、45、50、60 和 70 度。密塞保存。 2、水样的测定 (1)分取 50.0mL 澄清透明水样于比色管中,如水样色度较大,可酌情少取 水样,用水稀释至 50.0mL。 (2)将水样与标准色列进行目视比较。观察时,可将比色管置于白瓷板或 白纸上,使光线从管底部向上透过液柱,目光自管口垂直向下观察,记下与水样 色度相同的铂钴标准色列的色度。 (四)计算

色度(度)=A×50 式中:A一一稀释后水样相当于铂钴标准色列的色度: B一一水样的体积(ml)。 (五)注意事项 1、可用重铬酸钾代替氯铂酸钾配制标准色列。方法是:称取0.0437g重铬 酸钾和1.000g硫酸钻(C0S0,7H20),溶于少量水中,加入0.50mL硫酸,用 水稀释至500mL。此溶液的色度为500度。不宜久存.。 2、如果样品中有泥土或其他分散很细的悬浮物,虽经预处理而得不到透明 水样时,则只测其表色。 三、稀释倍数法 (一)原理 将有色工业废水用无色水稀释到接近无色时,记录稀释倍数,以此表示该水 样的色度。并辅以用文字描述颜色性质,如深蓝色、棕黄色等。 (二)仪器 50l具塞比色管,其标线高度要一致。 (三)测定步骤 1、取100一150mL澄清水样置烧杯中,以白色瓷板为背景,观察并描述其颜 色种类。 2、分取澄清的水样,用水稀释成不同倍数,分取50mL分别置于50mL比色 管中,管底部衬一白瓷板,由上向下观察稀释后水样的颜色,并与蒸馏水相比较, 直至刚好看不出颜色,记录此时的稀释倍数。 (四)注意事项 如测定水样的真色,应放置澄清取上清液,或用离心法去除悬浮物后测定: 如测定水样的表色,待水样中的大颗粒悬浮物沉降后,取上清液测定
式中:A——稀释后水样相当于铂钴标准色列的色度; B——水样的体积(mL)。 (五)注意事项 1、可用重铬酸钾代替氯铂酸钾配制标准色列。方法是:称取 0.0437g 重铬 酸钾和 1.000g 硫酸钴(COSO4·7H2O),溶于少量水中,加入 0.50mL 硫酸,用 水稀释至 500mL。此溶液的色度为 500 度。不宜久存。 2、如果样品中有泥土或其他分散很细的悬浮物,虽经预处理而得不到透明 水样时,则只测其表色。 三、稀释倍数法 (一)原理 将有色工业废水用无色水稀释到接近无色时,记录稀释倍数,以此表示该水 样的色度。并辅以用文字描述颜色性质,如深蓝色、棕黄色等。 (二)仪器 50mL 具塞比色管,其标线高度要一致。 (三)测定步骤 1、取 100—150mL 澄清水样置烧杯中,以白色瓷板为背景,观察并描述其颜 色种类。 2、分取澄清的水样,用水稀释成不同倍数,分取 50mL 分别置于 50mL 比色 管中,管底部衬一白瓷板,由上向下观察稀释后水样的颜色,并与蒸馏水相比较, 直至刚好看不出颜色,记录此时的稀释倍数。 (四)注意事项 如测定水样的真色,应放置澄清取上清液,或用离心法去除悬浮物后测定; 如测定水样的表色,待水样中的大颗粒悬浮物沉降后,取上清液测定

实验四碘量法测定水中溶解氧 一、实验目的 1.熟悉氧化还原滴定的基本原理。 2。掌握碘量法滴定的基本操作及标准溶液的配制及标定方法。 3.掌握碘量法测定溶解氧的基本操作规程。 二、实验原理 碘量法测定水中溶解氧是基于溶解氧的氧化性能。当水样中加入硫酸锰和碱 性KI溶液时,立即生成M血(O),沉淀。M血(O田,极不稳定,迅速与水中溶解氧化 合生成锰酸锰。在加入硫酸酸化后,己化合的溶解氧(以锰酸锰的形式存在)将 KI氧化并释放出与溶解氧量相当的游离碘。然后用硫代硫酸钠标准溶液滴定, 换算出溶解氧的含量。 此法适用于含少量还原性物质及硝酸氮<0.1mg/L、铁不大于1g/L,较为清 洁的水样。 三、实验主要仪器 1.250mL溶解氧瓶 2.25mL酸式滴定管 3.250mL锥形瓶 四、试剂 1.硫酸锰溶液:称取480gMS0·4H0,溶于蒸馏水中,过滤后稀释至1L。 (此溶液在酸性时,加入KI后,遇淀粉不变色。) 2.碱性KI溶液:称取500gNa0H溶于300~400mL蒸馏水中,称取150gKI 溶于200mL蒸馏水中,待NaOH溶液冷却后将两种溶液合并,混匀,用蒸馏水稀 释至1L。若有沉淀,则放置过夜后,倾出上层清液,储于塑料瓶中,用黑纸包 裹避光保存。 3.(1+5)硫酸溶液 4,浓疏静 5,1%淀粉溶液:称取1g可溶性淀粉,用少量水调成糊状,再用刚煮沸的 水冲稀至100mL。冷却后,加入0.1g水杨酸或0.4g氯化锌防腐。 6.0.02500mo1/L(1/6K,Cr0)重铬酸钾标准溶液:称取于105-110C烘干 2小时并冷却的K,Cr,0,0.3064g,溶于水,移入250mL容量瓶中,用水稀释至标 线,摇匀
实验四 碘量法测定水中溶解氧 一、实验目的 1.熟悉氧化还原滴定的基本原理。 2.掌握碘量法滴定的基本操作及标准溶液的配制及标定方法。 3.掌握碘量法测定溶解氧的基本操作规程。 二、实验原理 碘量法测定水中溶解氧是基于溶解氧的氧化性能。当水样中加入硫酸锰和碱 性 KI 溶液时,立即生成 Mn(OH)2沉淀。Mn(OH)2极不稳定,迅速与水中溶解氧化 合生成锰酸锰。在加入硫酸酸化后,已化合的溶解氧(以锰酸锰的形式存在)将 KI 氧化并释放出与溶解氧量相当的游离碘。然后用硫代硫酸钠标准溶液滴定, 换算出溶解氧的含量。 此法适用于含少量还原性物质及硝酸氮<0.1mg/L、铁不大于 1mg/L,较为清 洁的水样。 三、实验主要仪器 1.250mL 溶解氧瓶 2.25mL 酸式滴定管 3.250mL 锥形瓶 四、试剂 1.硫酸锰溶液:称取 480gMnSO4·4H2O,溶于蒸馏水中,过滤后稀释至 1L。 (此溶液在酸性时,加入 KI 后,遇淀粉不变色。) 2.碱性KI溶液:••称取500gNaOH溶于300~400mL蒸馏水中,••称取150gKI 溶于 200mL 蒸馏水中,待 NaOH 溶液冷却后将两种溶液合并,混匀,用蒸馏水稀 释至 1L。若有沉淀,则放置过夜后,倾出上层清液,储于塑料瓶中,用黑纸包 裹避光保存。 3.(1+5)硫酸溶液 4.浓硫酸 5.1%淀粉溶液: 称取 1g 可溶性淀粉,用少量水调成糊状,再用刚煮沸的 水冲稀至 100mL。冷却后,加入 0.1g 水杨酸或 0.4g 氯化锌防腐。 6.0.02500mol/L(1/6K2Cr2O7)重铬酸钾标准溶液:称取于 105-110℃烘干 2 小时并冷却的 K2Cr2O70.3064g,溶于水,移入 250mL 容量瓶中,用水稀释至标 线,摇匀