
试卷代号:2123 座位号■■ 中央广播电视大学2007一2008学年度第二学期“开放专科”期末考试(半开卷) 医用基础化学试题 2008年7月 题 号 一 二 三 四 五 六 总分 分数 无机及分析化学部分 得分 评卷人 一、选择题(每小题2分,共10分) l.碳酸钙的分解反应:CaCO,(s)=CaO(s)十CO2(g),其标准平衡常数表达式为() Ake=CaO]/e)(Co]/p°y ([CaCO3 ]/ce) B.Ke=pco2/p C.Ke_([CaOl/c)([pco:]/p) ([CaCO,]/ce) D.Ke[CO2]/ 2.25C,BaSO4的摩尔溶解度为1.0×10-5mol·L',则BaSO,的Kp为() A.2.0×10-1o B.5.0×10-8 C.3.0×10-5 D.1.0×10-10 3.下列分子中,中心原子采取$p不等性杂化的是() A.PH B.CH C.BCI D.BeCl2 4.在滴定分析中,化学计量点与滴定终点间的关系是( A.两者含义相同 B.两者必须吻合 C.两者互不相干 D.两者愈接近,滴定误差愈小 5.由于指示剂选择不当而造成的误差属于() A.方法误差 B.试剂误差 C.仪器误差 D.偶然误差 655
试卷代号:2123 座位号巨口 中央广播电视大学2007-2008学年度第二学期“开放专科”期末考试(半开卷) 医用基础化学 试题 2008年 7月 题 号 四 五 六 总 分 分 数 无机及分析化学部分 得 分 评卷人 一、选择题(每小题 2分,共 10分) 1.碳酸钙的分解反应 :CaC0, (s) = CaO (S) + C02 (g),其标准平衡常数表达式为( A. K8= ([Ca0]/ce)([C02]/he) (仁CaC0,]/ce) B. Ke=PC02/pe C. Ke= ([Ca0]/ce)([PCoz ]/PE) ) ([CaCO,]/ce) D. Ke [C02 I/ PE) 2.25 0C , BaSO,的摩尔溶解度为 1. 0 X 10-' mol " L-',则 BaSO;的Ksp为( A.2.OX10一‘0 B. 5. 0 X 10-' C.3.OX10一5 1).1.0X10一‘0 3.下列分子中,中心原子采取 SP 3不等性杂化的是( ) A. P H, B. CH, C. BCI, D. BeClz 4.在滴定分析中,化学计量点与滴定终点间的关系是 ( ) A.两者含义相同 B.两者必须吻合 C.两者互不相干 D.两者愈接近,滴定误差愈小 5.由于指示剂选择不当而造成的误差属于( ) A.方法误差 B.试剂误差 C.仪器误差 D.偶然误差 655

得分 评卷人 二、问答题(每题5分,共10分)】 1.将e十C+=Fe+十Cu氧化还原反应设计成原电池,分别写出他们的反应和电池符号。 2.命名[Ag(NH3)2]OH配合物,并指出中心原子、配体、配位原子和配位数。 得分 评卷人 三、计算题(每题6分,共30分)】 1.正常人血浆中每100mL含Na+0.356g,求其物质的量浓度(用mol·L1表 示)。(M(Na+)=23.0g/mol) 2.计算10.0g·L-1CaCl2溶液在37℃时的渗透压。(Mec,=111g·mol-1) 3.计算0.25mol·L1NaAc溶液的pH值。(已知K,(HAc)=1.7×10-5) 4.0.35mol·L1HAc溶液与0.45mol·L1NaAc等体积混合,计算混合溶液的pH值。 (已知K,(HAc)=1.8×10-5) 5.计算298K时Sn+/Sn2+,c(Sn4+)=2.0mol·L-1,c(Sn2+)=0.4mol·L-1电对的电 极电势。(已知2+/s2+=0.151V) 有机化学部分 得 分 评卷人 四、给下列化合物命名或写出结构式(每小题4分,共20分) 1.H,C-C-C=CH CH CH, 2. OH 3.对硝基苯乙酮 4. COOH COOH 5.N-乙基苯胺 656
得 分 评卷人 二、问答题 (每题 5分 ,共 10分 ) 将 Fe十Cu?' =Fez+十Cu氧化还原反应设计成原电池,分别写出他们的反应和电池符号。 命名〔Ag(NH,)z]OH配合物,并指出中心原子、配体、配位原子和配位数。 得 分 评卷人 三、计算题 (每题 6分,共 30分) 1.正常人血浆 中每 100mL含 Na' 0. 356g,求其 物 质的量 浓度 (用 mol " L-’表 示)。(M(Na+)=23. Og/mol) 2:计算10. Og·L-' Caclz溶液在37℃时的渗透压。(Mcecl, =111g·mol-' ) 3.计算 0. 25mol " L-' NaAc溶液的pH值。(已知 K, (HAc) =1. 7 X 10-5) 4.0.35mol " L-'HAc溶液与0. 45mol·L-' NaAc等体积混合,计算混合溶液的pH值。 (已知 K}(HAc)=1. 8X 10-5) 5.计算 298K时 Sn4+/Snz+,c(Sn")=2.0 mol " L-',c(Snz+)=0.4 mol " L-’电对的电 极电势。(已知碑4 +/S2+ =0. 151V) 有机化学部分 得 分 评卷人 四、给下列化合物命名或写出结构式(每小题 4分,共 20分} H� C- C- C- CH CH CH 3.对一硝基苯乙酮 4(工COOH 5.N一乙基苯胺 656
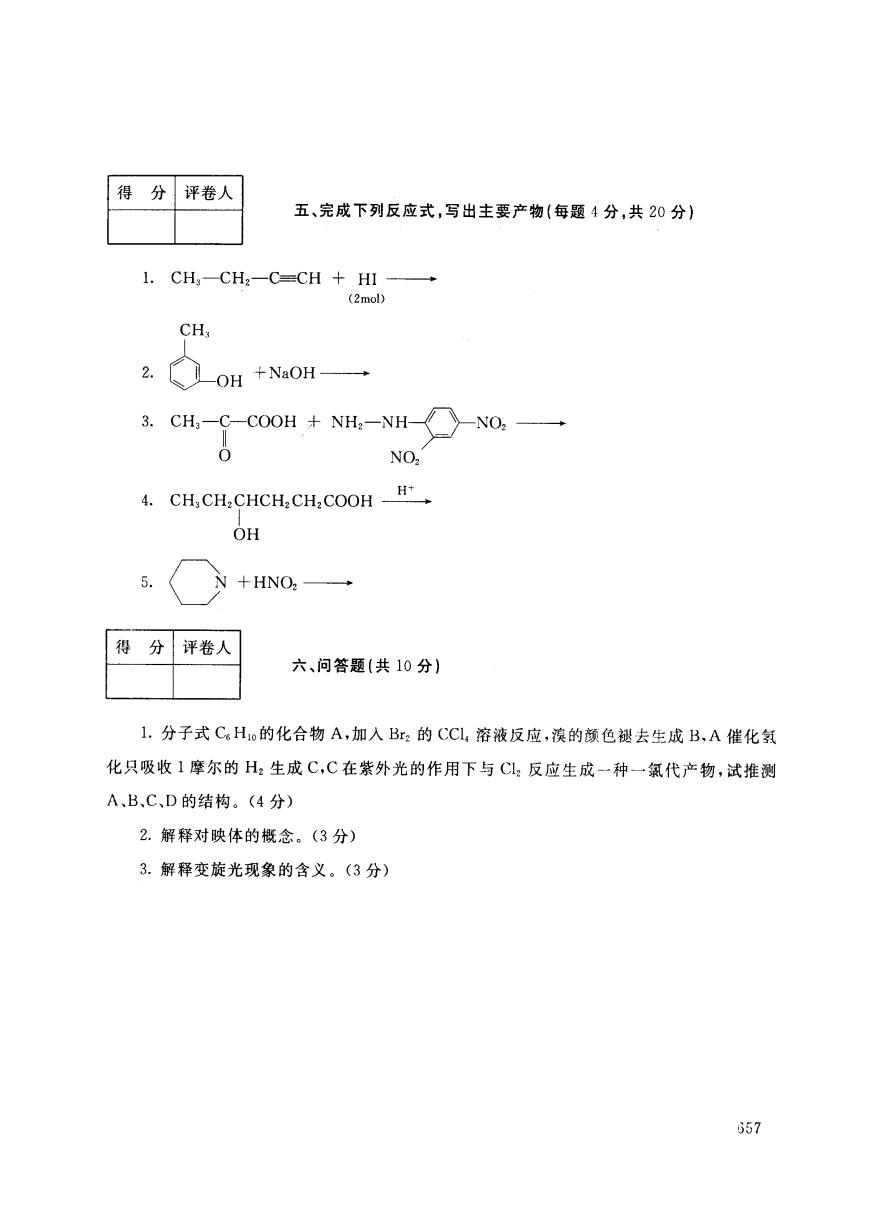
得 分 评卷人 五、完成下列反应式,写出主要产物(每题4分,共20分) 1.CH,-CH2-C=CH HI- (2mol) CH: 2. OH +NaOH→ 3.CH,-C-COOH NH2-NH- NO H+ 4.CH,CH,CHCH,CH2 COOH OH 5. +HNO2→ 得 分 评卷人 六、问答题(共10分) 1.分子式CHo的化合物A,加入Br2的CCl溶液反应,滨的颜色褪去生成B,A催化氢 化只吸收1摩尔的H2生成C,C在紫外光的作用下与C2反应生成一种一氯代产物,试推测 A、B、C、D的结构。(4分) 2.解释对映体的概念。(3分) 3.解释变旋光现象的含义。(3分) 657
得 分 评卷人 五、完成下列反应式 ,写出主要产物 (每题 4分 ,共 20分 ) CH,-CH,-C=CH + HI一 (2moU CH 2.红OH + NaOH一 3. CH,-C-000H + NH,-NH I 一7fQ 少-NOZ,一 4. CH,CH,CHCH,CHZCOOH NO, H+ OH 5.已 +HNO,一 六、问答题 (共 10分 ) 1.分子式 C, H,。的化合物 A,加入 Br:的 OOl,溶液反应,嗅的颜色褪去生成 13,A催化氢 化只吸收 1摩尔的 H:生成 C,C在紫外光的作用下与 Cl:反应生成一种一氯代产物,试推测 A,I3,C,D的结构。(4分) 解释对映体的概念。(3分) 解释变旋光现象的含义。(3分) };57

试卷代号:2123 中央广播电视大学2007一2008学年度第二学期“开放专科”期末考试(半开卷) 医用基础化学试题答案及评分标准 (供参考) 2008年7月 无机及分析化学部分 一、选择题(每小题2分,共10分) 1.B 2.D 3.B 4.D 5.A 二、问答题(每题5分,共10分) 1.正极(还原反应) Cu2++2e=Cu (1分) 负极(氧化反应)Fe-2e=Fe2+ (1分) 电池符号:(-)Fe|Fe2+(c1)ICu2+(c2)ICu(+) (3分) 2.氢氧化二氨合银(I) (1分) 中心原子Ag (1分) 配体NH, (1分) 配位原子N (1分) 配位数2 (1分) 三、计算题(每题6分,共30分) 1.解因为6Na)产-8-=0.015(mo (2分) .100mL V=1000m/元=0.10L (1分) c(Na*)=nNa*)-0.0155mo=0.155mol.L 0.100L (3分) 2.解:,CaCl2溶液的浓度c=p/M (1分) c=品=0.135(molL) (1分) CaCl2A一B2型强电解质,据渗透压公式: (1分) Ⅱ=icRT=3cRT=3×0.135×8.314×(273+37)=1010(kPa) (3分) 658
试卷代号 :2123 中央广播电视大学2007-2008学年度第二学期“开放专科”期末考试(半开卷) 医用基础化学 试题答案及评分标准 (供参考) 2008年 7月 无机及分析化学部分 一、选择题(每小题 2分,共 10分) 1. B 2. D 3. B 4. D 二、问答题 (每题 5分 ,共 10分 ) 1.正极(还原反应) Cu" -1 -2e=Cu 负极(氧化反应) Fe-2e=Fez+ 电池符号:(一)Fe I F e2+ (c, ) I I Cuz+ (C ) I CU( +) 2.氢氧化二氨合银(工) 中心原子 Ag+ 配体 NH, 配位原子 N 配位数 2 三、计算题(每题 6分,共 30分) 、, , 、, ,、,、、 m 0. 356 1.解 因 为 ,z(Na十)=二丫拼-一 =书井芋=0. 0155(mol) ~/‘”‘一’一 M (Na+) 23.0 5. A (1分) (1分) (3分) (1分) (1分) (1分) (1分) (1分) (2分) V一101000mm1L/l.一。.100L c(N二)_n(NVa兰一0. 00. 115050mLo1一。.155m。卜L-' (1分) (3分) 2.解:': Cac12溶液的浓度。=洲M 15 .’“一前一。·135(mol·L-') CaC12 A-从 型强电解质 ,据渗透压公式 : (1分 ) (1分 ) I=icRT=3cRT=3 X 0. 135 X 8. 314 X (273十37)=1010(kPa) 658 (1分) (3分)

K。1.0×1014 3.解:K,(Ac)=K.iAo=7X10=5.9X100 (1分) 0.25 :c(B)/K。=5.9义10>>500,可采用最简式: (1分) .[0H-]=√K,Xc(B)=√5.9X10-oX0.25=1.2X10-5(mol·L1) (2分) p0H=-lg[0H-]=-lg(1.2×10-5)=4.9 (1分) pH=14-p0H=9.1 (1分) 4.解:缓冲对的浓度分别为: c(HAc=0.35=0.175molL-1 2 (1分) c(Ac)=045=0.225mol.L1 2 (1分) pK。=-lgK,=-lg1.8×105=4.74 (2分) pH=k,+le3-474+1g8=474-0.11=4.63 (2分) 5.解:已知品+/sm2+=0.151V Sn++2e=Sn2+ (1分) p=p9+0.05921gSnt (2分) 2 c(Sn2+) =0.151+0-05921g024=0.172v 2 2 (3分) 有机化学部分 四、给下列化合物命名或写出结构式(每小题4分,共20分) 1.3-甲基-1-丁炔 2.邻-甲基苯酚 3.0N- C-CH 4.邻苯二甲酸 5. NHCH2 CH; 659
Kw 1. 0 X 10一14 ·解,八“CAc)一灭二(HAc)一l. 7 X 10-5一“· 9X10一10 (1分) c(B)/K、一盯5. 9 0X .2150-10>二。,可采用最简式: (1分) ·’.[OH一〕=丫Kb X c(B)= .2 X 10-5 (mol·L-1) pOH二一lg[OH一〕=一Ig(1. 2 X 10一5)=4.9 pH=14一pOH=9.1 4.解:缓冲对的浓度分别为: (2分) (1分) (1分) c(HAc)二 0. 35=0. 175 mol c(Ac- 0.45= 0. 225 mol ·L-1 ·L-1 (1分) (1分) pKe=一1gKe=一1g1. 8 X 10一5=4. 74 (2分) pH=p K.+Ig c (Ac-) -,:二二二-二.= 4 c又且Ac) .74+lg 0.225 0. 175 = 4. 74一 0. 11= 4. 63 (2分) 5.解: 已知,异+,5}2+ =0. 151V Sna+ +2e= Snz+ (1分) 、一、。+0.0n 乙59218c(Sna+) c(Sn'+) (2分) 一。.151+0. 0n 乙59218六一。 ·172(V) (3分) 有机化学部分 四、给下列化合物命名或 写出结构式 (每小题 4分 ,共 20分) .3一甲基一1一丁炔 .邻一甲基苯酚 Oz N-0-节 O CH, .邻苯二 甲酸 0--NHCH,CH, 659
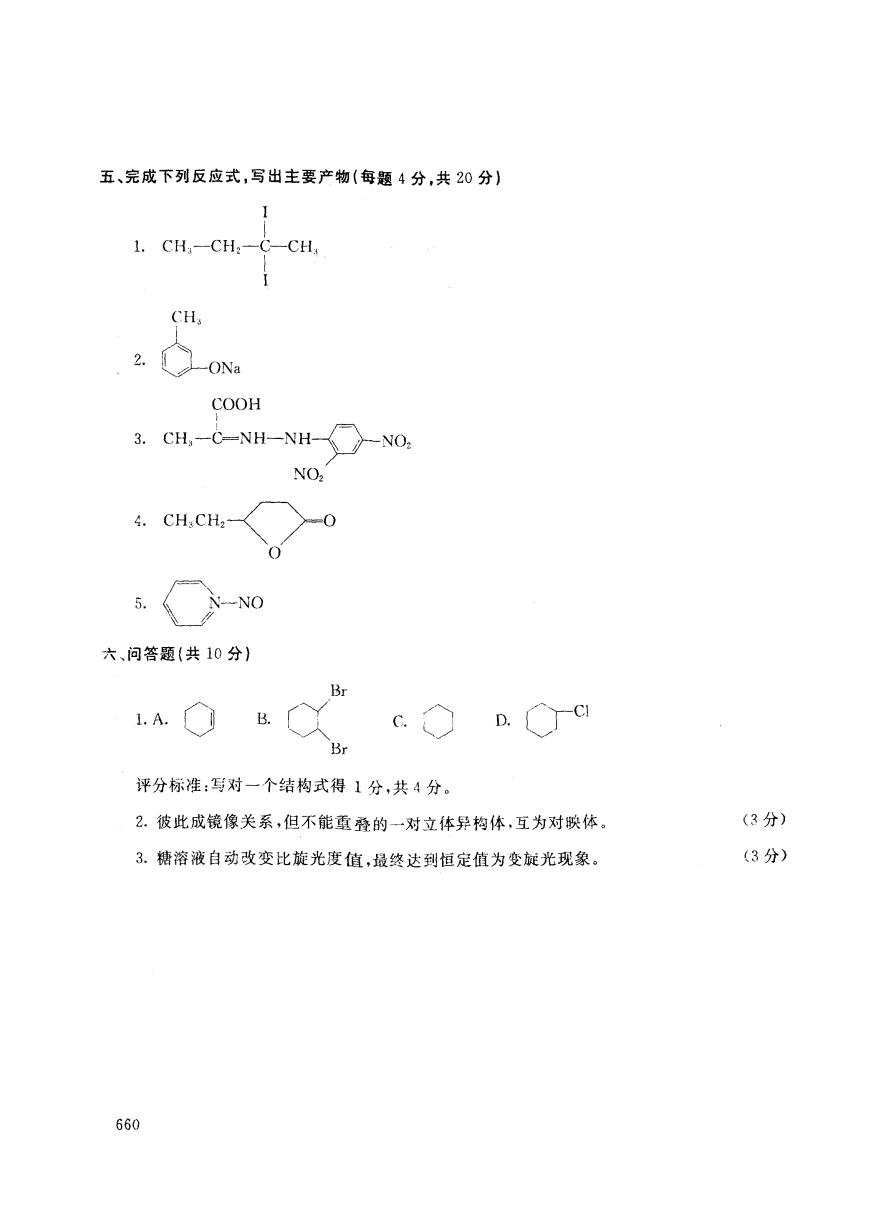
五、完成下列反应式,写出主要产物(每题4分,共20分) 1.CH,-CH2-C-CH, CH 2. -ONa COOH 3.CH,-C-NH-NH--NO: NO2 4.CH:CH2- -NO 六、问答题(共10分) 1.A. B. C. D.C Br 评分标准:写对一个结构式得1分,共4分。 2.彼此成镜像关系,但不能重叠的一对立体异构体,互为对映体。 (3分) 3.糖溶液自动改变比旋光度值,最终达到恒定值为变旋光现象。 (3分) 660
五、完成下列反应式,写出主要产物(每题 4分,共 20分) 1. CH,,- CH,-C一一CH:, CH, 。八 火少片.-ON a COOH 3. CH,-C=NH-N N H O 汤 2 一NO 4. CH,{CHZ 厂= 二 , / XX r 、:。 J· \ 上N-- 1 N V 飞一-/1 六.、问答题(共 10分) ‘/\; ,、 厂入丫 1.八. ! }] t5. { , 从\/2 \、/入 c.丫 伙卜份/ D.厂、\、/丫C1 13r 评分标准:写对一个结构式得 1分,共4分。 2.彼此成镜像关系,但不能重叠的一对立体异构体,互为对映体。 3.糖溶液自动改变比旋光度值,最终达到恒定值为变旋光现象。 (3分) r3分) 660