
试卷代号:2123 座位☐ 中央广播电视大学2008一2009学年度第二学期“开放专科”期末考试(半开卷) 医用基础化学试题 2009年7月 题号 一 二 三 四 五 六 总 分 分数 无机及分析化学部分 得分 评卷人 一、选择题(每小题2分,共10分) 1.关于催化剂,下列说法正确的是( A.催化剂可以催化△,Gm>0的反应,它可以促使不能发生的反应发生 B.催化剂可以改变平衡常数 C.催化剂参与反应,改变了反应路线,降低了活化能,因而加快了反应 D.催化剂只能催化正向反应,不催化逆向反应 2.25℃,BaS0,的摩尔溶解度为1.0×10-5mol·L-1,则BaSO4的Kp为( A.2.0×10-10 B.5.0×10-8 C.3.0×10-5 D.1.0×10-10 3.下列分子中,中心原子采取sp3不等性杂化的是( ) A.PH3 B.CH C.BCl; D.BeCl2 4.有滴定反应aA十bB一dD+eE,在化学计量点,其反应物间物质的量的关系错误的是 ( A.n(aA)=n(bB)=n(dD)=n(eE) B(A)=云(B)=(D)=(E) C.(A)a:n(A)a n(B)Bin(D)d D.an(A)=bn(B)=dn(D)=en(E) 657
试卷代号:2123 座位号口口 中央广播电视大学2008-2009学年度第二学期“开放专科”期末考试(半开卷) 医用基础化学 试题 2009年 7月 题 号 四 五 六 总 分 分 数 无机及分析化学部分 得 分 评卷人 一、选择题(每小题 2分,共 10分) 1.关于催化剂 ,下列说法正确的是( ) A.催化剂可以催化 △,G,>0的反应,它可以促使不能发生的反应发生 B,催化剂可以改变平衡常数 C.催化剂参与反应,改变了反应路线,降低了活化能,因而加快了反应 D.催化剂只能催化正向反应 ,不催化逆向反应 2. 25 0C , BaSO‘的摩尔溶解度为1. 0 X 10-' mol·L-',则BaSO‘的K,为( ) A. 2.0X10-'0 B. 5.0X10-' C. 3. 0 X 10-' D. 1. 0 X 10-'0 3.下列分子中,中心原子采取 sp,不等性杂化 的是( ) A. PH, B. CH, C. BCI, D. BeC12 4.有滴定反应 aA+bB =dD+eE,在化学计量点,其反应物间物质的量的关系错误的是 ) A. n(aA) = n(bB)= n(dD)= n(eE) 。 1 ,‘、 1 ,。、 1 ,,、 1 B.言n (A)一补(B)一护(D)一言n (E) 。 n (A) a n (A) a lam. ~~二花二丁片 二一 ;一,井二又,今 一了 九C匕夕 b ’nl曰 少 d D. an (A)=bn(B)=dn(D)二en(E) 657

5.已知准确浓度的试剂溶液称为( A.分析试剂 B.标定溶液 C.标准溶液 D.基准试剂 得分 评卷人 二、问答题(每题5分,共10分) 1.将4Cr2+十O2+4H+=4C3+十2H20氧化还原反应设计成原电池,分别写出他们的反 应和电池符号。(5分) 2.命名[Cu(NH,)4](OH)z配合物,并指出中心原子、配体、配位原子和配位数。(5分) 得 分 评卷人 三、计算题(30分) 1.将15gNaC1溶于130g水中配成溶液,计算此溶液中NaC1的质量分数。(6分) 2.计算10.0g·L-1蔗糖(CzHa01)溶液在37℃时的渗透压。(M,0.=324g·mol1) (6分) 3.计算0.15mol·L1NH,C1溶液的pH值。(已知K.(NH)=1.8×10-5)(6分) 4.0.35mol·L1HAc溶液与0.45mol·L-1NaAc等体积混合,计算混合溶液的pH值。 (已知K.(HAc)=1.8×10-3)(6分) 5.计算298K时Fe+/Fe2+,c(Fe3+)=0.1mol.L-1,c(Fe+)=0.5mol·L-1电对的电 极电势。(已知+2+=0.771V)(6分) 有机化学部分 得 分 评卷人 四、给下列化合物命名或写出结构式(每小题4分,共20分)】 1.对-羟基苯乙酮 2.H2 C-C-CH-CH2 CH; 658
5.已知准确浓度的试剂溶液称为( A.分析试剂 C.标准溶液 B.标定溶液 D.基准试剂 二、问答题(每题 5分,共 10分) 1.将4Cr'+十OZ十4H+ =4Cr,十十2H, O氧化还原反应设计成原电池,分别写出他们的反 应和电池符号。(5分) 2.命名〔Cu(NH3)4](OH)Z配合物,并指出中心原子、配体、配位原子和配位数。(5分) 得 分 评卷人 三、计算题 (30分 ) 1.将15g NaCl溶于130g水中配成溶液,计算此溶液中NaCl的质量分数。(6分) 2.计算10. Og·L-‘蔗糖(C12 H22 Oll)溶液在37℃时的渗透压。(峡2 H22 of、二324g·mol`1) (6分) 3.计算 0. 15mol " L-1 NH,Cl溶液的 pH值。(已知 Kb(NH3)=1.8X10-5)(6分) 4.。。35mol·L-l HAc溶液与0. 45mol·L-1 NaAc等体积混合,计算混合溶液的pH值。 (已知 K, (HAc)=1. 8X 10-5) (6分) 5.计算 298K时 Fe" /Fe2+,c(Fe3+)=0. 1 mol " L-1,c(Fe2+)=0.5 mol " L-‘电对的电 极电势。(已知A 3+/Fe2+ -0. 771 V) (6分) 有机化学部分 得 分 评卷人 四、给下列化合物命名或写出结构式(每小题 4分,共 20分) 1.对一经基苯乙酮 2. HZ C=C-CH=CH2 1 CH 658
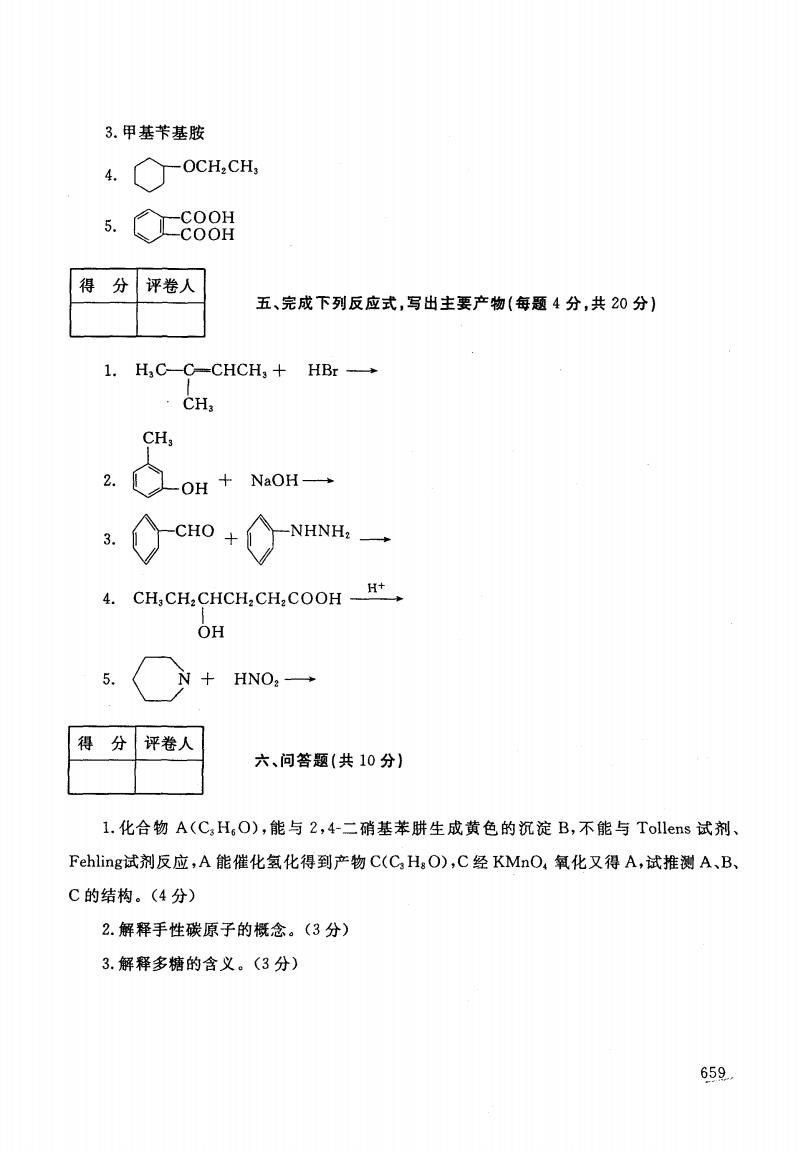
3.甲基苄基胺 4. OCH,CH, 5. -COOH -COOH 得分 评卷人 五、完成下列反应式,写出主要产物(每题4分,共20分) 1.H,C-C-CHCH,+HBr- CH, CH; 2.OH+NaOH一 .CcHo+◇NNH 4.CH,CH:CHCH:CHCOOH H+ OH 5. +HNO, 得分 评卷人 六、问答题(共10分)】 1.化合物A(CH,O),能与2,4-二硝基苯肼生成黄色的沉淀B,不能与Tollens试剂、 Fehling试剂反应,A能催化氢化得到产物C(C:HgO),C经KMnO,氧化又得A,试推测A、B、 C的结构。(4分) 2.解释手性碳原子的概念。(3分) 3.解释多糖的含义。(3分) 659
3.甲基节基胺 OCH,CH COOH COOH 得 分 评卷人 五、完成下列反应式,写出主要产物(每题 4分,共 20分) 1. H,C-C- CHCH,十 HBr一 } CH CH 2. &OH+·一 3.令CHO·合NHNH,一 4. CH,CH,CHCH,CH,COOH -里-I- } OH 5.协 +HNO 得 分 评卷人 六、问答题 (共 10分 ) 1.化合物 A(C,H,0),能与 2,4一二硝基苯脐生成黄色的沉淀 B,不能与 Tollens试剂、 Fehling试剂反应,A能催化氢化得到产物C(CH,O),C经 KMnO;氧化又得A,试推测A,B, C的结构。(4分) 2.解释手性碳原子的概念。(3分) 3.解释多糖的含义 。(3分) 659

试卷代号:2123 中央广播电视大学2008一2009学年度第二学期“开放专科”期末考试(半开卷) 医用基础化学 试题答案及评分标准 (供参考) 2009年7月 无机及分析化学部分 一、选择题(每小题2分,共10分) 1.c 2.D 3.B 4.D 5.C 二、问答题(每题5分,共10分】 1.(5分) 正极(还原反应) 02+4H++4e=2H20(1分) 负极(氧化反应)Cr+=Cr3++e(1分) 电池符号:(-)Pt|Cr2+(c1),(Cr3+(c2)1IH2O|O2(p1)Pt(+)(3分) 2.(5分) 氢氧化四氨合铜(Ⅱ)(1分),中心原子Cu+(1分),配体(1分)NH,配位原子N(1分), 配位数4(1分) 三、计算题(30分) 1.(6分) 解:m(NaCI0=15g(1分) m=130+15=145(g)(1分) 号=0.1034 (NaCl)=m(NaCI)_15 (4分) m 2.(6分) 解::蔗糖(Cn2H22O)溶液的浓度c=p/M (1分) ÷c=8=-0.0234(mol-L- )(2分) 蔗糖(C12H22O:)是非电解质,据渗透压公式: 660
试卷代号:2123 中央广播电视大学2008-2009学年度第二学期“开放专科”期末考试(半开卷) 医用基础化学 试题答案及评分标准 (供参考) 2009年 7月 无机及分析化学部分 一、选择题(每小题 2分.共 10分》 1.C 2.D 3.B 4.D 5.C 二、问答题(每题 5分,共 10分) 1. (5分) 正极(还原反应) 02+4H++4e=2H20 (1分) 负极(氧化反应) Cr2+ =Cr3+ -f- e (1分) 电池符号:(一)Pt I Cr2+ (c1 ) , (Cr 3+ (c2 )}H2O旧2(pl)IPt(+) (3分) 2.(5分) 氢氧化四氨合铜(H)(1分),中心原子Cu2+ (1分),配体(1分)NH,,配位原子N(1分), 配位数 4(1分) 三、计算题(30分) 1. (6分) 解:m(NaCI)=15g (1分) m = 130+ 15 = 145(g) (1分) cu(NaCD= m(NaCI) 力之 l5 牛 二t下.今 U, 1U}4 1住匕 2.(6分) 解:‘.’ 蔗糖(C12 H22011)溶液的浓度 。 =0. 0294(mol·L-l) (4分) =p/M (1分) (2分 ) 丝一一 342 蔗糖(Cl2 H22 Oll)是非电解质,据渗透压公式: 660

Π=cRT=0.0294×8.314×(273+37)=75.8(kPa)(3分) 3.(6分) 。Kw=1.0X10-“ 解:K,(NH)=KNH-.8X10一=5.6X100(1分) :c0NH时)/K.-65》50,可采用最筒式。1分) .[H+]=√K.XcNH)=√5.6X10X0.15=9.2×10-6(3分) pH=-lg[H+]=-lg(9.2×10-6)=5.04(1分) 4.(6分) 解:缓冲对的浓度分别为: c(HAc)=0.35=0.175mol·L-1(1分) 2 c(Ac)=0-45=0.225molL1(1分) 2 pK.=-lgK.=-lg1.8×10-5=4.74(2分) pH=pK,+le3-44+le8器-4:74-0.1-4632分) 5.计算298K时Fe3+/Fe2+,c(Fe3+)=0.1mol·L1,c(Fe2+)=0.5mol·L-1电对的电 极电势。(已知p+2+=0.771V)(6分) 解:已知4+/2+=0.771V Fe3++e=Fe2+(1分) p=9+0.05921g(Fe+) c(Fe2+) (2分) =0.71+0.05921le80.73w (3分) 有机化学部分 四、给下列化合物命名或写出结构式(每小题4分,共20分】 1.no o. 2.2-甲基-1,3-丁二烯 661
I=cRT=0. 0294 X 8. 314 X (273+37)=75.8(kPa) (3分) 3. (6分) 解 八-八~1V,? n }‘4.,夕= ;二一下K下;w 下 ;,芍= 下1产.气0万X丁了1了0刃一-1S4今 _5 八 ellvn 3) 1. is入 l ’ 6X10-'0 (1分) c(NH才)/K,= 0.15 5. 6 X 10一1o;500,可采用最简式: <1分) :’ [H+]=了K, X c(NH才)=丫5.6X10一‘0 X0.15=9.2X10-' (3分) pH二一1gEH+〕二一lg(9.2X10-')=5.04 (1分) 4.(6分) 解 :缓冲对的浓度分别为: c(HAc卜华一。 ·175mol·L-' (1分) c(A。一卜毕一。·225mol·L-' (1分) pKe=一1gK,=一1g1. 8 X 10-' =4.74 (2分) pH=pK,+lg c(Ac一) c(HAc) =4.74+lg 0.225 0.175=4. 74一0.11=4.63 (2分) 5.计算 298K时 Fe3+/Fe2+,c(Fe3+)=0. 1 mol " L-',c(Fe2+)=0. 5 mol " L-’电对 的电 极电势。(已知沐3+ /F,2+= 0. 771 V) (6分) 解:已知A3+ /Fe 2+ Fe" + e= Fe' = 0. 771V (1分) }o = lpe十0.八UJ,.v八G, lgc.下(下F丁 ee1 3+ 不戈) Clr e 少 (2分) _ ,,, ._ ___八,, 0.1 _ ,_,,,、 = U. I t l十 U.USvzllg-, = U.lSIV) v 一 口 (3分) 有机化学部分 四、给下列化合物命名或写出结构式(每小题 4分 ,共 20分 ) ‘·Ho班少犷CH, 2. 2一甲基一1,3一丁二烯 661

3.《 ○ CH2NHCH, 4.乙基环己基醚 5.邻苯二甲酸 五、完成下列反应式,写出主要产物(每题4分,共20分) Br CH,CCH.CH; CHa CH, 2. ONa 4. CH,CH2- 5. -NO 六、问答题(共10分) 1.(4分) A.CH,CCH CH B. C-NNH--No: CH, NO, C.CH,CCH OH 评分标准:A,C写对各得1分,B写对得2分,共4分。 2.(3分)连有4个不同的原子或基团的碳原子称为手性碳原子。 3.(3分)水解后能产生10个以上单糖分子的糖称多糖。 662
3. /)一 CHZNHCH 4.乙基环己基醚 5.邻苯二甲酸 五、完成下列反应式,写出主要产物(每题 4分,共 20分) Br ! 1. CH, CCH, CH, } CH, 2. II CH I ,,-.* 、、尹 卜一 viva 3.合CH= CH,CH, -< O 卜.0 必-NO 六、问答题(共 10分 ) 1.(4分) A. CH,CCH }} C- NN N H O 7Q-NO, \ / H H C C B. C. CH, CCH, ! OH 评分标准:A,C写对各得 1分,B写对得 2分,共 4分。 2.0分)连有 4个不同的原子或基团的碳原子称为手性碳原子。 3.0分)水解后能产生 10个以上单糖分子的糖称多糖。 662