
实验二、小麦氮素含量的测定一SPAD与铜镉还原柱法 (综合性实验) 一原理 作物体内的含氢量约为作物干物质重的03%5%,含量的高低因作物种类、器官类型、生有时期不 同而异。在一定的施氮水平下,植株中的含氮量、可溶性氮的含量,均随氮肥用量的增加而提高。由于 溶液培养其元素的种类和数量可以控制,因此要了解氨素的数量对植物生长发有的影响时,可有意识地 配制不同水平氯素的培养液,根据植物的生长发育情况及症状,了解其影响。收获后,通过测定植株中 的养分含量,了解养分在植物体中的氨素累积情况。 二材料料、仪器及药品 1、材料准备 小麦幼苗于实验前15天左右砂培有苗。 2、仪器 天平、铜镉还原柱、SPAD 10ml刻度吸管、1000ml量筒、培养箱、移液器、试剂瓶、容量瓶 3、药品 (1)Ca(NOs)z4H2O.(2)KNO3,(3 )KH2PO4,(4)KSO4,(5)CaClz,(6)NaH2PO4,(7)NH4NO3,(8)KCI (9) FeS047H0,(10)EDTA-Na,(1)HB0,(12)Cus045H0,(13)Mns0r4H0,(14)ZnS047H0, (15NH4MoO4HO。(16)MgSOr7HO(17)NHC1(18)(C6 HsN2OS)黄胺(19)N-1蔡基乙二 胺二盐酸盐C12Hl4N22HC(20)硝酸钾(21)氯化钾(KC) 4、试剂 浸提剂:称取化学纯氯化钠58.5克放入烧杯中,加入约500毫升蒸馏水溶解,用小量筒准确量取21毫 升浓盐酸倒入烧杯中,搅匀,移入量筒中,用蒸馏水稀释至1000毫升。 浓氯化铵溶液:秣取100g氯化铵溶于水中,稀释至500mL。 稀氯化铵溶液:吸取50mL浓氯化铵溶液用去离子水稀释至2L。 重氮化试剂:称取0.5g磺胺(C6HgNO2S)溶于100ml盐酸[c(HC1)=2.4molL-1]中,储存于4℃的冰 箱中。 偶合试剂:称取0.3gN1萘基-乙二胺二盐酸盐[C12H14N22HC,化学纯]溶于100ml盐酸溶液[c(HC -0.12m0l-L-11,储存于棕色瓶,放于冰箱(4℃)中。 硝态氮标准溶液[p(N)=2.00mgL:称取0.360%硝酸钾(分析纯)溶于去离子水中,洗入容量瓶后 定溶至1L,储存于冰箱中,此溶液每升含硝态氨50.0mg。使用前将其用氯化钾溶液稀释25倍,配成硝 态氮的标准溶液p(N)2mgL1备用。 氯化钾溶液[c(KC)=2molL-1:称取149.1g氯化钾溶于水,稀释至1L 三、实验处理设引 分4个处理: 处理一:不加氨+其它养分(以一N表示) 处理二:加12剂量氮+其它养分(以12N表示) 处理三:加1剂量氨+其它养分(以1N表示) 处理四:加2剂量氮+其它养分(以2N表示) 四、实验过程 (一)不同氮素水平的麦苗培养
实验二、小麦氮素含量的测定- SPAD 与铜镉还原柱法 (综合性实验) 一. 原理 作物体内的含氮量约为作物干物质重的 0.3%~5%,含量的高低因作物种类、器官类型、生育时期不 同而异。在一定的施氮水平下,植株中的含氮量、可溶性氮的含量,均随氮肥用量的增加而提高。由于 溶液培养其元素的种类和数量可以控制,因此要了解氮素的数量对植物生长发育的影响时,可有意识地 配制不同水平氮素的培养液,根据植物的生长发育情况及症状,了解其影响。收获后,通过测定植株中 的养分含量,了解养分在植物体中的氮素累积情况。 二. 材料料、仪器及药品 1、材料准备 小麦幼苗于实验前 15 天左右砂培育苗。 2、仪器 天平、铜镉还原柱、SPAD 10ml 刻度吸管、1000ml 量筒、培养箱、移液器、试剂瓶、容量瓶 3、药品 (1)Ca(NO3)2∙4H2O, (2)KNO3, (3 )KH2PO4, (4) K2SO4, (5) CaCl2, (6) NaH2PO4, (7) NH4NO3, (8) KCl (9) FeSO4•7H2O, (10) EDTA-Na2, (11) H3BO3, (12) CuSO4∙5H2O, (13) MnSO4∙4H2O, (14) ZnSO4∙7H2O, (15)(NH4)6Mo7O24∙4H2O。(16)MgSO4∙7H2O(17)NH4Cl(18)(C6H8N2O2S)磺胺(19)N-1 萘基-乙二 胺二盐酸盐[C12H14N2·2HCl](20)硝酸钾(21)氯化钾(KCl) 4、试剂 浸提剂:称取化学纯氯化钠 58.5 克放入烧杯中,加入约 500 毫升蒸馏水溶解,用小量筒准确量取 2.1 毫 升浓盐酸倒入烧杯中,搅匀,移入量筒中,用蒸馏水稀释至 1000 毫升。 浓氯化铵溶液:秣取 100g 氯化铵溶于水中,稀释至 500mL。 稀氯化铵溶液:吸取 50mL 浓氯化铵溶液用去离子水稀释至 2L。 重氮化试剂:称取 0.5g 磺胺(C6H8N2O2S)溶于 100ml 盐酸[c(HCl)=2.4mol·L-1]中,储存于 4℃的冰 箱中。 偶合试剂:称取 0.3gN-1 萘基-乙二胺二盐酸盐[C12H14N2·2HCl,化学纯]溶于 100ml 盐酸溶液[c(HCl) =0.12 mol·L-1],储存于棕色瓶,放于冰箱(4℃)中。 硝态氮标准溶液[ρ(N)=2.00mg·L-1]:称取 0.3609g 硝酸钾(分析纯)溶于去离子水中,洗入容量瓶后 定溶至 1L,储存于冰箱中,此溶液每升含硝态氮 50.0mg。使用前将其用氯化钾溶液稀释 25 倍,配成硝 态氮的标准溶液 ρ(N)2mg·L-1 备用。 氯化钾溶液[c(KCl)=2mol·L-1]:称取 149.1g 氯化钾溶于水,稀释至 1L。 三、实验处理设计 分 4 个处理: 处理一:不加氮+其它养分(以—N 表示) 处理二:加 1/2 剂量氮+其它养分(以 1/2N 表示) 处理三:加 1 剂量氮+其它养分(以 1N 表示) 处理四:加 2 剂量氮+其它养分(以 2N 表示) 四、实验过程 (一) 不同氮素水平的麦苗培养
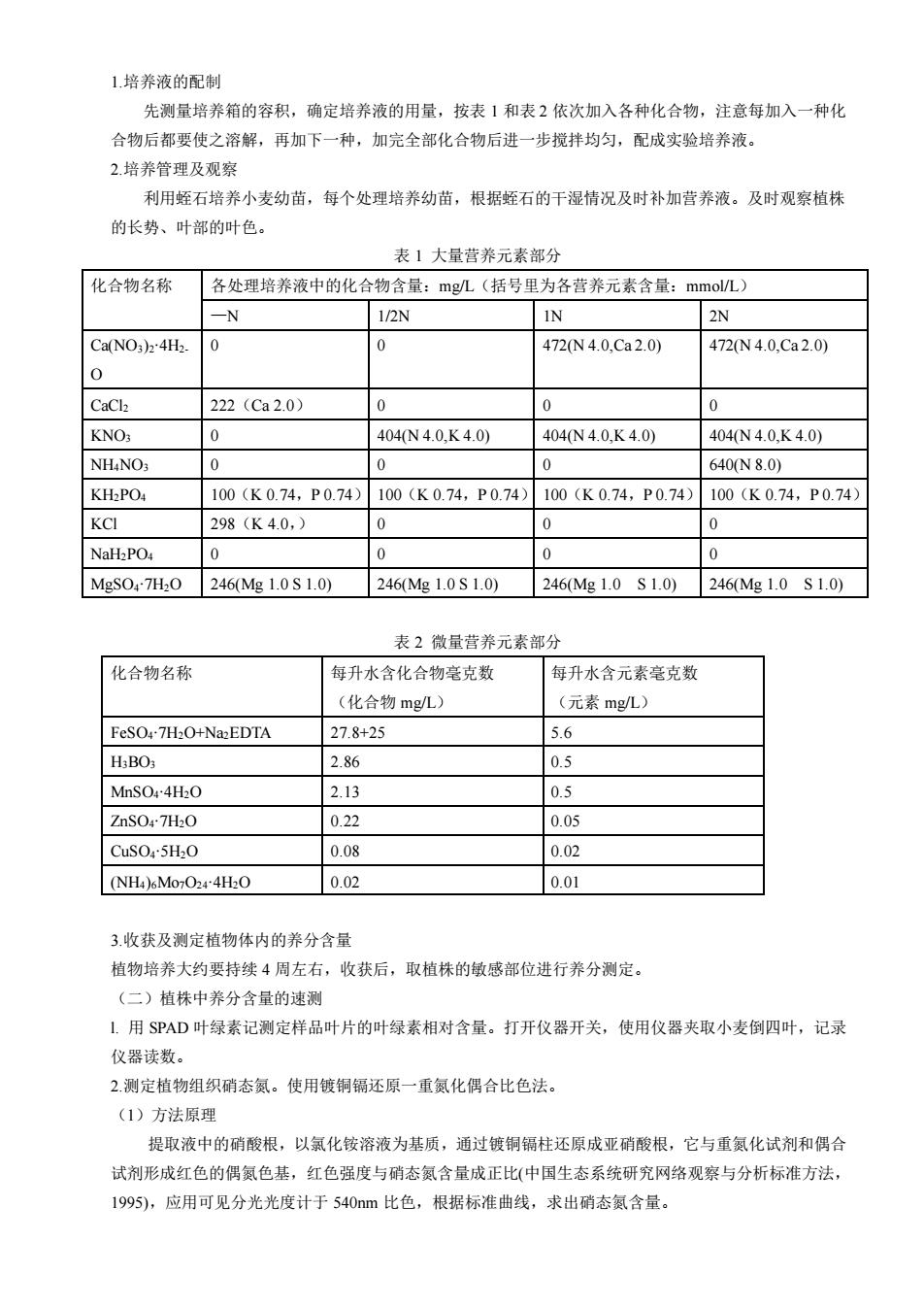
1培养液的配制 先测量培养箱的容积,确定培养液的用量,按表1和表2依次加入各种化合物,注意每加入一种化 合物后都要使之溶解,再加下一种,加完全部化合物后进一步搅拌均匀,配成实验培养液。 2.培养管理及观察 利用蛭石培养小麦幼苗,每个处理培养幼苗,根据蛭石的干湿情况及时补加营养液。及时观察植株 的长势、叶部的叶色 表1大量营养元素部分 化合物名称 各处理培养液中的化合物含量:mgL(括号里为各营养元素含量:mmo/L) 12N 2N Ca(NO3)z4H2. 0 472N4.0,Ca2.0) 472N4.0,Ca2.0) 222(C320) KNOs 0 404N4.0,K4.0) 404N4.0.K4.0) 404N4.0.K4.0) NH4NOs 0 0 640N8.0) KH:PO. 100(K0.74,P0.74)100(K0.74,P0.74) 100(K0.74,P0.74)100(K0.74,P0.74) KCI 298(K4.0,) 0 0 0 NaHzPO4 0 0 246(Mg1.0S1.0) 246(Mg1.0S1.0) 246Mg1.0S1.0)246Mg1.0S1.0) 表2微量营养元素部分 化合物名称 每升水含化合物毫克数 每升水含元素毫克数 (化合物m1) (元素mgL) FeSO47H2O+NaEDTA 27.8+25 5.6 H:BOs 2.86 0.5 MnSO4H-O 2.13 05 ZnSO47H2O 0.22 0.05 CuSO.5H-O 0.08 0.02 0.02 0.01 3.收获及测定植物体内的养分含量 植物培养大约要持续4周左右,收获后,取植株的敏感部位进行养分测定。 (二)植株中养分含量的速测 1.用SPAD叶绿素记测定样品叶片的叶绿素相对含量。打开仪器开关,使用仪器夹取小麦倒四叶,记录 仪器读数。 2.测定植物组织硝态氮。使用镀铜镉还原一重氮化偶合比色法。 (1)方法原理 提取液中的硝酸根,以氯化铵溶液为基质,通过镀铜镉柱还原成亚硝酸根,它与重氮化试剂和偶合 试剂形成红色的偶氮色基,红色强度与硝态氮含量成正比(中国生态系统研究网络观察与分析标淮方法 1995),应用可见分光光度计于540m比色,根据标准曲线,求出硝态氨含量
1.培养液的配制 先测量培养箱的容积,确定培养液的用量,按表 1 和表 2 依次加入各种化合物,注意每加入一种化 合物后都要使之溶解,再加下一种,加完全部化合物后进一步搅拌均匀,配成实验培养液。 2.培养管理及观察 利用蛭石培养小麦幼苗,每个处理培养幼苗,根据蛭石的干湿情况及时补加营养液。及时观察植株 的长势、叶部的叶色。 表 1 大量营养元素部分 化合物名称 各处理培养液中的化合物含量:mg/L(括号里为各营养元素含量:mmol/L) —N 1/2N 1N 2N Ca(NO3)2∙4H2- O 0 0 472(N 4.0,Ca 2.0) 472(N 4.0,Ca 2.0) CaCl2 222(Ca 2.0) 0 0 0 KNO3 0 404(N 4.0,K 4.0) 404(N 4.0,K 4.0) 404(N 4.0,K 4.0) NH4NO3 0 0 0 640(N 8.0) KH2PO4 100(K 0.74,P 0.74) 100(K 0.74,P 0.74) 100(K 0.74,P 0.74) 100(K 0.74,P 0.74) KCl 298(K 4.0,) 0 0 0 NaH2PO4 0 0 0 0 MgSO4∙7H2O 246(Mg 1.0 S 1.0) 246(Mg 1.0 S 1.0) 246(Mg 1.0 S 1.0) 246(Mg 1.0 S 1.0) 表 2 微量营养元素部分 化合物名称 每升水含化合物毫克数 (化合物 mg/L) 每升水含元素毫克数 (元素 mg/L) FeSO4∙7H2O+Na2EDTA 27.8+25 5.6 H3BO3 2.86 0.5 MnSO4∙4H2O 2.13 0.5 ZnSO4∙7H2O 0.22 0.05 CuSO4∙5H2O 0.08 0.02 (NH4)6Mo7O24∙4H2O 0.02 0.01 3.收获及测定植物体内的养分含量 植物培养大约要持续 4 周左右,收获后,取植株的敏感部位进行养分测定。 (二)植株中养分含量的速测 l. 用 SPAD 叶绿素记测定样品叶片的叶绿素相对含量。打开仪器开关,使用仪器夹取小麦倒四叶,记录 仪器读数。 2.测定植物组织硝态氮。使用镀铜镉还原一重氮化偶合比色法。 (1)方法原理 提取液中的硝酸根,以氯化铵溶液为基质,通过镀铜镉柱还原成亚硝酸根,它与重氮化试剂和偶合 试剂形成红色的偶氮色基,红色强度与硝态氮含量成正比(中国生态系统研究网络观察与分析标准方法, 1995),应用可见分光光度计于 540nm 比色,根据标准曲线,求出硝态氮含量

(2)作物样品的采集 ①采样要有代表性 进行作物化学诊断,只能选取一定数量来测定,用以反映一块田或一片田的作物生长情况。因此选 取测定的作物必须是具有代表性的、一定数量的样品。采样时应先在田头观察作物的生长情况,如长势 长相比较均匀一致,一般随机多点采取10一20株样品:如不一致的,取样的数量就应增多。 ②采样要取敏感部位 取整株作物讲行分析是没有必要的。因为作物的各种组织和器官内,含有的节养成分和数量有很大 差异:即使是同一种器官,在不同的生有期中,其养分含量也会不同。经过大量实践证明,宜选取作物 的敏感部位进行测定。 什么叫敏感部位呢?植株中最能灵敏反映被诊元素丰缺程度的部位,称为敏感部位。例如,我们对 、磷、钾等可移动元素的测定 一般认为用幼叶是测不出差别来的,因为士壤中这些元素虽然缺乏, 但作物本身首先保证幼叶的需要,把这些元素从老叶移动到幼叶中来。而老叶则不同,当这些元素供应 不充足时,其中的含量就会迅速下降。因此,我们选择敏感部位进行测定,不同作物的敏感部位如下: 水稻:诊断氮素营养水平(淀粉一碘试法)用心叶往下数第二片叶的叶鞘:诊断磷,钾营养水平用整株 的叶鞘。 小麦:诊断氨、磷、钾水平都用心叶往下数第三至四片叶中脉下半段。 玉米:幼苗用整株的叶鞘下半段:抽雄后用果穗对应的叶片中脉下半段。 叶柄明显的作物(如番茄、木薯、马铃薯、油菜、番薯、桑树等),诊断氨、磷、钾营养水平都用中部叶 片的叶柄。如作物有10片叶时,取心叶往下数第5一6片叶的叶柄:如作物有6片叶,则取心叶往下数 第3~4片叶的叶柄。如此类推。 ③采样时间 作物体内的养分含量在一天之内变化很大。以硝态氮为例,清晨作物体内游离的硝态氮较多,这是 因为硝态氨还原同化过程中,需要阳光和碳水化合物作为能源。因此一般认为硝态氨测定的灵敏时间在 清晨。其它养分的变化虽不及硝态氮,但一般也以上午采样较适宜。当然,互相比较的样品必须在同 时间内采集,否则就失去比较的意义。 ④采样时期 采样诊断也要注意到不同的生育期。因为作物体内养分的含量会随生有期而变化 “般生育初期体 内养分会高于生有中、后期,这样,不同生有期的养分分级标准就有异,不应拿早期分级标准套到中后 期去应用,所以采样时应注明生育期,以供研究参考。 3.作物样品的处理与作物养分待测液的制备 (1)作物样品的处理方法 进行作物诊断的样品,一般要求在田间测定。如不在田间测定,则要尽快带回室内,带回室内用的 样品要注意防止水分蒸发所造成的误差。小株作物如水稻,可将其根放在盛少量水的塑料袋中并扎紧袋 口:株型大的作物可采取特定的敏感部位样品用湿布包好。采回的样品应立即测定,一般在采样后2小 时内完成,否则作物死亡过程中,有部分有机物会分解而造成误差。特别是测定无机磷,一定要用新鲜 样品,因为有机磷在植物死亡过程中会迅速矿质化。 (2)作物养分待测液的制备 样品经上述处理后,用干净剪刀将数株作物样品特定部位剪下剪成小段,在研钵中磨烂,然后用角 匙把原汁液压出备用。 测定硝态氨和磷是用稀释了的植物汁液进行测定:测定钾是用原汁液测定
(2) 作物样品的采集 ①采样要有代表性 进行作物化学诊断,只能选取一定数量来测定,用以反映一块田或一片田的作物生长情况。因此选 取测定的作物必须是具有代表性的、一定数量的样品。采样时应先在田头观察作物的生长情况,如长势 长相比较均匀一致,一般随机多点采取 10~20 株样品;如不一致的,取样的数量就应增多。 ②采样要取敏感部位 取整株作物进行分析是没有必要的。因为作物的各种组织和器官内,含有的营养成分和数量有很大 差异;即使是同一种器官,在不同的生育期中,其养分含量也会不同。经过大量实践证明,宜选取作物 的敏感部位进行测定。 什么叫敏感部位呢?植株中最能灵敏反映被诊元素丰缺程度的部位,称为敏感部位。例如,我们对 氮、磷、钾等可移动元素的测定,一般认为用幼叶是测不出差别来的,因为土壤中这些元素虽然缺乏, 但作物本身首先保证幼叶的需要,把这些元素从老叶移动到幼叶中来。而老叶则不同,当这些元素供应 不充足时,其中的含量就会迅速下降。因此,我们选择敏感部位进行测定,不同作物的敏感部位如下: 水稻:诊断氮素营养水平(淀粉-碘试法)用心叶往下数第二片叶的叶鞘;诊断磷,钾营养水平用整株 的叶鞘。 小麦:诊断氮、磷、钾水平都用心叶往下数第三至四片叶中脉下半段。 玉米:幼苗用整株的叶鞘下半段;抽雄后用果穗对应的叶片中脉下半段。 叶柄明显的作物(如番茄、木薯、马铃薯、油菜、番薯、桑树等),诊断氮、磷、钾营养水平都用中部叶 片的叶柄。如作物有 10 片叶时,取心叶往下数第 5~6 片叶的叶柄;如作物有 6 片叶,则取心叶往下数 第 3~4 片叶的叶柄。如此类推。 ③采样时间 作物体内的养分含量在一天之内变化很大。以硝态氮为例,清晨作物体内游离的硝态氮较多,这是 因为硝态氮还原同化过程中,需要阳光和碳水化合物作为能源。因此一般认为硝态氮测定的灵敏时间在 清晨。其它养分的变化虽不及硝态氮,但一般也以上午采样较适宜。当然,互相比较的样品必须在同一 时间内采集,否则就失去比较的意义。 ④采样时期 采样诊断也要注意到不同的生育期。因为作物体内养分的含量会随生育期而变化。一般生育初期体 内养分会高于生育中、后期,这样,不同生育期的养分分级标准就有异,不应拿早期分级标准套到中后 期去应用,所以采样时应注明生育期,以供研究参考。 3. 作物样品的处理与作物养分待测液的制备 (1)作物样品的处理方法 进行作物诊断的样品,一般要求在田间测定。如不在田间测定,则要尽快带回室内,带回室内用的 样品要注意防止水分蒸发所造成的误差。小株作物如水稻,可将其根放在盛少量水的塑料袋中并扎紧袋 口;株型大的作物可采取特定的敏感部位样品用湿布包好。采回的样品应立即测定,一般在采样后 2 小 时内完成,否则作物死亡过程中,有部分有机物会分解而造成误差。特别是测定无机磷,一定要用新鲜 样品,因为有机磷在植物死亡过程中会迅速矿质化。 (2)作物养分待测液的制备 样品经上述处理后,用干净剪刀将数株作物样品特定部位剪下剪成小段,在研钵中磨烂,然后用角 匙把原汁液压出备用。 测定硝态氮和磷是用稀释了的植物汁液进行测定;测定钾是用原汁液测定

4早作物组织中硝态氯的测定 作物吸收氨态氮后会迅速同化,因此正常的作物体内测不出氨态氮。硝态氮虽也会迅速同化,但仍 有一部分存在于作物输导系统的汁液中,因此除水稻和木本植物等以外,一般可以检测出一定量的硝态 氨。其浓度在一定范围内可反映当时土壤供氨状况及作物体内的氨素营养水平。 (1)提取液的制备 ①压汁钳榨汁法 将新采集的样品(田间速测,一般从采集到测定不超过12小时),用湿布擦净,用干净剪刀剪成 大小不超过1-2毫米的小碎片,放入压汁钳中压出汁液,量取1mL,稀释于100mL容量瓶(待测提取液。 ②作物组织浸出液法 ①将田间新采集的样品组织,用湿布擦净,用干净剪刀剪成大小不超过1-2毫米的小碎片。 ②混匀后称取0.5克,放入小三角瓶或在试管中,加蒸馏水20毫升,塞紧,用力上下摇动1分钟 (200次J分),静置片刻即可吸取浸出液速测。如果溶液浑浊,应先过滤,再测定。浸出液不要放置太 久,应在2-3小时内测定,(此浸出液可同时用以测定无机磷和钾)。 此浸出液稀释倍数为40,如果粗测结果浓度过高,还要稀释更大的倍数。稀释倍数根据粗测结果 来定。 (3)制备镀铜镉还原柱 将玻璃棉放入还原柱的下端(活塞之上),注入稀氯化铵溶液,使内径为1cm、长为300cm的玻璃管 中充满,再倒人镀铜镉颗粒,其厚度为20cm。除去镀铜镉柱中所有气泡之后,排出多余的氯化铵溶液, 然后用10倍于镀铜镉孔隙体积量的稀氯化铵溶液,以大约8mLm的流速洗还柱。还愿柱不使用时,镀 铜镉金属上应保持至少lcml厚的氯化铵溶液。 (4)硝酸根还原成亚硝酸根将柱中的稀氯化铵溶液排出一部分,使液面与镀铜填料表面相平。吸取1ml 浓氯化铵溶液于柱表面,加入2ml的提取液(其含量应低于20ugNO-N)将橡皮塞塞紧150ml三角瓶, 开启活塞,使提取液进入还原柱中,在加入75ml稀氯化铵溶液,调节减压装置和活塞开关位置,使其 以110 mL min的流速通过还原柱。全部流出液收集在150ml三角瓶中。当液面降到镀铜铬表面时,关闭 活塞,取下三角瓶。 (5)比色:将流出液转入100mL容量瓶,加入2mL重氮化试剂于上述容量瓶中,混合,5min后加入 2ml偶合试剂,混合,稀释定容至刻度。20min后用1cm比色杯在光电比色计540nm波长处比色,以试 剂空白为对照,测定样品溶液的吸光度。 (6)工作曲线:吸取0.00ml,200ml,4.00ml,6.00ml,8.00ml,10.00mlNO-N标准溶液分别加入还原 柱中,按样品同样方法进行还原和比色测定。 五、结果计算 (1)硝酸盐含量的计算 0 (N)=pxVxts/v o(N)- 一硝态氮(NOs一N)的质量分数,mgkg-1: p——显色液硝态氮NO3一N的质量浓度mgkg-l: V一一比色时定容体积,mL: T——稀释倍数: V一一加入还原柱的提取液体积mL 参考指标: (1)蔬菜硝酸盐含量评价。对于食用蔬菜,一般各类蔬菜硝酸盐的平均含量的控制指标应低于1080
4. 旱作物组织中硝态氮的测定 作物吸收氨态氮后会迅速同化,因此正常的作物体内测不出氨态氮。硝态氮虽也会迅速同化,但仍 有一部分存在于作物输导系统的汁液中,因此除水稻和木本植物等以外,一般可以检测出一定量的硝态 氮。其浓度在一定范围内可反映当时土壤供氮状况及作物体内的氮素营养水平。 (1)提取液的制备 ①压汁钳榨汁法 将新采集的样品(田间速测,一般从采集到测定不超过 1-2 小时),用湿布擦净,用干净剪刀剪成 大小不超过 1-2 毫米的小碎片,放入压汁钳中压出汁液,量取 l mL,稀释于 100mL 容量瓶(待测提取液)。 ②作物组织浸出液法 ①将田间新采集的样品组织,用湿布擦净,用干净剪刀剪成大小不超过 1-2 毫米的小碎片。 ②混匀后称取 0.5 克,放入小三角瓶或在试管中,加蒸馏水 20 毫升,塞紧,用力上下摇动 1 分钟 (200 次/分),静置片刻即可吸取浸出液速测。如果溶液浑浊,应先过滤,再测定。浸出液不要放置太 久,应在 2-3 小时内测定,(此浸出液可同时用以测定无机磷和钾)。 此浸出液稀释倍数为 40,如果粗测结果浓度过高,还要稀释更大的倍数。稀释倍数根据粗测结果 来定。 (3)制备镀铜镉还原柱 将玻璃棉放入还原柱的下端(活塞之上),注入稀氯化铵溶液,使内径为 1cm、长为 300cm 的玻璃管 中充满,再倒人镀铜镉颗粒,其厚度为 20cm。除去镀铜镉柱中所有气泡之后,排出多余的氯化铵溶液, 然后用 10 倍于镀铜镉孔隙体积量的稀氯化铵溶液,以大约 8mLmin 的流速洗还柱。还愿柱不使用时,镀 铜镉金属上应保持至少 1cml 厚的氯化铵溶液。 (4)硝酸根还原成亚硝酸根 将柱中的稀氯化铵溶液排出一部分,使液面与镀铜填料表面相平。吸取 1ml 浓氯化铵溶液于柱表面,加入 2ml 的提取液(其含量应低于 20μgNO3-N).将橡皮塞塞紧 150ml 三角瓶, 开启活塞,使提取液进入还原柱中,在加入 75ml 稀氯化铵溶液,调节减压装置和活塞开关位置,使其 以 110mL·min 的流速通过还原柱。全部流出液收集在 150ml 三角瓶中。当液面降到镀铜铬表面时,关闭 活塞,取下三角瓶。 (5)比色:将流出液转入 100mL 容量瓶,加入 2mL 重氮化试剂于上述容量瓶中,混合,5min 后加入 2ml 偶合试剂,混合,稀释定容至刻度。20min 后用 1cm 比色杯在光电比色计 540nm 波长处比色,以试 剂空白为对照,测定样品溶液的吸光度。 (6)工作曲线:吸取 0.00ml,2.00ml,4.00ml,6.00ml,8.00ml,10.00mlNO3-N 标准溶液分别加入还原 柱中,按样品同样方法进行还原和比色测定。 五、结果计算 (1)硝酸盐含量的计算 ω(N)=ρ×V×ts/v ω(N)——硝态氮(NO3-—N)的质量分数,mg·kg-1; ρ——显色液硝态氮 NO3—N 的质量浓度 mg·kg-1; V——比色时定容体积,mL; Ts——稀释倍数; V——加入还原柱的提取液体积 mL。 参考指标: (1)蔬菜硝酸盐含量评价。对于食用蔬菜,一般各类蔬菜硝酸盐的平均含量的控制指标应低于 1080
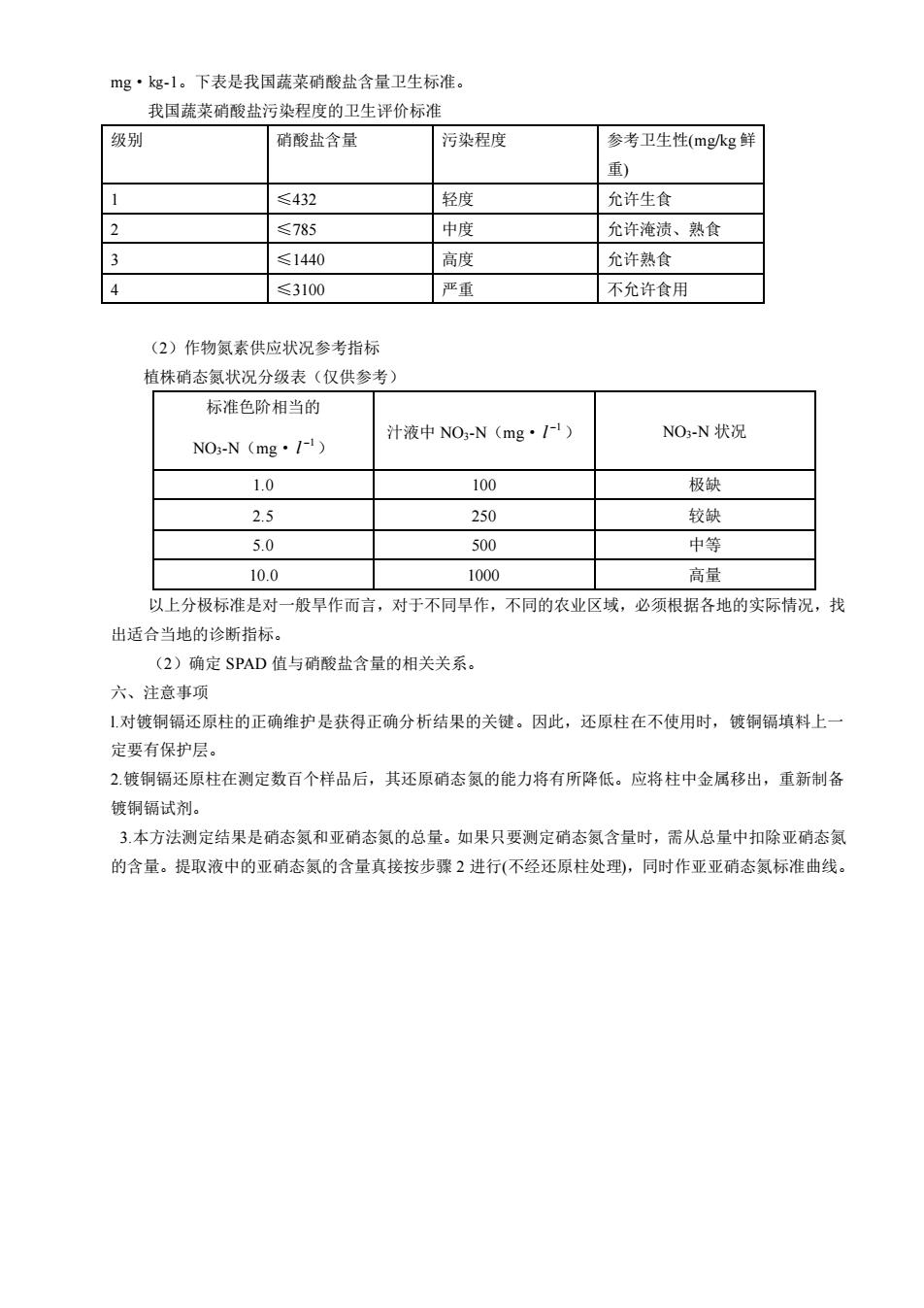
mg·kg-1。下表是我国蔬菜硝酸盐含量卫生标准。 我国蔬菜硝酸盐污染程度的卫生评价标准 级别 硝酸盐含量 污染程度 参考卫生性(mgkg鲜 重) ≤432 轻度 允许生食 ≤785 中度 允许淹渍、熟食 ≤1440 高度 允许熟食 ≤3100 亚重 不允许食用 (2)作物氮素供应状况参考指标 植株硝态氮状况分级表(仅供参考) 标准色阶相当的 汁液中NO-N(mg·P) NO-N状况 NO-N(mg·I) 1.0 100 极缺 2.5 250 较缺 5.0 500 中等 10.0 1000 高量 以上分极标准是对一般早作而言,对于不同早作,不同的农业区域,必须根据各地的实际情况,找 出适合当地的诊断指标。 (2)确定SPAD值与硝酸盐含量的相关关系。 六、注意事项 !对镀铜镉还原柱的正确维护是获得正确分析结果的关键。因此,还原柱在不使用时,镀铜镉填料上一 定要有保护层。 2镀铜镉还原柱在测定数百个样品后,其还原硝态氯的能力将有所降低。应将柱中金属移出,重新制备 镀钥镉试剂。 3本方法测定结果是硝态氨和亚硝态氨的总量。如果只要测定硝态氮含量时,需从总量中扣除亚硝态氮 的含量。提取液中的亚硝态氮的含量真接按步骤2进行(不经还原柱处理),同时作亚亚硝态氮标准曲线
mg·㎏-1。下表是我国蔬菜硝酸盐含量卫生标准。 我国蔬菜硝酸盐污染程度的卫生评价标准 级别 硝酸盐含量 污染程度 参考卫生性(mg/kg 鲜 重) 1 ≤432 轻度 允许生食 2 ≤785 中度 允许淹渍、熟食 3 ≤1440 高度 允许熟食 4 ≤3100 严重 不允许食用 (2)作物氮素供应状况参考指标 植株硝态氮状况分级表(仅供参考) 标准色阶相当的 NO3-N(mg· −1 l ) 汁液中 NO3-N(mg· −1 l ) NO3-N 状况 1.0 100 极缺 2.5 250 较缺 5.0 500 中等 10.0 1000 高量 以上分极标准是对一般旱作而言,对于不同旱作,不同的农业区域,必须根据各地的实际情况,找 出适合当地的诊断指标。 (2)确定 SPAD 值与硝酸盐含量的相关关系。 六、注意事项 l.对镀铜镉还原柱的正确维护是获得正确分析结果的关键。因此,还原柱在不使用时,镀铜镉填料上一 定要有保护层。 2.镀铜镉还原柱在测定数百个样品后,其还原硝态氮的能力将有所降低。应将柱中金属移出,重新制备 镀铜镉试剂。 3.本方法测定结果是硝态氮和亚硝态氮的总量。如果只要测定硝态氮含量时,需从总量中扣除亚硝态氮 的含量。提取液中的亚硝态氮的含量真接按步骤 2 进行(不经还原柱处理),同时作亚亚硝态氮标准曲线