
8 Heterogeneous catalysis 1.Characteristics of surface catalysis (1)Mechanism of reaction Langmuir (1921): 多相催化是通过被吸附物质之间的反应 而实现的。 Taylor (1926): 发生多相反应的必要条件之一是至少有 一种反应物分子被化学吸附。 A(g)+B( )diffusion.A(g)+B(g)+2S adsorption 一AS+BS_reaction PS desorption →Pg)+S diffusion P(g)+S
1. Characteristics of surface catalysis (1) Mechanism of reaction Langmuir (1921): 多相催化是通过被吸附物质之间的反应 而实现的。 Taylor (1926): 发生多相反应的必要条件之一是至少有 一种反应物分子被化学吸附。 A(g) + B(g) As (g) + Bs (g) + 2S AS + BS PS Ps (g) + S P(g) + S diffusion adsorption reaction desorption diffusion § 8 Heterogeneous catalysis
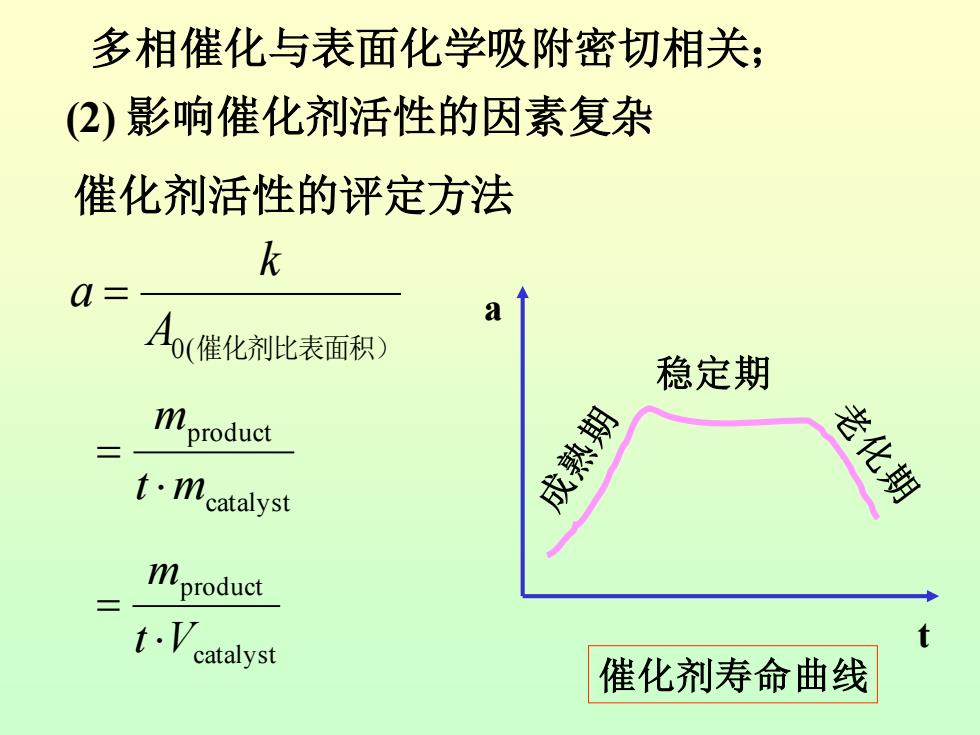
多相催化与表面化学吸附密切相关: (2)影响催化剂活性的因素复杂 催化剂活性的评定方法 k a= a A(催化剂比表面积) 稳定期 mproduct t·ncatalyst 成熟期 老化期 二 mproduct t. catalyst 催化剂寿命曲线
多相催化与表面化学吸附密切相关; (2) 影响催化剂活性的因素复杂 催化剂活性的评定方法 A0(催化剂比表面积) k a = catalyst product t m m = catalyst product t V m = 稳定期 a t 催化剂寿命曲线
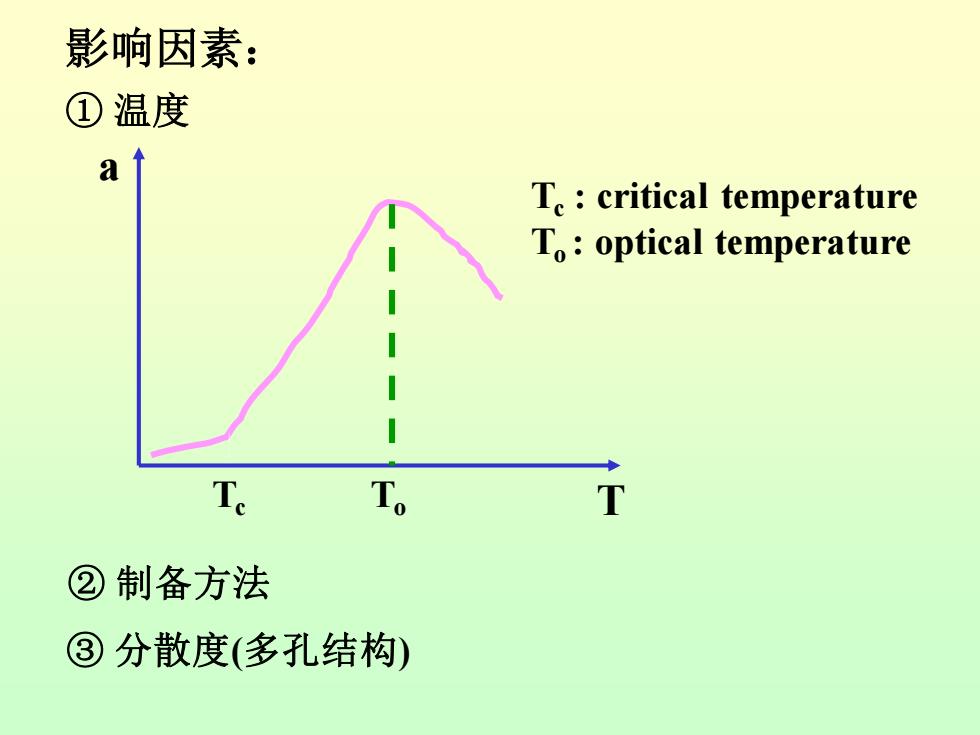
影响因素: ①温度 9 T.:critical temperature To:optical temperature Te T。 T ②制备方法 ③分散度(多孔结构)
影响因素: ① 温度 Tc To Tc : critical temperature To : optical temperature ② 制备方法 ③ 分散度(多孔结构) a T

(3)催化剂表面是不均匀的,反应只发生在表面 少数特定的位置上-活性中心(active center) ①毒物的作用 4NH3+502 Pt-Rh 4N0+6H,0 1273K 混合气中含有10-7PH3,活性完全消失 ②吸附热随表面覆盖率增加而减小. ③表面的不同部位有不同的催化活性 a&0]+H 加CS2,反应(1)不进行,但反应(2)仍可进行
(3) 催化剂表面是不均匀的,反应只发生在表面 少数 特定的位置上-活性中心( active center) ① 毒物的作用 4NH3 + 5O2 4NO + 6H2O Pt - Rh 1273K 混合气中含有10-7 PH3 , 活性完全消失 ② 吸附热随表面覆盖率增加而减小. ③ 表面的不同部位有不同的催化活性 (C3H7 )2CO C6H5NO2 + H2 Pt 加CS2 ,反应(1)不进行,但反应(2) 仍可进行
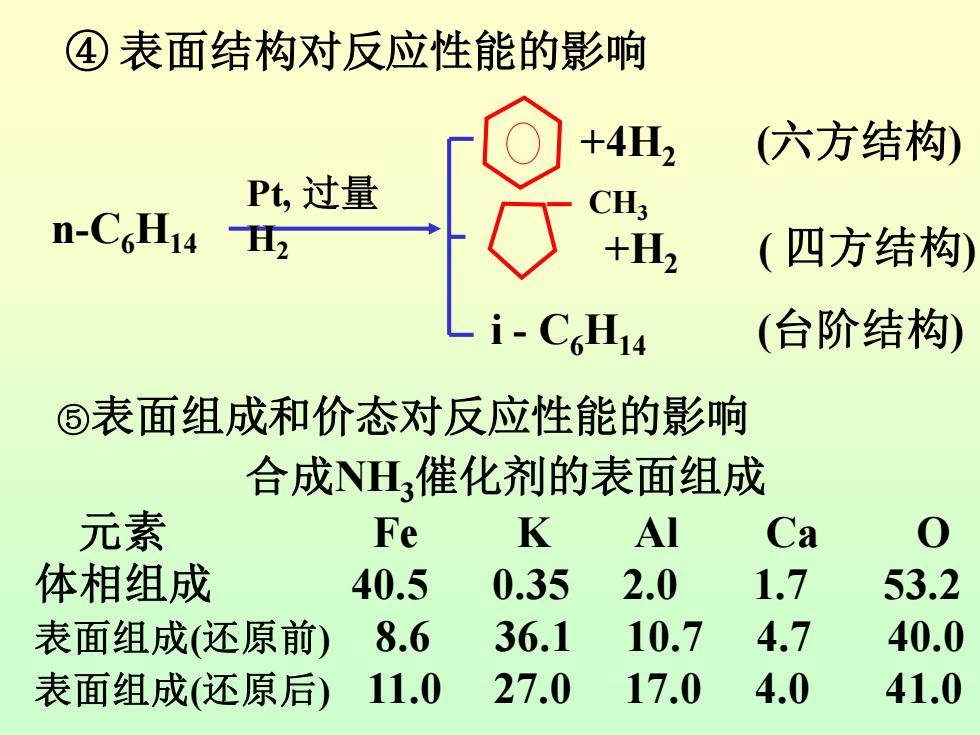
④表面结构对反应性能的影响 +4H2 (六方结构) Pt,过量 CH; n-C6H14H2 +H2 (四方结构) _i-C6H14 (台阶结构) ⑤表面组成和价态对反应性能的影响 合成NH,催化剂的表面组成 元素 Fe K Al Ca 0 体相组成 40.5 0.35 2.0 1.7 53.2 表面组成(还原前) 8.6 36.1 10.7 4.7 40.0 表面组成(还原后) 11.0 27.0 17.0 4.0 41.0
④ 表面结构对反应性能的影响 n-C6H14 Pt, 过量 H2 +4H2 (六方结构) CH3 +H2 ( 四方结构) i - C6H14 (台阶结构) ⑤表面组成和价态对反应性能的影响 合成NH3催化剂的表面组成 元素 Fe K Al Ca O 体相组成 40.5 0.35 2.0 1.7 53.2 表面组成(还原前) 8.6 36.1 10.7 4.7 40.0 表面组成(还原后) 11.0 27.0 17.0 4.0 41.0

气固表面催化反应 一般来说,多相催化反应包括下面五个基本步骤: 1.体相的反应物向催化剂表面扩散; 2.反应物发生化学吸附; 3.吸附后的分子发生表面化学反应; 4.产物从表面上解吸; 5.解吸产物扩散到体相中
气固表面催化反应 一般来说,多相催化反应包括下面五个基本步骤: 1.体相的反应物向催化剂表面扩散; 2.反应物发生化学吸附; 3.吸附后的分子发生表面化学反应; 4.产物从表面上解吸; 5.解吸产物扩散到体相中

气固表面催化反应 1.扩散控制 2.吸附或脱附控制 3.表面反应控制 a.单分子反应 b.双分子反应 Langmuir一Hinshelwood机理 Rideal机理
气固表面催化反应 1. 扩散控制 2. 吸附或脱附控制 3. 表面反应控制 a. 单分子反应 b. 双分子反应 Langmuir-Hinshelwood机理 Rideal机理

表面反应控制 单分子反应AP r=k,04 近似认为A与P吸附都可迅速达到平衡 apa 0=I+apa+aPr k,·p4 r=I+apa+dPp
表面反应控制 单分子反应 A P s A r k = 近似认为A与P吸附都可迅速达到平衡 1 A A A P ap ap a p = + + 1 s A A P k ap r ap a p = + +

表面反应控制 讨论: k。·p4A r 1+ap+app 1.产物P吸附很弱,也即a'≈0 a.A吸附很弱或压力很低,r=k~p4为一级反应 b.A吸附很强或压力很高,r=k 为零级反应 c.A吸附及压力适当,r= ksapA 为分数级反应 1+p4
表面反应控制 1 s A A P k ap r ap a p = + + 讨论: 1.产物 P 吸附很弱,也即 a' 0 a. A 吸附很弱或压力很低, 为一级反应 A r k p = b. A 吸附很强或压力很高, r k = 为零级反应 c. A 吸附及压力适当, 为分数级反应 1 s A A k ap r ap = +

表面反应控制 k,·ap4 讨论: r= 1+ap+app 2.产物P吸附很强,而A吸附很弱也即a≈0 r=k.Pa Pp 3.产物P吸附很强,而A吸附也很强也即 k,·ap4 r= apa +app
表面反应控制 1 s A A P k ap r ap a p = + + 讨论: 2.产物 P 吸附很强,而A吸附很弱也即 a 0 A P p r k p = 3.产物 P 吸附很强,而A吸附也很强也即 s A A P k ap r ap a p = +