
10.11 催化反应动力学 ·一、催化反应原理: ·催化剂:可明显改变化学反应速率,而本身在反应 前后的化学性质和数量均不发生变化的物质。 ·这种作用称为催化作用。 催化剂只能改变反应速率(即达到平衡的速率), 而不能改变反应平衡。 ·催化剂对于正向和逆向反应具有相同的催化作用。 ·催化剂有正催化剂(加速)和负催化剂(减速)。 减速者又称为阻化剂
10.11 催化反应动力学 • 一、催化反应原理: • 催化剂:可明显改变化学反应速率,而本身在反应 前后的化学性质和数量均不发生变化的物质。 • 这种作用称为催化作用。 • 催化剂只能改变反应速率(即达到平衡的速率), 而不能改变反应平衡。 • 催化剂对于正向和逆向反应具有相同的催化作用。 • 催化剂有正催化剂(加速)和负催化剂(减速)。 减速者又称为阻化剂

「气相 均相催化:液相 催化反应: 多相底化:气液、国 气、固 了常见的几种重要催化反应: 硫酸工业:S02+1V202V,0s,S0, 氮肥工业:】 N2+3H2-Fe 2NHg C0+H0→ C02+H2 硝酸工业: NH3+02 -Pt. H,O+NO, 光合作用: 啤酒发酵、等等
常见的几种重要催化反应: 光合作用: 啤酒发酵、等等 硫酸工业: SO2 + 1/2O2 SO3 V2O5 氮肥工业: N2 + 3H2 2NH3 CO + H2O CO2 + H2 Fe 硝酸工业: NH3 + O2 H2O + NO2 Pt 气相 液相 气、固 液、固 催化反应: 均相催化: 多相催化:

催化反应机理 A+BK→AB A+K之AK AK+Bk店→AB+K .kcCAC k2 E。=E,+E3-E2
K A B AB + ⎯⎯→ 1 2 k k A K AK + ⎯⎯ ⎯⎯→3 k AK B AB K + ⎯⎯→ + 1 3 2 K A B k r k c c c k = E E E E a = + − 1 3 2 催化反应机理
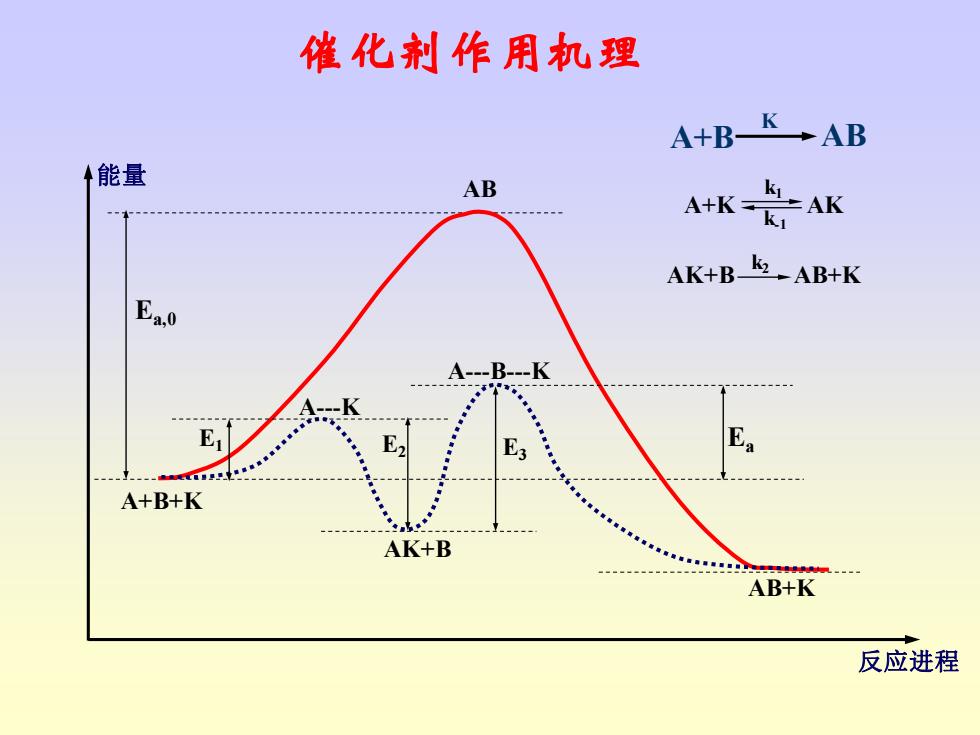
催化剂作用机理 A+B-K-AB 能量 AB AK是K AK+Bk-AB+K Ea.0 E A+B+K AK+B AB+K 反应进程
AB A+B+K AB+K Ea,0 E2 AK+B A-B-K A-K E1 E3 Ea 反应进程 能量 催化剂作用机理 A+B AB K A+K AK AK+B AB+K k2 k1 k-1

催化反应机理 催化作用的关键是大大降低了反应的活化能。 。如: (1) 2S02+02→S03 E =251 kJ/mol Pt催化: Ea’=62.8kJ/mol (2) 3H2+N2→2NH3 E=334.7 kJ/mol Fe-Al2O3-K2O: E3’=167.4kJ/mol
• 如: (1) 2SO2 + O2 → SO3 Ea = 251 kJ/mol Pt催化: Ea ’ = 62.8 kJ/mol (2) 3H2 + N2 → 2NH3 Ea = 334.7 kJ/mol Fe- Al2O3 -K2O: Ea ’ = 167.4 kJ/mol 催化作用的关键是大大降低了反应的活化能。 催化反应机理

。催化作用的特点: ()催化剂能加快反应速率的原因是由于改变了 反应的历程,降低了反应活化能。 (2)催化剂在反应前后数量和化学性质不变,催 化剂只能影响反应速率,不能改变化学平衡。 (3)催化剂本身可能参与反应,其浓度项经常会出 现在速率方程中。 ·(4)催化剂反应前后物理性质可能发生变化。 (5)催化剂有特殊的选择性。一种催化剂只对特 定类型反应有催化作用。酶催化反应具有更 强选择性。 (6)少量杂质有可能强烈的影响催化剂的作用。 增加催化剂作用的为助催剂,减低催化活性 的称为毒物
• 催化作用的特点: • ⑴ 催化剂能加快反应速率的原因是由于改变了 反应的历程,降低了反应活化能。 • (2) 催化剂在反应前后数量和化学性质不变,催 化剂只能影响反应速率,不能改变化学平衡。 • (3) 催化剂本身可能参与反应,其浓度项经常会出 现在速率方程中。 • (4) 催化剂反应前后物理性质可能发生变化。 • (5) 催化剂有特殊的选择性。一种催化剂只对特 定类型反应有催化作用。酶催化反应具有更 强选择性。 • (6) 少量杂质有可能强烈的影响催化剂的作用。 增加催化剂作用的为助催剂,减低催化活性 的称为毒物

了均相酸碱催化反应 了设有一均相催化反应: A C.P C:催化剂 ·催化反应历程可设为: A+ k M-k2P+C ·由稳态法: dM=kLA]IC]-k[M]-k[M]=0 dt M=LAIIC]-K1AIICI k1+k2
设有一均相催化反应: A P C:催化剂 C • 催化反应历程可设为: M P + C k2 A + C M k1 k-1 • 由稳态法: = k1 [A][C]− k−1 [M ]− k2 [M ] = 0 dt dM [ ][ ] [ ][ ] [ ] 1 2 1 k A C k k k A C M = + = − 均相酸碱催化反应

kk,-[4C]=k.[4[C] =k[M]=kitk2 ·无催化剂存在时的反应速率为: =k[A] .r=ro+re=ko[A]+ke[C][A] =(k+k[C])[A] =k[4] k=ko +kc[C]
[ ] [ ][ ] [ ][ ] 1 2 1 2 2 A C k A C k k k k rc k M = c + = = − [ ] r0 = k0 A [ ] [ ][ ] r = r0 + rc = k0 A + kc C A ( [ ])[ ] = k0 + kc C A = k[A] [ ] k = k0 + kc C • 无催化剂存在时的反应速率为:

酶催化反应 ·酶催化反应历程 ·用稳态近似法处理 ·酶催化反应的级数 •酶催化的反应速率曲线 米氏常数 •酶催化反应特点
酶催化反应 •酶催化反应历程 •用稳态近似法处理 •酶催化的反应速率曲线 •酶催化反应的级数 •米氏常数 •酶催化反应特点

酶催化反应特点 酶催化反应与生命现象有密切关系,它的主 要特点有: 1.高选择性 它的选择性超过了任何人造催化剂,例如脲酶它只 能将尿素迅速转化成氨和二氧化碳,而对其他反应 没有任何活性。 2.高效率 它比人造催化剂的效率高出10至1015倍。例如 一个过氧化氢分解酶分子,在1秒钟内可以分解十 万个过氧化氢分子。 3.反应条件温和一般在常温、常压下进行。 4.反应历程复杂 受H、温度、离子强度影响较大
酶催化反应特点 酶催化反应与生命现象有密切关系,它的主 要特点有: 1.高选择性 它的选择性超过了任何人造催化剂,例如脲酶它只 能将尿素迅速转化成氨和二氧化碳,而对其他反应 没有任何活性。 2.高效率 它比人造催化剂的效率高出109至1015倍。例如 一个过氧化氢分解酶分子,在1秒钟内可以分解十 万个过氧化氢分子。 3.反应条件温和 一般在常温、常压下进行。 4.反应历程复杂 受pH、温度、离子强度影响较大