
《生物技术制药》实验指导 (供生物技术专业使用) 杨德龙栗孟飞李唯编写 甘肃农业大学 生命科学技术学院生物制品系 2008年1月
《生物技术制药》实验指导 (供生物技术专业使用) 杨德龙 栗孟飞 李 唯 编写 甘肃农业大学 生命科学技术学院生物制品系 2008 年 1 月

学生实验守则 1.学生实验前必须认真预习,包括到实验室进行预习,并写好预习报告(含讲义指定 课前必做的内容及实验数据表格)。进入实验室须带上预习报告,经教师检查同意方可 进行实验。 2.严格按照实验分组表进行实验,不得擅自调整分组。遵守上课时间,不得无故迟到、 缺席。有事有病要事先向实验教师请假。一般情况下,所缺实验不得补做。 3.实验前检查、清理好所需的仪器、用具。如有缺损,应立即向教师报告,不得自己 任意拉用。 4.遵守课堂纪律,保持安静整洁的实验环境。严禁吃东西、随地吐痰、乱扔脏物、大 声喧哗等不文明行为。 5.使用电源时,严禁带电接线或拆线,务必经过教师检查线路后才能接通电源;实验 后要切断电源。 6.爱护仪器,严格按仪器说明书或操作规程操作。仪器用具发生故障、损坏或丢失等 特别情况,应立即向教师报告。严禁擅自拆卸、搬弄仪器。有损坏仪器,应做出书面检 查,等候处理。公用工具用完后应立即归还原处。 7.实验中要注意安全,如仪器设备出现异常气味、打火、冒烟、发热、响声、振动等 现象,应立即切断电源,关闭仪器,并向教师报告。 8.实验中若发生触电等人身伤害,应保持镇定并立即切断电源,马上向教师报告,以 便采取相应措施。 9.实验中要注意节约使用实验材料。 10.作完实验,学生应负责将仪器整理还原,桌面、凳子收拾整齐,经教师审查测量数 据和仪器还原情况并同意后,方可离开实验室。 11.实验室中任何仪器用具不得带出实验室。 12.每次实验后,由值日学生打扫卫生并协助教师收整仪器。 13.实验报告应在实验教师规定时间内交实验室。 2008年1月
学生实验守则 1.学生实验前必须认真预习,包括到实验室进行预习,并写好预习报告(含讲义指定 课前必做的内容及实验数据表格)。进入实验室须带上预习报告,经教师检查同意方可 进行实验。 2.严格按照实验分组表进行实验,不得擅自调整分组。遵守上课时间,不得无故迟到、 缺席。有事有病要事先向实验教师请假。一般情况下,所缺实验不得补做。 3.实验前检查、清理好所需的仪器、用具。如有缺损,应立即向教师报告,不得自己 任意拉用。 4.遵守课堂纪律,保持安静整洁的实验环境。严禁吃东西、随地吐痰、乱扔脏物、大 声喧哗等不文明行为。 5.使用电源时,严禁带电接线或拆线,务必经过教师检查线路后才能接通电源;实验 后要切断电源。 6.爱护仪器,严格按仪器说明书或操作规程操作。仪器用具发生故障、损坏或丢失等 特别情况,应立即向教师报告。严禁擅自拆卸、搬弄仪器。有损坏仪器,应做出书面检 查,等候处理。公用工具用完后应立即归还原处。 7.实验中要注意安全,如仪器设备出现异常气味、打火、冒烟、发热、响声、振动等 现象,应立即切断电源,关闭仪器,并向教师报告。 8.实验中若发生触电等人身伤害,应保持镇定并立即切断电源,马上向教师报告,以 便采取相应措施。 9.实验中要注意节约使用实验材料。 10.作完实验,学生应负责将仪器整理还原,桌面、凳子收拾整齐,经教师审查测量数 据和仪器还原情况并同意后,方可离开实验室。 11.实验室中任何仪器用具不得带出实验室。 12.每次实验后,由值日学生打扫卫生并协助教师收整仪器。 13.实验报告应在实验教师规定时间内交实验室。 2008 年 1 月
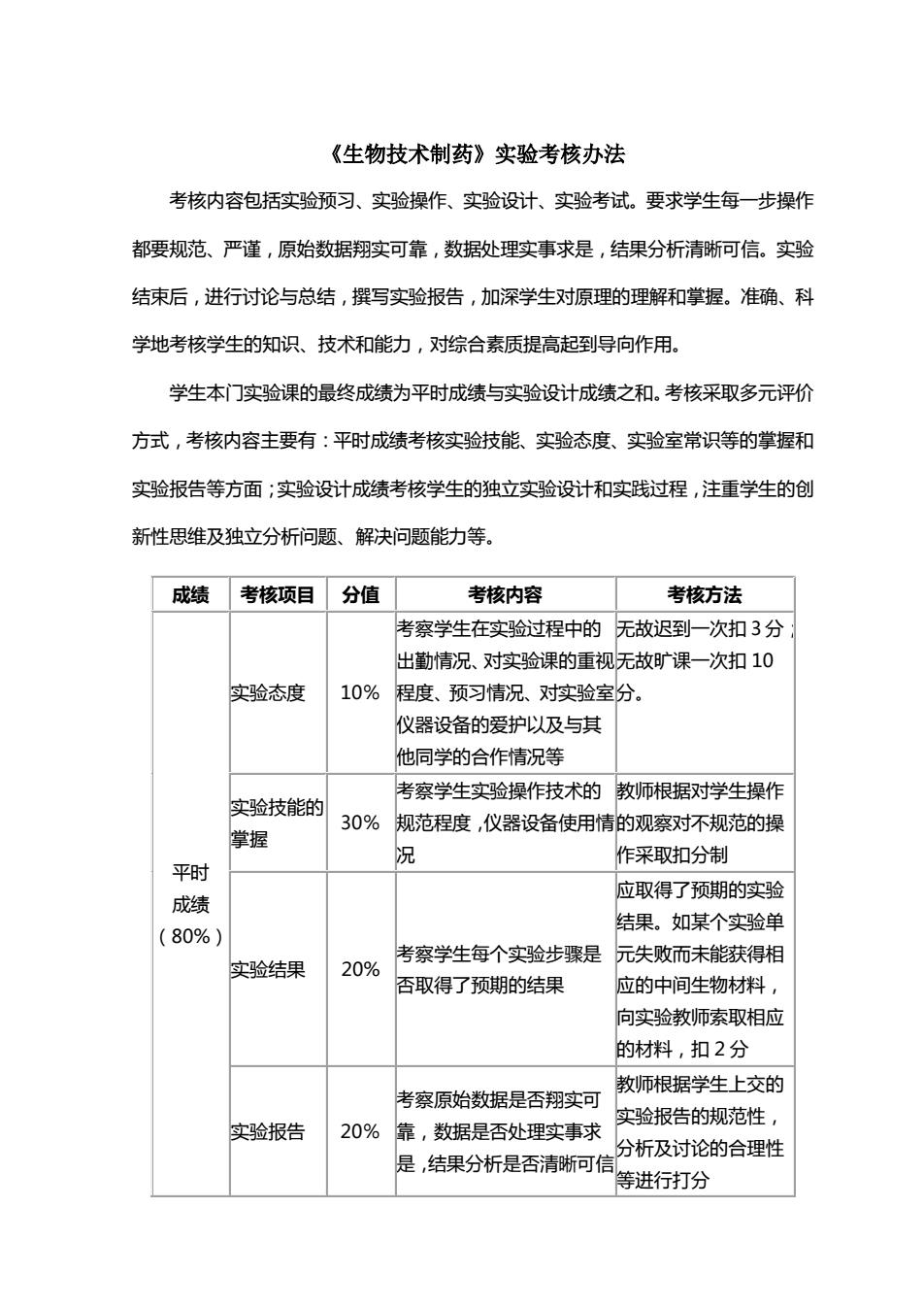
《生物技术制药》实验考核办法 考核内容包括实验预习、实验操作、实验设计、实验考试。要求学生每一步操作 都要规范、严谨,原始数据翔实可靠,数据敔处理实事求是,结果分析清晰可信。实验 结束后,进行讨论与总结,撰写实验报告,加深学生对原理的理解和掌握。准确、科 学地考核学生的知识、技术和能力,对综合素质提高起到导向作用。 学生本门实验课的最终成绩为平时成绩与实验设计成绩之和。考核采取多元评价 方式,考核内容主要有:平时成绩考核实验技能、实验态度、实验室常识等的掌握和 实验报告等方面;实验设计成绩考核学生的独立实验设计和实践过程,注重学生的创 新性思维及独立分析问题、解决问题能力等。 成绩 考核项目 分值 考核内容 考核方法 考察学生在实验过程中的 无故迟到一次扣3分 出勤情况、对实验课的重视无故旷课一次扣10 实验态度 10% 程度、预习情况、对实验室分。 仪器设备的爱护以及与其 他同学的合作情况等 考察学生实验操作技术的 教师根据对学生操作 实验技能的 30% 规范程度,仪器设备使用情的观察对不规范的操 掌握 况 作采取扣分制 平时 应取得了预期的实验 成绩 结果。如某个实验单 (80%) 考察学生每个实验步骤是 元失败而未能获得相 实验结果 20% 否取得了预期的结果 应的中间生物材料, 向实验教师索取相应 的材料,扣2分 教师根据学生上交的 考察原始数据是否翔实可 实验报告的规范性, 实验报告 20% 靠,数据是否处理实事求 分析及讨论的合理性 是,结果分析是否清晰可信 等进行打分
《生物技术制药》实验考核办法 考核内容包括实验预习、实验操作、实验设计、实验考试。要求学生每一步操作 都要规范、严谨,原始数据翔实可靠,数据处理实事求是,结果分析清晰可信。实验 结束后,进行讨论与总结,撰写实验报告,加深学生对原理的理解和掌握。准确、科 学地考核学生的知识、技术和能力,对综合素质提高起到导向作用。 学生本门实验课的最终成绩为平时成绩与实验设计成绩之和。考核采取多元评价 方式,考核内容主要有:平时成绩考核实验技能、实验态度、实验室常识等的掌握和 实验报告等方面;实验设计成绩考核学生的独立实验设计和实践过程,注重学生的创 新性思维及独立分析问题、解决问题能力等。 成绩 考核项目 分值 考核内容 考核方法 平时 成绩 (80%) 实验态度 10% 考察学生在实验过程中的 出勤情况、对实验课的重视 程度、预习情况、对实验室 仪器设备的爱护以及与其 他同学的合作情况等 无故迟到一次扣 3 分; 无故旷课一次扣 10 分。 实验技能的 掌握 30% 考察学生实验操作技术的 规范程度,仪器设备使用情 况 教师根据对学生操作 的观察对不规范的操 作采取扣分制 实验结果 20% 考察学生每个实验步骤是 否取得了预期的结果 应取得了预期的实验 结果。如某个实验单 元失败而未能获得相 应的中间生物材料, 向实验教师索取相应 的材料,扣 2 分 实验报告 20% 考察原始数据是否翔实可 靠,数据是否处理实事求 是,结果分析是否清晰可信 教师根据学生上交的 实验报告的规范性, 分析及讨论的合理性 等进行打分

《生物技术制药》实验指导 教师根据设计的实验 设计方案和 考察学生自主设计的实验 10% 方案新颖,研究方案 实验 设计报告 的合理性和可行性 可行打分 设计 考察学生在实施过程中出 成绩 教师根据实验实施情 实验结果和 现问题时的分析解决能力、 (20%) 10% 况、实验数据和结果 分析报告 是否能达到预期结果、结果 打分 的分析是否合理 目 录 实验一细菌感受态的制备和质粒的转化 .2 实验二碱变性法提取质粒DNA 6 实验三水平式琼脂糖凝胶电泳法检测DNA 11 实验四DNA的限制性内切酶酶切 15 实验五DNA的回收与连接 18 实验六基因的PCR扩增 23 实验七用温度敏感型启动子表达系统表达目的基因 29 实验八基因组合生物合成新化合物 36 实验九药用甘草片中甘草酸含量的分析及其质量评价 47 实验十牛奶中酪蛋白和乳蛋白素粗品的制备.… 48 实验十一固定化细胞法生产L天冬氨酸和L丙氨酸 50 实验十二重组水蛭素Ⅲ的制备 57 实验十三酸醇提取法制备猪胰岛素 65 实验十四多肽缩宫素的Fmoc固相合成法 70
《生物技术制药》实验指导 1 实验 设计 成绩 (20%) 设计方案和 设计报告 10% 考察学生自主设计的实验 的合理性和可行性 教师根据设计的实验 方案新颖,研究方案 可行打分 实验结果和 分析报告 10% 考察学生在实施过程中出 现问题时的分析解决能力、 是否能达到预期结果、结果 的分析是否合理 教师根据实验实施情 况、实验数据和结果 打分 目 录 实验一 细菌感受态的制备和质粒的转化....................................................................... 2 实验二 碱变性法提取质粒 DNA ..................................................................................... 6 实验三 水平式琼脂糖凝胶电泳法检测 DNA ............................................................... 11 实验四 DNA 的限制性内切酶酶切 ............................................................................... 15 实验五 DNA 的回收与连接 ........................................................................................... 18 实验六 基因的 PCR 扩增............................................................................................... 23 实验七 用温度敏感型启动子表达系统表达目的基因................................................. 29 实验八 基因组合生物合成新化合物............................................................................. 36 实验九 药用甘草片中甘草酸含量的分析及其质量评价............................................... 47 实验十 牛奶中酪蛋白和乳蛋白素粗品的制备............................................................... 48 实验十一 固定化细胞法生产 L-天冬氨酸和 L-丙氨酸.................................................. 50 实验十二 重组水蛭素Ⅲ的制备....................................................................................... 57 实验十三 酸醇提取法制备猪胰岛素............................................................................... 65 实验十四 多肽缩宫素的 Fmoc 固相合成法.................................................................... 70

《生物技术制药》实验指导 实验十五酵母RNA的制备和单核苷酸的离子交换柱层析分析….76 实验十六单核苷酸衍生物制备.… 82 实验十七胰弹性蛋白酶的制备及活力测定 85 实验十八超氧化物歧化酶的分离纯化 89 实验十九重组门冬酰胺酶Ⅱ的纯化与分析 97 实验一 细菌感受态的制备和质粒的转化 【实验目的】 通过实验学会感受态细胞的制备方法和DNA转化的最基本操作,以及如何提高 转化效率的思路。本实验综合因素较多,难度较大,是分子生物学中的一个很关键的 实验手段。 【实验原理】 转化是指某一细胞系由于接受了外源DNA,而导致其原来的遗传性状发生改变, 这种遗传性状包括遗传型和表型的改变
《生物技术制药》实验指导 2 实验十五 酵母 RNA 的制备和单核苷酸的离子交换柱层析分析................................. 76 实验十六 单核苷酸衍生物制备....................................................................................... 82 实验十七 胰弹性蛋白酶的制备及活力测定................................................................... 85 实验十八 超氧化物歧化酶的分离纯化........................................................................... 89 实验十九 重组门冬酰胺酶Ⅱ的纯化与分析................................................................... 97 实验一 细菌感受态的制备和质粒的转化 【实验目的】 通过实验学会感受态细胞的制备方法和 DNA 转化的最基本操作,以及如何提高 转化效率的思路。本实验综合因素较多,难度较大,是分子生物学中的一个很关键的 实验手段。 【实验原理】 转化是指某一细胞系由于接受了外源 DNA,而导致其原来的遗传性状发生改变, 这种遗传性状包括遗传型和表型的改变

《生物技术制药》实验指导 感受态是受体菌能接受外源DNA能力的一种生理状态。用CaCI2处理细菌,改 变细胞膜的结构,使质粒DNA能够穿过细菌细胞膜进入细胞。然后在选择性培养基 中培养转化处理过的细菌,转化成功的细菌可以在选择性培养基上生长形成菌落。 本实验采用质粒pUC118转化大肠杆菌DH-5,通过氨苄青霉素抗性筛选转化 :118/pUC119 cloning site pUC118/pUC119 (3,162bp) S-GAATTCGAGCTCGGTACCCOGOGATCCTCTAGAGTCOACCTGCAGGCATGCAAGCTTGGC-3 1Ss683B71 -GCCAAGCTTOCATOCCTOCAOOTCOACTCTAOANGATCCCCOOOTACCOAOCTCOMAT SeeB387 1 S 子。 图1-1质粒pUC118/pUC119图谱 【实验材料和试剂】 (一)实验材料 大肠杆菌DH-5、质粒pUC118(ampicillin,AmpR) (二)培养基和试剂 1.LB液体培养基(%) 胰蛋白胨(Tryptone) 0.5 酵母浸出粉(Yeast extract) 1.0 NaCl 0.5 pH7.2~7.4(用2mol/L NaOH调节)
《生物技术制药》实验指导 3 感受态是受体菌能接受外源 DNA 能力的一种生理状态。用 CaCl2 处理细菌,改 变细胞膜的结构,使质粒 DNA 能够穿过细菌细胞膜进入细胞。然后在选择性培养基 中培养转化处理过的细菌,转化成功的细菌可以在选择性培养基上生长形成菌落。 本实验采用质粒 pUC118 转化大肠杆菌 DH- ,通过氨苄青霉素抗性筛选转化 子。 图 1-1 质粒 pUC118/pUC119 图谱 【实验材料和试剂】 (一)实验材料 大肠杆菌 DH- 、质粒 pUC118(ampicillin,AmpR) (二)培养基和试剂 1. LB 液体培养基(%) 胰蛋白胨(Tryptone) 0.5 酵母浸出粉(Yeast extract) 1.0 NaCl 0.5 pH 7.2~7.4(用 2mol/L NaOH 调节)

《生物技术制药》实验指导 (分装:20ml/250ml三角瓶,每组2瓶。3ml/试管,每组2管。0.07Mpa高压 灭菌30分钟)。 2.LB固体培养基 LB液体培养基加入1.6%的琼脂粉即可。 (分装:50ml/250ml三角瓶,加入0.8克琼脂粉,每组1瓶。0.07Mpa高压灭 菌30分钟)。 3.抗生素:氨苄青霉素(ampicillin,Amp)),配制成100mg/ml备用。 4.0.1mol/LCaC2溶液 配制方法称取1.1克无水CaCl2,溶于90ml蒸馏水中定容至100ml装于250ml 三角瓶中,0.07Mpa高压灭菌30分钟,4℃保存。 (三)器材 接种针、10ml移液管、50ml塑料离心管、5ml移液管、90mm培养皿、1ml移液 管、1.5 ml Eppendorf管、2001吸头、三角爬、15×150试管、冰块、试管铝帽、牛皮 纸、纱布盖、线绳、硫酸纸。 (四)仪器 净化工作台、摇床机、恒温水浴锅、离心机、培养箱 【实验步骤】 (一)感受态细胞的制备 1.大肠杆菌DH5冷冻保存的菌种,挑取一环,划线接种在LB固体培养基平 板上(活化菌种),37℃培养过夜(约16小时)。 2.从长好的平板上挑取一个单菌落,转接在含有3mlLB液体培养基的试管中, 37℃振荡培养过夜(约16小时)
《生物技术制药》实验指导 4 (分装:20ml/250ml 三角瓶,每组 2 瓶。3ml/试管,每组 2 管。0.07Mpa 高压 灭菌 30 分钟)。 2. LB 固体培养基 LB 液体培养基加入 1.6%的琼脂粉即可。 (分装:50ml/250ml 三角瓶,加入 0.8 克琼脂粉,每组 1 瓶。0.07Mpa 高压灭 菌 30 分钟)。 3. 抗生素:氨苄青霉素(ampicillin,,Amp),配制成 100mg/ml 备用。 4. 0.1mol/L CaCl2溶液 配制方法:称取 1.1 克无水 CaCl2,溶于 90ml 蒸馏水中,定容至 100ml,装于 250ml 三角瓶中,0.07Mpa 高压灭菌 30 分钟,4℃保存。 (三)器材 接种针、10ml 移液管、50ml 塑料离心管、5ml 移液管、90mm 培养皿、1ml 移液 管、1.5ml Eppendorf 管、200 l 吸头、三角爬、15×150 试管、冰块、试管铝帽、牛皮 纸、纱布盖、线绳、硫酸纸。 (四)仪器 净化工作台、摇床机、恒温水浴锅、离心机、培养箱 【实验步骤】 (一)感受态细胞的制备 1. 大肠杆菌 DH- 冷冻保存的菌种,挑取一环,划线接种在 LB 固体培养基平 板上(活化菌种),37℃培养过夜(约 16 小时)。 2. 从长好的平板上挑取一个单菌落,转接在含有 3ml LB 液体培养基的试管中, 37℃振荡培养过夜(约 16 小时)

《生物技术制药》实验指导 3.取0.3ml菌液接种于20mlLB液体培养基的250ml三角瓶中37℃振荡培养2~ 3小时,待0D6oo值达到0.3~0.4时,取下三角瓶,立即置冰浴10~15分钟。 4.将细菌转移到一个灭菌的50ml离心管中,4℃3000r/min离心10分钟,弃去 上清液(尽可能将所有的上清液去净),收集菌体。 5.加入20ml用冰预冷的0.1mol/LCaC12溶液,重新悬浮菌体,使菌体分散均匀, 置冰浴中30分钟。 6.4℃3000r/min离心10分钟,弃去上清液(尽可能将所有的上清液去净)。 7.再加入2ml用冰预冷的0.1mol/L CaCl2溶液,小心重新悬浮菌体(操作要轻)。 在4℃冰箱中放置12~24小时,即可应用于DNA转化。 (二)细菌的转化 1.取大肠杆菌DH-5新鲜感受态细胞1001于1.5 ml Eppendorf管中加入50~ 100ng质粒pUC118DNA,轻轻旋转以混合内容物,在冰浴中放置30分钟。 2.42℃热休克120秒,不要摇动Eppendorf管。 3.加入LB液体培养基9001,37℃保温60分钟。 4.取1001转化液涂布在含氨苄青霉素((Amp)100gml的LB固体平板上, 37℃倒置培养16~24小时。 5.观察平板,长出的菌落可能就是转化子,可进一步提取质粒鉴定。 【提示】 实验操作中注意的问题 1.DNA与感受态细胞混合后,一定要在冰浴条件下操作,如果温度时高时低, 转化效率极差。 2.Eppendorf管盖紧,以免反应液溢出或外面水进入而污染
《生物技术制药》实验指导 5 3. 取0.3ml菌液接种于20ml LB液体培养基的250ml三角瓶中,37℃振荡培养2~ 3 小时,待 OD600 值达到 0.3~0.4 时,取下三角瓶,立即置冰浴 10~15 分钟。 4. 将细菌转移到一个灭菌的 50ml 离心管中,4℃ 3000r/min 离心 10 分钟,弃去 上清液(尽可能将所有的上清液去净),收集菌体。 5. 加入 20ml 用冰预冷的 0.1mol/L CaCl2溶液,重新悬浮菌体,使菌体分散均匀, 置冰浴中 30 分钟。 6. 4℃ 3000r/min 离心 10 分钟,弃去上清液(尽可能将所有的上清液去净)。 7. 再加入 2ml 用冰预冷的 0.1mol/L CaCl2 溶液,小心重新悬浮菌体(操作要轻)。 在 4℃冰箱中放置 12~24 小时,即可应用于 DNA 转化。 (二)细菌的转化 1. 取大肠杆菌 DH- 新鲜感受态细胞 于 1.5ml Eppendorf 管中,加入 50~ 100ng 质粒 pUC118 DNA,轻轻旋转以混合内容物,在冰浴中放置 30 分钟。 2. 42℃热休克 120 秒,不要摇动 Eppendorf 管。 3. 加入 LB 液体培养基 ,37℃保温 60 分钟。 4. 取 转化液涂布在含氨苄青霉素(Amp) 的 LB 固体平板上, 37℃倒置培养 16~24 小时。 5.观察平板,长出的菌落可能就是转化子,可进一步提取质粒鉴定。 【提示】 实验操作中注意的问题 1. DNA 与感受态细胞混合后,一定要在冰浴条件下操作,如果温度时高时低, 转化效率极差。 2. Eppendorf 管盖紧,以免反应液溢出或外面水进入而污染

《生物技术制药》实验指导 3.42℃热处理时很关键,转移速度要快,但温度要准确。 4.涂布转化液时,要避免反复来回涂布,因为感受态细菌的细胞壁有了变化, 过多的机械挤压涂布会使细胞破裂,影响转化率。 实验二碱变性法提取质粒DNA 【实验目的】 提取基因工程中运载基因的载体,掌握最常用的提取质粒DNA的方法。 【实验原理】 碱变性提取质粒DNA是基于染色体DNA与质粒DNA的变性与复性的差异而达 到分离目的。在pH高达12.6的碱性条件下,染色体DNA的氢键断裂,双螺旋结构 解开而变性。质粒DNA的大部分氢键也断裂,但超螺旋共价闭合环状的两条互补链 不会完全分离,当以pH4.8的NaAc高盐缓冲液去调节其pH至中性时,变性的质粒 DNA又恢复原来的构型,保存在溶液中,而染色体DNA不能复性而形成缠连的网状 结构,通过离心,染色体DNA与不稳定的大分子RNA、蛋白质SDS复合物等一起 沉淀下来而被除去。 【实验材料和试剂】 (一)实验材料 6
《生物技术制药》实验指导 6 3. 42℃热处理时很关键,转移速度要快,但温度要准确。 4. 涂布转化液时,要避免反复来回涂布,因为感受态细菌的细胞壁有了变化, 过多的机械挤压涂布会使细胞破裂,影响转化率。 实验二 碱变性法提取质粒 DNA 【实验目的】 提取基因工程中运载基因的载体,掌握最常用的提取质粒 DNA 的方法。 【实验原理】 碱变性提取质粒 DNA 是基于染色体 DNA 与质粒 DNA 的变性与复性的差异而达 到分离目的。在 pH 高达 12.6 的碱性条件下,染色体 DNA 的氢键断裂,双螺旋结构 解开而变性。质粒 DNA 的大部分氢键也断裂,但超螺旋共价闭合环状的两条互补链 不会完全分离,当以 pH4.8 的 NaAc 高盐缓冲液去调节其 pH 至中性时,变性的质粒 DNA 又恢复原来的构型,保存在溶液中,而染色体 DNA 不能复性而形成缠连的网状 结构,通过离心,染色体 DNA 与不稳定的大分子 RNA、蛋白质-SDS 复合物等一起 沉淀下来而被除去。 【实验材料和试剂】 (一)实验材料

《生物技术制药》实验指导 大肠杆菌DH-5(pUC118)(使用实验一转化平板上的菌)。 (二)培养基和试剂 1.LB液体培养基 同实验一。 2.抗生素:氨苄青霉素(ampicillin,.Amp),配制成100mgml备用。 3.溶液1: 50mmol/L 葡萄糖 25mmol/L Tris-HCI pH8.0 10mmol/L EDTA pH8.0) 2mg/ml 溶菌酶 4.溶液Ⅱ: 200mmol/L NaOH 1% SDS 5.溶液Ⅲ: 3mol/L NaAc(pH4.8)溶液 6.TE缓冲液: 10mmol/L Tris-HCI pH8.0 1mmol/L EDTA 7.预冷的无水乙醇 (三)器材 接种针、1ml移液管、1.5 ml Eppendorf管、2001吸头、冰块、牛皮纸、纱布盖、 线绳 (四)仪器 >
《生物技术制药》实验指导 7 大肠杆菌 DH- (pUC118)(使用实验一转化平板上的菌)。 (二)培养基和试剂 1. LB 液体培养基 同实验一。 2. 抗生素:氨苄青霉素(ampicillin, Amp),配制成 100mg/ml 备用。 3. 溶液 I : 50mmol/L 葡萄糖 25mmol/L Tris-HCl(pH8.0) 10mmol/L EDTA(pH8.0) 2mg/ml 溶菌酶 4. 溶液 II : 200mmol/L NaOH 1% SDS 5. 溶液 III : 3mol/L NaAc(pH4.8)溶液 6. TE 缓冲液 : 10mmol/L Tris-HCl(pH8.0) 1mmol/L EDTA 7. 预冷的无水乙醇 (三)器材 接种针、1ml 移液管、1.5ml Eppendorf 管、200 l 吸头、冰块、 牛皮纸、纱布盖、 线绳 (四)仪器