
《分析化学》教学大纲 一、课程基本信息 开课单位:化学与化工学院 课程名称:分析化学 课程编号:081006 英文名称:Analytical chemistry 课程类型:学科基础课 总学时:48理论学时:48实验学时:课外学时: 学分:3 开设专业:化学、化学工程与工艺、应用化学、材料化学、制药工程 先修课程:无机化学 二、课程任务目标 (一)课程任务 课程性质:分析化学是研究物质的化学组成、含量与结构的分析方法及有关理论的一门科 学,是化学学科的重要分支。分析化学是以试验为基础的一门专业基础课。分析化学提供大量的 有关物质的信息,在处理和解决实际问题中发挥了重要作用。 课程的教学任务:分析化学的主要内容为滴定分析、重量分析和光度分析三大部分。通过本 课程的学习,使学生掌握水溶液中化学平衡理论及其在分析化学中的应用:掌握滴定分析、重量 分析和光度分析的基本原理和方法,初步了解仪器分析的内容。 (二)课程目标 在学完本课程之后,学生能够: 1掌握定量分析的基本理论和基本分析方法: 2.掌握分析化学的基本原理及其基本操作,正确掌握化学分析实验的基本操作技能: 3.运用所学的基本原理和分析方法设计分析方案,初步具有分析问题、解决问题的能力: 4.培养学生良好的实验习惯、实事求是的科学态度和严谨细致的工作作风。培养能从事大中 小企业产品品质理化检测分析的应用型人才。并为后续学习《仪器分析》课程打下基础。 三、教学内容和要求 (一)理论教学的内容及要求 第一章概论 重点与难点: 重点:定量分析结果的表示,常用基准物质、标准溶液的配制及浓度表示方法,滴定剂与被滴 物质之间的计量关系的确定及计算。 难点:对于较复杂涉及多步反应的滴定分析,确定计量关系进行计算是本章的难点。 教学内容: 11分析化学的定义、任务和作用 了解分析化学的定义、任务与作用 12分析方法的分类与洗择 L.了解分析方法的分类 2.了翠分析方法的洗择 13分析化学发展简史与发展趋势
《分析化学》教学大纲 一、课程基本信息 开课单位:化学与化工学院 课程名称:分析化学 课程编号:081006 英文名称:Analytical chemistry 课程类型:学科基础课 总 学 时:48 理论学时: 48 实验学时: 课外学时: 学 分:3 开设专业:化学、化学工程与工艺、应用化学、材料化学、制药工程 先修课程:无机化学 二、课程任务目标 (一) 课程任务 课程性质:分析化学是研究物质的化学组成、含量与结构的分析方法及有关理论的一门科 学,是化学学科的重要分支。分析化学是以试验为基础的一门专业基础课。分析化学提供大量的 有关物质的信息,在处理和解决实际问题中发挥了重要作用。 课程的教学任务:分析化学的主要内容为滴定分析、重量分析和光度分析三大部分。通过本 课程的学习,使学生掌握水溶液中化学平衡理论及其在分析化学中的应用;掌握滴定分析、重量 分析和光度分析的基本原理和方法,初步了解仪器分析的内容。 (二) 课程目标 在学完本课程之后,学生能够: 1. 掌握定量分析的基本理论和基本分析方法; 2. 掌握分析化学的基本原理及其基本操作,正确掌握化学分析实验的基本操作技能; 3. 运用所学的基本原理和分析方法设计分析方案,初步具有分析问题、解决问题的能力; 4. 培养学生良好的实验习惯、实事求是的科学态度和严谨细致的工作作风。培养能从事大中 小企业产品品质理化检测分析的应用型人才。并为后续学习《仪器分析》课程打下基础。 三、教学内容和要求 (一) 理论教学的内容及要求 第一章 概论 重点与难点: 重点:定量分析结果的表示,常用基准物质、标准溶液的配制及浓度表示方法,滴定剂与被滴 物质之间的计量关系的确定及计算。 难点:对于较复杂涉及多步反应的滴定分析,确定计量关系进行计算是本章的难点。 教学内容: 1.1分析化学的定义、任务和作用 了解分析化学的定义、任务与作用 1.2 分析方法的分类与选择 1. 了解分析方法的分类 2. 了解分析方法的选择 1.3 分析化学发展简史与发展趋势

了解分析化学发展简中与发展格势 1.4分析化学参考文献 了解分析化学丛书、大全和手册,相关的参考书、杂志及其相应的网站 1.5分析化学过程及分析结果的表示 1.了解定量分析过程 2掌握定量分析结果的表示 16商定分析法概述 1.了解滴定分析法对化学反应的要求 2.了解常用滴定方式 1.7基准物质和标准溶液 1.掌握常用基准物质 2.掌握标准溶液的配制方法 1.8滴定分析中的计算 1.掌握标准溶液浓度表示方法及计算 2.掌握滴定剂与被滴物质之间的计量关系、待测组分含量的计算 第二章分析试样的采集与制备 重点与难点: 重点:试样的分解方法 难点:根据试样的组成和特性等选择合适的分解方法 教学内容: 2.1试样的采集 了解固体试样、液体试样、气体试样、生物试样的采集方法 22试样的制备 理解固体试样的制备过程 2.3试样的分解 1.了解半溶法、微波辅助消解法 2.理解干式灰化法、湿式灰化法和熔融法 3.掌握溶解法 2.4测定前的预处理 了解试样的预处理应考虑的因素 第三章分析化学中的误差与数据处理 重点与难点: 重点:误差、相对误差、偏差、平均偏差、相对平均偏差的计算,系统误差与随机误差的产生 原因、特点,有效数字的修约、计算,标准偏差的计算,平均值置信区间的计算,t检验法、F检验法 的方法与作用,提高分析结果准确度的方法。 难点:标准偏差的计算,平均值置信区间的计算,t检验法、F检验法的方法与作用 教学内容: 3.1分析化学中的误差 1,理解以下概念:准确度与误差、精密度与偏差。掌握误差、相对误差、偏差、平均偏 差、及相对平均信第的计算 2.理解系统误差与随机误差的产生原因和特点 3.2有效数字及其运算规则
了解分析化学发展简史与发展趋势 1.4 分析化学参考文献 了解分析化学丛书、大全和手册,相关的参考书、杂志及其相应的网站 1.5 分析化学过程及分析结果的表示 1. 了解定量分析过程 2. 掌握定量分析结果的表示 1.6 滴定分析法概述 1. 了解滴定分析法对化学反应的要求 2. 了解常用滴定方式 1.7 基准物质和标准溶液 1. 掌握常用基准物质 2. 掌握标准溶液的配制方法 1.8 滴定分析中的计算 1. 掌握标准溶液浓度表示方法及计算 2. 掌握滴定剂与被滴物质之间的计量关系、待测组分含量的计算 第二章 分析试样的采集与制备 重点与难点: 重点:试样的分解方法 难点:根据试样的组成和特性等选择合适的分解方法 教学内容: 2.1 试样的采集 了解固体试样、液体试样、气体试样、生物试样的采集方法 2.2 试样的制备 理解固体试样的制备过程 2.3 试样的分解 1. 了解半溶法、微波辅助消解法 2. 理解干式灰化法、湿式灰化法和熔融法 3. 掌握溶解法 2.4 测定前的预处理 了解试样的预处理应考虑的因素 第三章 分析化学中的误差与数据处理 重点与难点: 重点:误差、相对误差、偏差、平均偏差、相对平均偏差的计算,系统误差与随机误差的产生 原因、特点,有效数字的修约、计算,标准偏差的计算,平均值置信区间的计算,t检验法、F检验法 的方法与作用,提高分析结果准确度的方法。 难点:标准偏差的计算,平均值置信区间的计算,t检验法、F检验法的方法与作用 教学内容: 3.1 分析化学中的误差 1. 理解以下概念:准确度与误差、精密度与偏差。掌握误差、相对误差、偏差、平均偏 差、及相对平均偏差的计算 2. 理解系统误差与随机误差的产生原因和特点 3.2有效数字及其运算规则

1.理解有效数字 2.掌握有效数字的修约和计算规则 3.3分析化学中的数据处理 1.了解频数分布 2.理解总体、样本、样本容量、自由度、总体标准偏差、正态分布、标准正态分布、 分布曲线 3.掌握样本标准偏差、相对标准偏差、平均值的标准偏差的计算公式,随机误差的分 布规律,平均值的置信区间的计算 3.4显著性检验 掌握显著性检验方法:t检验法、F检验法 35可解值取金 掌握可疑值的取舍方法 3.6回归分析法 了解一元线性回归方程及相关系数的计算方法 3.7提高分析结果准确度的方法 掌握提高分析结果准确度的方法 1.理解t分布曲线 2.掌握平均值的置信区间的计算 3.掌握显著性检验及异常值的取舍方法 第四章分析化学中的质量保证与质量控制(自学) 第五章酸碱滴定法 重点与难点: 重点:掌握利用分布分数及PBE处理酸碱平衡的基本方法,各种类型酸碱溶液H十]的计算(强 酸强碱、一元弱酸弱碱、多元酸碱、混合酸碱、两性物质、缓冲溶液),酸碱滴定过程中旧十]的计 算(特别是计量点、突跃范围的计算),影响突跃的因素,指示剂的选择,终点误差的计算。缓冲 溶液的选择及缓冲范围的确定。准确滴定、分步滴定的条件。酸碱滴定法的应用(测混合碱、氨及 磷的原理)。酸滴定中C02的影响 难点:本章最大的难点是利用PBE方程推导十]计算式时近似条件的把握,其次是有关多元酸 碱滴定误差计算,但该问题不是重点。 教学内容 5.1溶液中的酸碱反应与平衡 1.了解酸碱平衡研究的内容以及酸碱平衡研究的手段 2.根据质子理论了解酸碱的定义、共轭酸碱对、酸碱反应的实质 3.理解浓度、活度和活度系数并掌握活度与活度系数的计算方法,物料平衡、电荷平衡和质 子平衡 4.掌握酸碱反应的平衡常数计算。 5.2酸碱组分的平衡浓度及分布分数的计算 1理解分布分数 2.掌握酸碱平衡体系中各型体分布分数的计算 5.3溶液pH的计算 掌握酸碱平衡溶液中H十]计算方法
1. 理解有效数字 2. 掌握有效数字的修约和计算规则 3.3 分析化学中的数据处理 1. 了解频数分布 2. 理解总体、样本、样本容量、自由度、总体标准偏差、正态分布、标准正态分布、t 分布曲线 3. 掌握样本标准偏差、相对标准偏差、平均值的标准偏差的计算公式,随机误差的分 布规律,平均值的置信区间的计算 3.4 显著性检验 掌握显著性检验方法:t检验法、 F检验法 3.5 可疑值取舍 掌握可疑值的取舍方法 3.6 回归分析法 了解一元线性回归方程及相关系数的计算方法 3.7 提高分析结果准确度的方法 掌握提高分析结果准确度的方法 1. 理解t分布曲线 2. 掌握平均值的置信区间的计算 3. 掌握显著性检验及异常值的取舍方法 第四章 分析化学中的质量保证与质量控制(自学) 第五章 酸碱滴定法 重点与难点: 重点:掌握利用分布分数及PBE处理酸碱平衡的基本方法,各种类型酸碱溶液[H+]的计算(强 酸强碱、一元弱酸弱碱、多元酸碱、混合酸碱、两性物质、缓冲溶液),酸碱滴定过程中[H+]的计 算(特别是计量点、突跃范围的计算),影响突跃的因素,指示剂的选择,终点误差的计算。缓冲 溶液的选择及缓冲范围的确定。准确滴定、分步滴定的条件。酸碱滴定法的应用(测混合碱、氮及 磷的原理)。酸滴定中CO2的影响。 难点:本章最大的难点是利用PBE方程推导[H+]计算式时近似条件的把握,其次是有关多元酸 碱滴定误差计算,但该问题不是重点。 教学内容: 5.1 溶液中的酸碱反应与平衡 1. 了解酸碱平衡研究的内容以及酸碱平衡研究的手段 2. 根据质子理论了解酸碱的定义、共轭酸碱对、酸碱反应的实质 3. 理解浓度、活度和活度系数并掌握活度与活度系数的计算方法,物料平衡、电荷平衡和质 子平衡 4. 掌握酸碱反应的平衡常数计算。 5.2 酸碱组分的平衡浓度及分布分数的计算 1. 理解分布分数 2. 掌握酸碱平衡体系中各型体分布分数的计算 5.3 溶液pH的计算 掌握酸碱平衡溶液中[H+]计算方法

5.4对数图解法(了解) 55酸减缓冲溶液 1,理解缓冲溶液的作用原理及缓冲范围 2.掌握其pH值及缓冲容量的计算方法 3.了解常用缓冲溶液的配制和应用 5.6酸碱指示剂 1.理解解指示剂的变色原理。 2.掌握指示剂的选择原则及常用指示剂的变色点、变色范围 3了解得形响指示剂变伍点的因茎。理解混合指示剂的种类、代点 57酸减商定基本原理 1.理解酸碱滴定过程中H十]变化规律并掌握滴定曲线的绘制方法 2.理解滴定突跃其影响因素 3.了解酸碱滴定曲线的意义 4.掌握酸碱能被准确滴定的条件,多元酸碱能否分步滴定的条件 5.8终点误差 掌握终点误差的计算 5.9酸碱滴定法的应用 1.掌握混合碱的测定、铵盐中氨的测定方法 2.了解极弱酸(碱)的滴定 3.理解酸碱滴定法测定磷、氟硅酸钾法测定硅、有机化合物中氨的测定 第六章配位滴定法 重点与难点: 重点:各种副反应系数及条件稳定常数的计算,化学计量点时、计量点前后金属离子浓度的计 算,终点误差的计算,准确滴定、分别滴定的条件,常用指示剂(EBT、XO)的使用条件。 难点:本章许多问题的解决都离不开条件稳定常数的计算,故KY的计算既是本章的终点又是 难点,特别是在有较多副反应的情况下,为此应首先搞清溶液中存在的副反应,计算出相应的副反 应系数 教学内容: 6.1配位滴定中的滴定剂 1.了解简单络合物、整合物 2.理解乙二胺四乙酸螯合物的特点 62配位平衡常数 1.理解络合平衡体系中有关概念及彼此间的关系,包括:稳定常数与不稳定常数,逐级 稳定常数与逐级不稳定常数,累积稳定常数与累积不稳定常数,总稳定常数与总不稳定常 数,平均配位数 2,掌握溶液中各级络合物的分布分数及平均配位数的计算 6.3副反应系数和条件稳定常数 1.了解络合反应中的各种副反应 2.理解酸效应,共存离子效应,络合效应及条件稳定常数 3.掌握络合平衡中各种副反应系数的计算,条件稳定常数的计算 4.了解金属离子缓冲溶液
5.4 对数图解法(了解) 5.5 酸碱缓冲溶液 1. 理解缓冲溶液的作用原理及缓冲范围 2. 掌握其pH值及缓冲容量的计算方法 3. 了解常用缓冲溶液的配制和应用 5.6 酸碱指示剂 1. 理解解指示剂的变色原理. 2. 掌握指示剂的选择原则及常用指示剂的变色点、变色范围 3. 了解影响指示剂变色点的因素。理解混合指示剂的种类、优点 5.7 酸碱滴定基本原理 1. 理解酸碱滴定过程中[H+]变化规律并掌握滴定曲线的绘制方法 2. 理解滴定突跃其影响因素 3. 了解酸碱滴定曲线的意义 4. 掌握酸碱能被准确滴定的条件,多元酸碱能否分步滴定的条件 5.8 终点误差 掌握终点误差的计算 5.9 酸碱滴定法的应用 1. 掌握混合碱的测定、铵盐中氮的测定方法 2. 了解极弱酸(碱)的滴定 3. 理解酸碱滴定法测定磷、氟硅酸钾法测定硅、有机化合物中氮的测定 第六章 配位滴定法 重点与难点: 重点:各种副反应系数及条件稳定常数的计算,化学计量点时、计量点前后金属离子浓度的计 算,终点误差的计算,准确滴定、分别滴定的条件,常用指示剂(EBT、XO)的使用条件。 难点:本章许多问题的解决都离不开条件稳定常数的计算,故KMY ‘的计算既是本章的终点又是 难点,特别是在有较多副反应的情况下,为此应首先搞清溶液中存在的副反应,计算出相应的副反 应系数 教学内容: 6.1 配位滴定中的滴定剂 1. 了解简单络合物、螯合物 2. 理解乙二胺四乙酸螯合物的特点 6.2 配位平衡常数 1. 理解络合平衡体系中有关概念及彼此间的关系,包括:稳定常数与不稳定常数,逐级 稳定常数与逐级不稳定常数,累积稳定常数与累积不稳定常数,总稳定常数与总不稳定常 数,平均配位数 2. 掌握溶液中各级络合物的分布分数及平均配位数的计算 6.3 副反应系数和条件稳定常数 1. 了解络合反应中的各种副反应 2. 理解酸效应,共存离子效应,络合效应及条件稳定常数 3. 掌握络合平衡中各种副反应系数的计算,条件稳定常数的计算 4. 了解金属离子缓冲溶液

6.4配位滴定法的基本原理 1.了解络合滴定曲线的意义 2.掌握滴定曲线的绘制方法(化学计量点前后、计量点时金属离子浓度计算方法),金属 离子指示剂的选择 3.了解影响滴定突跃范围的因素 4.理解金属离子指示剂的作用原理、变色点及指示剂的封闭与僵化 6.5准确滴定与分别滴定判别式 掌握准确滴定判别式及分别滴定判别式 6.6配位滴定中的酸度控制 1.理解缓冲溶液的作用 2.理解并掌握单一离子滴定时的的酸度范围、分别滴定时的酸度范围的确定 6.7提高配位商定选择性的途径 1.了解提高络合滴定选择性的方法 2.草隆常用掩被剂的使用 6.8配位滴定方式及其应用 L.理解配位滴定的方式及其应用 2.掌握配位滴定结果的计算 第七章氧化还原滴定法 重点与难点: 重点:利用能斯特方程计算氧化还原平衡体系中有关电对电极电位,并据此判定反方向及进行 程度,平衡常数的计算,滴定过程中电极电位的计算(特别是化学计量点、突跃范围的计算),指 示剂的选择。高锰酸钾法、重铬酸钾法、碘量法的原理及其应用。 难点:首先是对条件由位概念的理解及计管,为止必须犒清各种副反应(酸度、络合、沉淀等 因素)对氧化氧化还原平衡的影响。其次是滴定分析结果的计算,为此应先根据发生的反应找出滴 定剂于被测物间的计量关系。 教学内容: 71每化不原平衡 1.了解能斯特方程的应用 2.理解标准电位、条件电位 3.掌握电极电位的计算、影响条件电位的因素及其计算。掌握平衡常数的计算、及反应 完全程度的判断 4.理解影响氧化还原反应速度的各种因素、催化反应与诱导反应 72室化还原滴定原理 1理解指示剂的变色原理、变色点及其选择 2了解氧化还原滴定曲线的意义 3.掌握氧化还原滴定曲线的绘制方法 4.了解终点误差的计算 7.3氧化还原滴定的预处理 理解常用预处理用氧化剂、还原剂的使用条件及出去方法 74常用的氧化怀原滴定法 1,掌握高锰酸钾法、重铬酸钾法、碘量法的应用及有关溶液的配制 2.了解其他氧化还原滴定法
6.4 配位滴定法的基本原理 1. 了解络合滴定曲线的意义 2. 掌握滴定曲线的绘制方法(化学计量点前后、计量点时金属离子浓度计算方法),金属 离子指示剂的选择 3. 了解影响滴定突跃范围的因素 4. 理解金属离子指示剂的作用原理、变色点及指示剂的封闭与僵化 6.5 准确滴定与分别滴定判别式 掌握准确滴定判别式及分别滴定判别式 6.6 配位滴定中的酸度控制 1. 理解缓冲溶液的作用 2. 理解并掌握单一离子滴定时的的酸度范围、分别滴定时的酸度范围的确定 6.7 提高配位滴定选择性的途径 1. 了解提高络合滴定选择性的方法 2. 掌握常用掩蔽剂的使用 6.8 配位滴定方式及其应用 1. 理解配位滴定的方式及其应用 2. 掌握配位滴定结果的计算 第七章 氧化还原滴定法 重点与难点: 重点:利用能斯特方程计算氧化还原平衡体系中有关电对电极电位,并据此判定反方向及进行 程度,平衡常数的计算,滴定过程中电极电位的计算(特别是化学计量点、突跃范围的计算),指 示剂的选择。高锰酸钾法、重铬酸钾法、碘量法的原理及其应用。 难点:首先是对条件电位概念的理解及计算,为此必须搞清各种副反应(酸度、络合、沉淀等 因素)对氧化氧化还原平衡的影响。其次是滴定分析结果的计算,为此应先根据发生的反应找出滴 定剂于被测物间的计量关系。 教学内容: 7.1氧化还原平衡 1. 了解能斯特方程的应用 2. 理解标准电位、条件电位 3. 掌握电极电位的计算、影响条件电位的因素及其计算。掌握平衡常数的计算、及反应 完全程度的判断 4. 理解影响氧化还原反应速度的各种因素、催化反应与诱导反应 7.2 氧化还原滴定原理 1. 理解指示剂的变色原理、变色点及其选择 2. 了解氧化还原滴定曲线的意义 3. 掌握氧化还原滴定曲线的绘制方法 4. 了解终点误差的计算 7.3 氧化还原滴定的预处理 理解常用预处理用氧化剂、还原剂的使用条件及出去方法 7.4 常用的氧化还原滴定法 1. 掌握高锰酸钾法、重铬酸钾法、碘量法的应用及有关溶液的配制 2. 了解其他氧化还原滴定法

75氧化还原滴定结果的计算 学握氧化还原滴定结果的计算 第八章沉淀滴定法和滴定分析小结 重点与难点: 重点与难点:莫尔法、佛尔哈德法及法扬司法的原理、滴定条件和应用 教学内容: 8.1沉淀滴定法 1.了解沉淀滴定法的滴定曲线 2.掌握沉淀滴定终点指示剂和沉淀滴定分析方法 8.2滴定分析小结 理解各种滴定分析方法的共同点、不同点及滴定曲线 第九章重量分析法 重点与难点: 重点:影响沉淀溶解度的因素及其计算,不同类型沉淀条件的选择,均匀沉淀法及其优点,表 面吸附共沉淀的吸附规律,重量分析结果的计算。 难点:本章难点是关于溶解度的计算特别是在有如同离子效应、盐效应、络合效应、酸效应的 溶液中。 教学内容: 9.1重量分析法概述 1了翠重量分析法及其分类 2.理解重量分析对沉淀形式与称量形式的要求 92沉淀的溶解度及其显影响因素 1.理解溶解度、溶度积合条件溶度积 2.理解同离子效应、盐效应、酸效应、络合效应 3.掌握影响沉淀溶解度的计算 9.3沉淀的类型和沉淀的形成过程 1,了解沉淀的形成理论和沉淀的形成过程 2理解均相成核、异相成核 9.4影响沉淀纯度的主要因素 1,理解影响沉淀纯度的因素 2.掌握不同类型共沉淀的形成条件表面吸附共沉淀的吸附规律 3.理解减少沉淀玷污的方法 9.5沉淀条件的选择 掌握晶型沉淀的沉淀条件、无定型沉淀的沉淀条件、均匀沉淀法 96有机沉剂 了解有机沉淀剂的分类及其应用 第十章吸光光度法 重点与难点: 重点:朗伯一比尔定律的应用,ε与S的物理意义及其转化,显色条件的选择,吸收曲线与工作 曲线的绘制、作用,测定波长与参比溶液的选择,适宜的吸光度读数范围的控制,示差光度法的原 理及应用。 难点:显色条件的选择
7.5 氧化还原滴定结果的计算 掌握氧化还原滴定结果的计算 第八章 沉淀滴定法和滴定分析小结 重点与难点: 重点与难点:莫尔法、佛尔哈德法及法扬司法的原理、滴定条件和应用 教学内容: 8.1 沉淀滴定法 1. 了解沉淀滴定法的滴定曲线 2. 掌握沉淀滴定终点指示剂和沉淀滴定分析方法 8.2 滴定分析小结 理解各种滴定分析方法的共同点、不同点及滴定曲线 第九章 重量分析法 重点与难点: 重点:影响沉淀溶解度的因素及其计算,不同类型沉淀条件的选择,均匀沉淀法及其优点,表 面吸附共沉淀的吸附规律,重量分析结果的计算。 难点:本章难点是关于溶解度的计算特别是在有如同离子效应、盐效应、络合效应、酸效应的 溶液中。 教学内容: 9.1 重量分析法概述 1. 了解重量分析法及其分类 2. 理解重量分析对沉淀形式与称量形式的要求 9.2沉淀的溶解度及其影响因素 1. 理解溶解度、溶度积合条件溶度积 2. 理解同离子效应、盐效应、酸效应、络合效应 3. 掌握影响沉淀溶解度的计算 9.3 沉淀的类型和沉淀的形成过程 1. 了解沉淀的形成理论和沉淀的形成过程 2. 理解均相成核、异相成核 9.4 影响沉淀纯度的主要因素 1. 理解影响沉淀纯度的因素 2. 掌握不同类型共沉淀的形成条件表面吸附共沉淀的吸附规律 3. 理解减少沉淀玷污的方法 9.5 沉淀条件的选择 掌握晶型沉淀的沉淀条件、无定型沉淀的沉淀条件、均匀沉淀法 9.6 有机沉淀剂 了解有机沉淀剂的分类及其应用 第十章 吸光光度法 重点与难点: 重点:朗伯-比尔定律的应用,ε与S的物理意义及其转化,显色条件的选择,吸收曲线与工作 曲线的绘制、作用,测定波长与参比溶液的选择,适宜的吸光度读数范围的控制,示差光度法的原 理及应用。 难点:显色条件的选择

教学内容: 10.1物质对光的选择性吸收和光吸收的基本定律 1.了解电磁波的分类及吸收光谱产生原理 2.掌握光吸收基本定律,理解摩尔吸光系数与桑德尔灵敏度的意义 3.理解比色法和吸光光度法的的测定方法、特点及其仪器 10.2分光光度计及吸收光谱 1.了解分光光度计的基本组成部分 2.理解吸收曲线及其意义 10.3显色反应及其影响因素 1.理解显色反应及显色条件的选择 2.了解生色团与助色团、多元络合物 10.4吸光光度分析及误差控制 1,掌握测量波长和吸光度范围的选择、参比溶液的选择、标准曲线的制作 2.理解偏离Lambert-一Beer定律的原因 3.掌握吸光度的测量误差的计算 10.5其他吸光光度法 1.掌握示差光度法的原理及其应用 2.理解双波长吸光光度法的测定原理及其应用 10.6吸光光度分析法的应用 掌握弱酸弱碱离解常数的测定方法及络合物组成的测定方法 第十一章分析化学中常用的分离与富集方法 重点与难点: 分配比、分配系数、萃取百分率的有关计算,阴离子、阳离子交换数树脂的种类、使用条 件,比移值的计算。 教学内容 11.1概述 理解分析化学中进行分离和富集的必要性,理解回收率的概念 112气态分离法 掌握挥发和蒸馏分离法的原理 11.3沉淀与过滤分离 1,了解常用的沉淀剂与共沉淀剂及其应用。 2.掌握沉淀分离法的原理 11.4萃取分离法 1,理解液液萃取分离法的实质,掌握分配系数、分配比、萃取百分率的概念及计算。 2.了解重要萃取体系,萃取条件的选择及萃取分离技术。 11.5离子交换分离法 1.理解离子交换分离法的原理,了解离子交换剂的性质和种类,理解交联度与交换 容量的概念及其与树脂交换性能的关系。掌握影响亲和力的因素 2了解离子交换分离快作及其应用。 1.6色谱分离法 了解纸色谱、薄层色谱、反相分配色谱的原理及其应用。掌握比移值的计算 (二)实践教学的内容及要求
教学内容: 10.1 物质对光的选择性吸收和光吸收的基本定律 1. 了解电磁波的分类及吸收光谱产生原理 2. 掌握光吸收基本定律,理解摩尔吸光系数与桑德尔灵敏度的意义 3. 理解比色法和吸光光度法的的测定方法、特点及其仪器 10.2 分光光度计及吸收光谱 1. 了解分光光度计的基本组成部分 2. 理解吸收曲线及其意义 10.3 显色反应及其影响因素 1. 理解显色反应及显色条件的选择 2. 了解生色团与助色团、多元络合物 10.4 吸光光度分析及误差控制 1. 掌握测量波长和吸光度范围的选择、参比溶液的选择、标准曲线的制作 2. 理解偏离Lambert—Beer定律的原因 3. 掌握吸光度的测量误差的计算 10.5 其他吸光光度法 1. 掌握示差光度法的原理及其应用 2. 理解双波长吸光光度法的测定原理及其应用 10.6 吸光光度分析法的应用 掌握弱酸弱碱离解常数的测定方法及络合物组成的测定方法 第十一章 分析化学中常用的分离与富集方法 重点与难点: 分配比、分配系数、萃取百分率的有关计算,阴离子、阳离子交换数树脂的种类、使用条 件,比移值的计算。 教学内容: 11.1 概述 理解分析化学中进行分离和富集的必要性,理解回收率的概念 11.2 气态分离法 掌握挥发和蒸馏分离法的原理 11.3 沉淀与过滤分离 1. 了解常用的沉淀剂与共沉淀剂及其应用。 2. 掌握沉淀分离法的原理 11.4 萃取分离法 1. 理解液液萃取分离法的实质,掌握分配系数、分配比、萃取百分率的概念及计算。 2. 了解重要萃取体系,萃取条件的选择及萃取分离技术。 11.5 离子交换分离法 1. 理解离子交换分离法的原理,了解离子交换剂的性质和种类,理解交联度与交换 容量的概念及其与树脂交换性能的关系。掌握影响亲和力的因素 2. 了解离子交换分离操作及其应用。 11.6 色谱分离法 了解纸色谱、薄层色谱、反相分配色谱的原理及其应用。掌握比移值的计算 (二) 实践教学的内容及要求
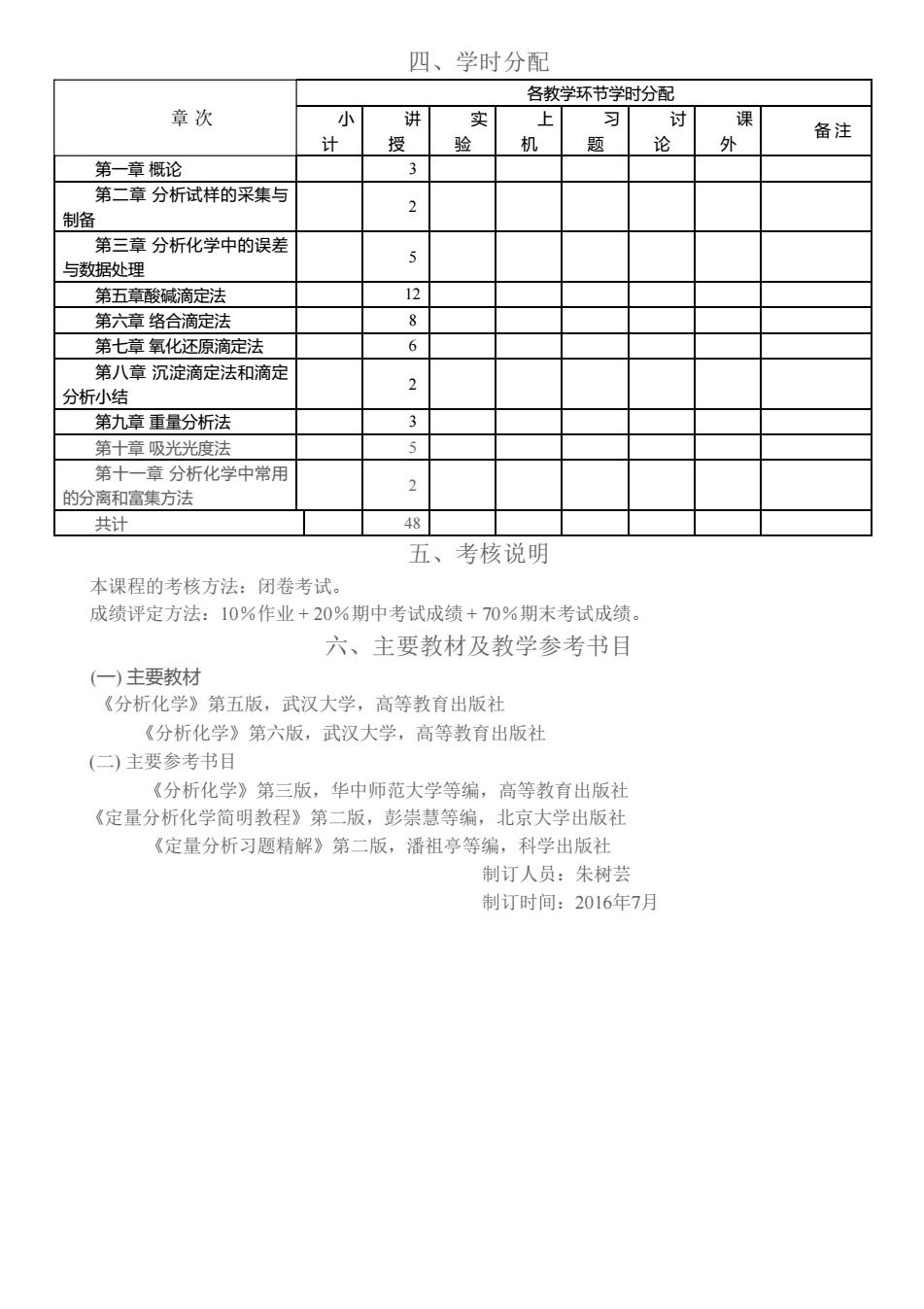
四、学时分配 名教学环节学时分卫 章次 上 习 课 授 机 题 论 备注 第一章概论 3 第二章分析试样的采集与 2 制备 第三章分析化学中的误差 与数据处理 第五章酸碱滴定法 第六章络合滴定法 8 第七章氧化还原滴定法 6 第八章沉淀滴定法和滴定 2 分析小结 第九章重量分析法 3 第十章吸光光度法 第 章分析化学中常用 的分离和富集方法 共计 48 五、考核说明 本课程的考核方法:闭卷考试。 成绩评定方法:10%作业+20%期中考试成绩+70%期末考试成绩。 六、主要教材及教学参考书目 (一)主要教材 《分析化学》第五版,武汉大学,高等教育出版社 《分析化学》第六版,武汉大学,高等教育出版社 (仁)主要参考书目 《分析化学》第三版,华中师范大学等编,高等教有出版社 《定量分析化学简明教程》第二版,彭崇慧等编,北京大学出版社 《定量分析习题精解》第二版,潘祖亭等编,科学出版社 制订人员:朱树芸 制订时间:2016年7月
四、学时分配 章 次 各教学环节学时分配 小 计 讲 授 实 验 上 机 习 题 讨 论 课 外 备 注 第一章 概论 3 第二章 分析试样的采集与 制备 2 第三章 分析化学中的误差 与数据处理 5 第五章酸碱滴定法 12 第六章 络合滴定法 8 第七章 氧化还原滴定法 6 第八章 沉淀滴定法和滴定 分析小结 2 第九章 重量分析法 3 第十章 吸光光度法 5 第十一章 分析化学中常用 的分离和富集方法 2 共计 48 五、考核说明 本课程的考核方法:闭卷考试。 成绩评定方法:10%作业 + 20%期中考试成绩 + 70%期末考试成绩。 六、主要教材及教学参考书目 (一) 主要教材 《分析化学》第五版,武汉大学,高等教育出版社 《分析化学》第六版,武汉大学,高等教育出版社 (二) 主要参考书目 《分析化学》第三版,华中师范大学等编,高等教育出版社 《定量分析化学简明教程》第二版,彭崇慧等编,北京大学出版社 《定量分析习题精解》第二版,潘祖亭等编,科学出版社 制订人员:朱树芸 制订时间:2016年7月