
药品监督管理统计年度报告 (2020年) 国家药品监督管理局综合和规划财务司 国家药品监督管理局信息中心 2021年4月
2020 国家药品监督管理局综合和规划财务司 国家药品监督管理局信息中心 2021 年 4 月

说明 本报告所用数据来源于药品监督管理统计调查制度的 月报、季报和年报。除特殊说明外,数据报告期为2020年1 月1日至2020年12月31日。报告分别对药品、医疗器械、 化妆品的相关行政受理、审批、监管等情况进行了汇总分析, 供参考
本报告所用数据来源于药品监督管理统计调查制度的 月报、季报和年报。除特殊说明外,数据报告期为 2020 年 1 月 1 日至 2020 年 12 月 31 日。报告分别对药品、医疗器械、 化妆品的相关行政受理、审批、监管等情况进行了汇总分析, 供参考

目录 第一部分药品监督管理1 一、药品行政受理情况 … (一)国家局行政受理情况 (二)省局行政受理情况.1 二、药品注册审批情况.1 (一)新药临床申请及按新药临床申请程序申报的审批情况..1 (二)创新药申请的审批情况 .2 (三)进口药品申请的审批情况… 2 (四)仿制药申请的审批情况 .2 (五)药品再注册申请的审批情况. 2 (六)药品补充申请的审批情况 2 (七)进口药材审批情况… .2 (八)按药品管理的体外诊断试剂的审批情况 2 (九)国产、进口药品批准文号情况 2 三、药品标准制修订情况… .3 四、药品生产企业情况 3 五、药品经营企业情况… 4 六、药品日常监管情况 4 (一)药品生产企业日常监管情况 4 (二)药品经营企业日常监管情况 4 七、国家药品抽检情况 .5 八、地方药品抽检情况… 5 九、进口药品检验情况 5 十、药品不良反应监测、处理及安全性评价情况…S 十一、药品案件查处情况.6 十二、药品包装材料案件查处情况… 9 十三、麻醉药品、精神药品和药品类易制毒化学品生产经营情况…9 (一)麻醉药品、精神药品和药品类易制毒化学品生产定点情况…9 (二)麻醉药品、精神药品和药品类易制毒化学品经营定点情况.…10
目 录 第一部分 药品监督管理 ..................................................................................... 1 一、药品行政受理情况 ......................................................................................... 1 (一)国家局行政受理情况 ................................................................................. 1 (二)省局行政受理情况 ..................................................................................... 1 二、药品注册审批情况 ......................................................................................... 1 (一)新药临床申请及按新药临床申请程序申报的审批情况 ......................... 1 (二)创新药申请的审批情况 ............................................................................. 2 (三)进口药品申请的审批情况 ......................................................................... 2 (四)仿制药申请的审批情况 ............................................................................. 2 (五)药品再注册申请的审批情况 ..................................................................... 2 (六)药品补充申请的审批情况 ......................................................................... 2 (七)进口药材审批情况 ..................................................................................... 2 (八)按药品管理的体外诊断试剂的审批情况 ................................................. 2 (九)国产、进口药品批准文号情况 ................................................................. 2 三、药品标准制修订情况 ..................................................................................... 3 四、药品生产企业情况 ......................................................................................... 3 五、药品经营企业情况 ......................................................................................... 4 六、药品日常监管情况 ......................................................................................... 4 (一)药品生产企业日常监管情况 ..................................................................... 4 (二)药品经营企业日常监管情况 ..................................................................... 4 七、国家药品抽检情况 ......................................................................................... 5 八、地方药品抽检情况 ......................................................................................... 5 九、进口药品检验情况 ......................................................................................... 5 十、药品不良反应监测、处理及安全性评价情况 ............................................. 5 十一、药品案件查处情况 ..................................................................................... 6 十二、药品包装材料案件查处情况 ..................................................................... 9 十三、麻醉药品、精神药品和药品类易制毒化学品生产经营情况 ................. 9 (一)麻醉药品、精神药品和药品类易制毒化学品生产定点情况 ................. 9 (二)麻醉药品、精神药品和药品类易制毒化学品经营定点情况 ............... 10

第二部分医疗器械监督管理 …11 、医疗器械注册情况 11 (一)医疗器械行政受理情况 11 (二)医疗器械产品注册情况.… 11 二、医疗器械标准制修订情况 12 三、医疗器械生产企业情况 12 四、医疗器械经营企业情况…。 12 五、医疗器械日常监管情况… 13 六、地方医疗器械抽验情况 。。。。。。 14 七、医疗器械不良事件监测情况 14 八、医疗器械案件查处情况 14 第三部分化妆品监督管理 ..17 一、化妆品行政受理事项情况 11 二、化妆品审批情况… 17 三、化妆品生产企业许可情况 17 四、化妆品日常监管情况 17 五、化妆品案件查处情况.… 18 第四部分其他… .19 一、科研情况.… 19 二、检查员情况 19 (一)药品GMP检查员情况 19 (二)药品GSP检查员情况 19 (三)医疗器械GMP检查员情况 . 20 (四)化妆品检查员情况. 20 三、执业药师情况 20 四、行政复议和行政诉讼情况 21 (一)行政复议案件情况…。 21 (二)行政诉讼案件情况… 22
第二部分 医疗器械监督管理 ............................................................................11 一、医疗器械注册情况 ....................................................................................... 11 (一)医疗器械行政受理情况 ........................................................................... 11 (二)医疗器械产品注册情况 ........................................................................... 11 二、医疗器械标准制修订情况 ........................................................................... 12 三、医疗器械生产企业情况 ............................................................................... 12 四、医疗器械经营企业情况 ............................................................................... 12 五、医疗器械日常监管情况 ............................................................................... 13 六、地方医疗器械抽验情况 ............................................................................... 14 七、医疗器械不良事件监测情况 ....................................................................... 14 八、医疗器械案件查处情况 ............................................................................... 14 第三部分 化妆品监督管理 ............................................................................... 17 一、化妆品行政受理事项情况 ........................................................................... 17 二、化妆品审批情况 ........................................................................................... 17 三、化妆品生产企业许可情况 ........................................................................... 17 四、化妆品日常监管情况 ................................................................................... 17 五、化妆品案件查处情况 ................................................................................... 18 第四部分 其他 ................................................................................................... 19 一、科研情况 ....................................................................................................... 19 二、检查员情况 ................................................................................................... 19 (一)药品 GMP 检查员情况............................................................................. 19 (二)药品 GSP 检查员情况.............................................................................. 19 (三)医疗器械 GMP 检查员情况..................................................................... 20 (四)化妆品检查员情况 ................................................................................... 20 三、执业药师情况 ............................................................................................... 20 四、行政复议和行政诉讼情况 ........................................................................... 21 (一)行政复议案件情况 ................................................................................... 21 (二)行政诉讼案件情况 ................................................................................... 22

第一部分 药品监督管理 一、药品行政受理情况 (一)国家局行政受理情况 2020年国家局受理进口(含港澳台)药品临床试验申请587件, 上市申请300件,再注册申请320件,补充申请3685件;受理国产 药品临床试验申请1099件,上市申请1076件,补充申请1520件; 受理仿制药质量和疗效一致性评价申请881件,临时进口申请489 件。详见附表1。 2020年国家局受理中药保护品种初次保护申请7件,同品种申 请0件,延长保护期申请5件,补充申请0件。详见附表2。 (二)省局行政受理情况 2020年各省(区、市)局受理药品补充审批申请3397件,受 理药品补充备案申请25638件;受理再注册申请90094件。受理进 口药材首次申请108件,非首次申请337件,补充申请6件。详见 附表3。 二、药品注册审批情况 (一)新药临床申请及按新药临床申请程序申报的审批情况 2020年国家局共批准新药临床879件(不包含进口药品),其 中中药天然药物9件,化学药品647件,生物制品223件;共批准 按新药申请程序申报临床申请181件,其中中药天然药物11件,化 学药品97件,生物制品73件。详见附表4
1 第一部分 药品监督管理 一、药品行政受理情况 (一)国家局行政受理情况 2020 年国家局受理进口(含港澳台)药品临床试验申请 587 件, 上市申请 300 件,再注册申请 320 件,补充申请 3685 件;受理国产 药品临床试验申请 1099 件,上市申请 1076 件,补充申请 1520 件; 受理仿制药质量和疗效一致性评价申请 881 件,临时进口申请 489 件。详见附表 1。 2020 年国家局受理中药保护品种初次保护申请 7 件,同品种申 请 0 件,延长保护期申请 5 件,补充申请 0 件。详见附表 2。 (二)省局行政受理情况 2020 年各省(区、市)局受理药品补充审批申请 3397 件,受 理药品补充备案申请 25638 件;受理再注册申请 90094 件。受理进 口药材首次申请 108 件,非首次申请 337 件,补充申请 6 件。详见 附表 3。 二、药品注册审批情况 (一)新药临床申请及按新药临床申请程序申报的审批情况 2020 年国家局共批准新药临床 879 件(不包含进口药品),其 中中药天然药物 9 件,化学药品 647 件,生物制品 223 件;共批准 按新药申请程序申报临床申请 181 件,其中中药天然药物 11 件,化 学药品 97 件,生物制品 73 件。详见附表 4

(二)创新药申请的审批情况 2020年共批准创新药临床品种1096个,批准创新药生产品种 20个。详见附表5。 (三)进口药品申请的审批情况 2020年共批准进口药品临床604件,上市128件。详见附表6。 (四)仿制药申请的审批情况 2020年共批准仿制药临床41件,生产722件。详见附表7。 (五)药品再注册申请的审批情况 2020年全国各省(区、市)局共批准国产药品再注册93667件, 国家局共批准进口药品再注册453件。详见附表8。 (六)药品补充申请的审批情况 2020年国家局共批准药品补充申请5124件,备案2807。全国 各省(区、市)局共批准药品补充申请3052件,备案24136件。详 见附表9。 (七)进口药材审批情况 2020年共批准进口药材首次申请58件,非首次申请604件, 补充申请8件。详见附表10。 (八)按药品管理的体外诊断试剂的审批情况 2020年共批准按药品管理的体外诊断试剂生产申请1件,再注 册申请2件,补充申请12件。详见附表11。 (九)国产、进口药品批准文号情况 截至2020年底,全国共有国产药品批准文号数量156355件
2 (二)创新药申请的审批情况 2020 年共批准创新药临床品种 1096 个,批准创新药生产品种 20 个。详见附表 5。 (三)进口药品申请的审批情况 2020 年共批准进口药品临床 604 件,上市 128 件。详见附表 6。 (四)仿制药申请的审批情况 2020 年共批准仿制药临床 41 件,生产 722 件。详见附表 7。 (五)药品再注册申请的审批情况 2020 年全国各省(区、市)局共批准国产药品再注册 93667 件, 国家局共批准进口药品再注册 453 件。详见附表 8。 (六)药品补充申请的审批情况 2020 年国家局共批准药品补充申请 5124 件,备案 2807。全国 各省(区、市)局共批准药品补充申请 3052 件,备案 24136 件。详 见附表 9。 (七)进口药材审批情况 2020 年共批准进口药材首次申请 58 件,非首次申请 604 件, 补充申请 8 件。详见附表 10。 (八)按药品管理的体外诊断试剂的审批情况 2020 年共批准按药品管理的体外诊断试剂生产申请 1 件,再注 册申请 2 件,补充申请 12 件。详见附表 11。 (九)国产、进口药品批准文号情况 截至 2020 年底,全国共有国产药品批准文号数量 156355 件

进口药品注册证4269件。详见附表12。 三、药品标准制修订情况 2020年新颁药典标准0项,修订0项;新颁局颁标准23项, 修订98项。截至2020年底,共有药典标准7347项,局颁标准22648 项。详见附表13。 四、药品生产企业情况 截至2020年底,全国有效期内药品生产企业许可证7690个(含 中药饮片、医用气体等)。从所生产产品类别看,生产原料药和制 剂的企业有4460家,生产化学药的企业有3519家,生产中成药的 企业有2160家,生产中药(含饮片)企业4357家,生产医用气体 的企业有671家,生产特殊药品的企业有224家。详见附表14。 ◆药品生产许可证数量 ■原料药和制剂企业数量 7580 7814 7347 7226 7409 7623 7690 69517132 6802 4629 47474875 50005065 4176437644414529 4460 2011年2012年2013年2014年2015年2016年2017年2018年2019年2020年 图1-12011-2020年药品生产企业数量变化趋势单位:件,家 '药品生产企业类别依据药品生产许可证上的分类码进行统计,生产多种类别的企业则各类分别统计。如,既生产化学 药又生产诊断试剂,则分别填入化学药和诊断试剂项下。2020年7月1日前发证的按原分类码统计,2020年7月1日 之后发证的按现分类码统计,许可证数量为二者之和, 3
3 进口药品注册证 4269 件。详见附表 12。 三、药品标准制修订情况 2020 年新颁药典标准 0 项,修订 0 项;新颁局颁标准 23 项, 修订 98 项。截至 2020 年底,共有药典标准 7347 项,局颁标准 22648 项。详见附表 13。 四、药品生产企业情况 截至 2020 年底,全国有效期内药品生产企业许可证 7690 个(含 中药饮片、医用气体等)。从所生产产品类别看1,生产原料药和制 剂的企业有 4460 家,生产化学药的企业有 3519 家,生产中成药的 企业有 2160 家,生产中药(含饮片)企业 4357 家,生产医用气体 的企业有 671 家,生产特殊药品的企业有 224 家。详见附表 14。 图 1-1 2011-2020 年药品生产企业数量变化趋势 单位:件,家 1药品生产企业类别依据药品生产许可证上的分类码进行统计,生产多种类别的企业则各类分别统计。如,既生产化学 药又生产诊断试剂,则分别填入化学药和诊断试剂项下。2020 年 7 月 1 日前发证的按原分类码统计,2020 年 7 月 1 日 之后发证的按现分类码统计,许可证数量为二者之和

五、药品经营企业情况 截至2020年底,全国共有《药品经营许可证》持证企业57.33 万家。其中,零售药店24.10万家,占经营企业数量的42.03%,零 售连锁企业和门店数量31.92万家,占比55.68%,批发企业1.31 万家,占比2.29%。详见附表15、16。 544132573295 440248443125451129452460466546465618472293508332 2011年2012年2013年2014年2015年2016年2017年2018年2019年2020年 图1-22010-2019年药品经营企业情况单位:家 六、药品日常监管情况 (一)药品生产企业日常监管情况2 2020年各级监管机构共检查药品生产企业1.99万家次,发现违 法的生产企业202家次,发现违规的生产企业2293家次,完成整改 3262家次,立案查处284家次。详见附表17。 (二)药品经营企业日常监管情况 2020年各级监管机构共检查药品经营企业304.25万家次。其中, 检查批发企业4.75万家次,发现存在违反药品经营相关管理规定行 2在填报年报数据时,部分填报机枸对“两品一械”的日常监管数据进行修正,数据以年报为准, 4
4 五、药品经营企业情况 截至 2020 年底,全国共有《药品经营许可证》持证企业 57.33 万家。其中,零售药店 24.10 万家,占经营企业数量的 42.03%,零 售连锁企业和门店数量 31.92 万家,占比 55.68% ,批发企业 1.31 万家,占比 2.29%。详见附表 15、16。 图 1-2 2010-2019 年药品经营企业情况 单位:家 六、药品日常监管情况 (一)药品生产企业日常监管情况2 2020 年各级监管机构共检查药品生产企业 1.99 万家次,发现违 法的生产企业 202 家次,发现违规的生产企业 2293 家次,完成整改 3262 家次,立案查处 284 家次。详见附表 17。 (二)药品经营企业日常监管情况 2020年各级监管机构共检查药品经营企业304.25万家次。其中, 检查批发企业 4.75 万家次,发现存在违反药品经营相关管理规定行 2 在填报年报数据时,部分填报机构对“两品一械”的日常监管数据进行修正,数据以年报为准

为的企业5855家次,完成整改6451家次。检查零售企业299.50万 家次,发现存在违反药品经营相关管理规定行为的企业8.49万家次, 完成整改9.18万家次。详见附表18。 七、国家药品抽检情况 2020年按照国家抽检计划抽检1.82万批次,不合格104批次, 总不合格率为0.57%。化学药品、中成药、中药饮片、生物制品、 药品包装材料和药用辅料的不合格率分别为0.43%、0.54%、1.97%、 0.00%、/和0.00%。详见附表19。 八、地方药品抽检情况 2020年各省(区、市)共检验药品19.38万批次,不合格1079 批次,不合格率0.56%。详见附表20。 九、进口药品检验情况 2020年中检院及19个口岸药检所对6935批次、105.02亿美元 的申请进口药品进行了检验,检验不合格167批次,占总批次的 2.41%,不合格药品金额达3760.41万美元。 进口药品检验情况详见附表21~23。 十、药品不良反应监测、处理及安全性评价情况 2020年国家药品不良反应监测中心共收到药品不良反应报告 167.58万份。其中严重病例16.74万件,死亡病例报告1489件。不 良反应报告处理数量10件。不良反应报告按来源见图1-3。详见附 表24、25
5 为的企业 5855 家次,完成整改 6451 家次。检查零售企业 299.50 万 家次,发现存在违反药品经营相关管理规定行为的企业 8.49 万家次, 完成整改 9.18 万家次。详见附表 18。 七、国家药品抽检情况 2020 年按照国家抽检计划抽检 1.82 万批次,不合格 104 批次, 总不合格率为 0.57%。化学药品、中成药、中药饮片、生物制品、 药品包装材料和药用辅料的不合格率分别为 0.43%、0.54%、1.97%、 0.00%、/和 0.00%。详见附表 19。 八、地方药品抽检情况 2020 年各省(区、市)共检验药品 19.38 万批次,不合格 1079 批次,不合格率 0.56%。详见附表 20。 九、进口药品检验情况 2020 年中检院及 19 个口岸药检所对 6935 批次、105.02 亿美元 的申请进口药品进行了检验,检验不合格 167 批次,占总批次的 2.41%,不合格药品金额达 3760.41 万美元。 进口药品检验情况详见附表 21~23。 十、药品不良反应监测、处理及安全性评价情况 2020 年国家药品不良反应监测中心共收到药品不良反应报告 167.58 万份。其中严重病例 16.74 万件,死亡病例报告 1489 件。不 良反应报告处理数量 10 件。不良反应报告按来源见图 1-3。详见附 表 24、25
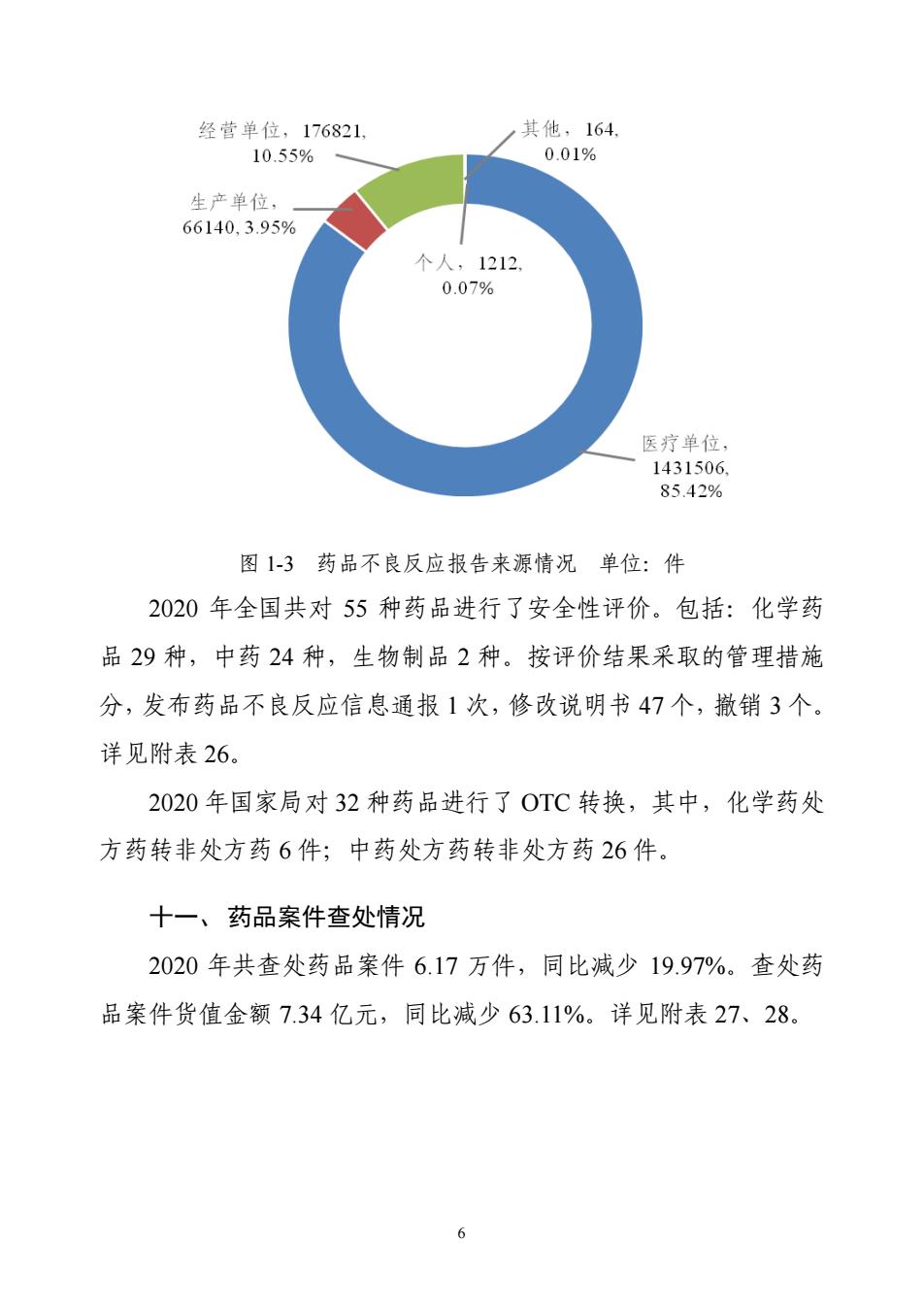
经营单位,176821, 其他,164. 10.55% 0.01% 生产单位, 66140,3.95% 个人,1212 0.07% 医疗单位, 1431506. 85.42% 图1-3药品不良反应报告来源情况单位:件 2020年全国共对55种药品进行了安全性评价。包括:化学药 品29种,中药24种,生物制品2种。按评价结果采取的管理措施 分,发布药品不良反应信息通报1次,修改说明书47个,撤销3个。 详见附表26。 2020年国家局对32种药品进行了0T℃转换,其中,化学药处 方药转非处方药6件;中药处方药转非处方药26件。 十一、药品案件查处情况 2020年共查处药品案件6.17万件,同比减少19.97%。查处药 品案件货值金额7.34亿元,同比减少63.11%。详见附表27、28。 6
6 图 1-3 药品不良反应报告来源情况 单位:件 2020 年全国共对 55 种药品进行了安全性评价。包括:化学药 品 29 种,中药 24 种,生物制品 2 种。按评价结果采取的管理措施 分,发布药品不良反应信息通报 1 次,修改说明书 47 个,撤销 3 个。 详见附表 26。 2020 年国家局对 32 种药品进行了 OTC 转换,其中,化学药处 方药转非处方药 6 件;中药处方药转非处方药 26 件。 十一、药品案件查处情况 2020 年共查处药品案件 6.17 万件,同比减少 19.97%。查处药 品案件货值金额 7.34 亿元,同比减少 63.11%。详见附表 27、28