
篇 生物大分子的结构与功能 本篇主要涉及生物机体重要生物大分子的结构与功能,包括蛋白质、核酸和酶等内 容,共3章。 机体是由数以亿万计分子量大小不等的分子组成。参与机体构成并发挥重要生理功 能的生物大分子尽管分子很大,但通常都由一定的种类不多的小分子基本结构单位组成 并按一定的排列顺序和连接方式而形成多聚体。 蛋白质是体内主要的生物大分子。机体的各项功能、各种性状都是由种类繁多、特定 的蛋白质分子来实现。酶是一类具有催化功能的重要蛋白质分子,体内几乎所有的化学 反应都由特定的酶来催化,使机体的物质代谢得以顺利进行。 核酸是体内另一类重要的生物大分子,具有储存和传递遗传信息等功能。核酸和蛋 白质两类生物大分子相互配合,使遗传信息得以表达,是生长、繁殖、物质代谢等生命现象 的基础。 学习本篇内容时,应首先认识体内上述生物大分子的结构特性、功能,重点是结构与 功能的关系,为后续内容的学习打下基础。 5

第一章蛋自质的结构与功能 学习目 通过本章的学习,你应该能够: 掌握蛋白质的元素组成特点,等电点概念。蛋白质一级结构的概念及其主要 的化学健,蛋白质三级结构的概念和维持其稳定的化学键。蛋白质一级 结构与高级结构以及功能三者之间的关系并能举例说明。蛋白质变性的 将令及其在医学卜的应用 熟悉蛋白质二级结构的概念、主要化学键及二级结构的主要形式。蛋白质别 构效应的概念。蛋白质的两性电离特性和等电点的概念,蛋白质的胶体 性质及其稳定因素,紫外吸收特性。 了解氨基酸的结构特点和分类,氨基酸的常见理化性质,包括两性电离、紫外 吸收特性和茚三酮显色反应等。肽、肽键与肽链的概念,多肽链的写法 几种重要的生物活性肽。蛋白质的分类。α-螺旋、B折叠、B转角和不规 则卷曲的结构特点,模序的概念。结构域、分子伴侣的概念。蛋白质四级 结构的概念和维持其稳定的化学键、亚基的概念。分子病、蛋白质构象疾 病的概念及分子机制,血红蛋白和肌红蛋白的分子结构。蛋白质复性、凝 固的概念,蛋白质的呈色反应。常用的蛋白质分离纯化技术。 蛋白质(protein)是细胞组分中含量最丰富,功能最多的生物大分子物质,也是生命活动的重要物 质基础。人体内蛋白质约占固体成分的45%,约有十万余种。各种蛋白质的分子结构千差万别,决 定了蛋白质功能的多样性,从而担负起参与并完成以复杂的物质代谢为基础的生命活动重任。生物 体内的酶、若干凝血因子、抗体、肽类激素、转运蛋白、收缩蛋白、基因调控蛋白等都是蛋白质,但结 构与功能截然不同。它们在物质代谢、血液凝固、机体防御、生长发育、物质转运、肌肉收缩、信号 转导等方面发挥着不可替代的重要作用。蛋白质之所以具有如此复杂重要的功能与蛋白质的结 构关系密切。本章将主要阐述蛋白质的结构特征,蛋白质结构与功能的关系,以及蛋白质重要的 理化性质。 第一节蛋白质的分子组成 一、蛋白质的元素组成 尽管蛋白质的种类繁多,结构各异,但元素组成相似,主要有碳(50%~55%)、氢(6%~7%)、氧
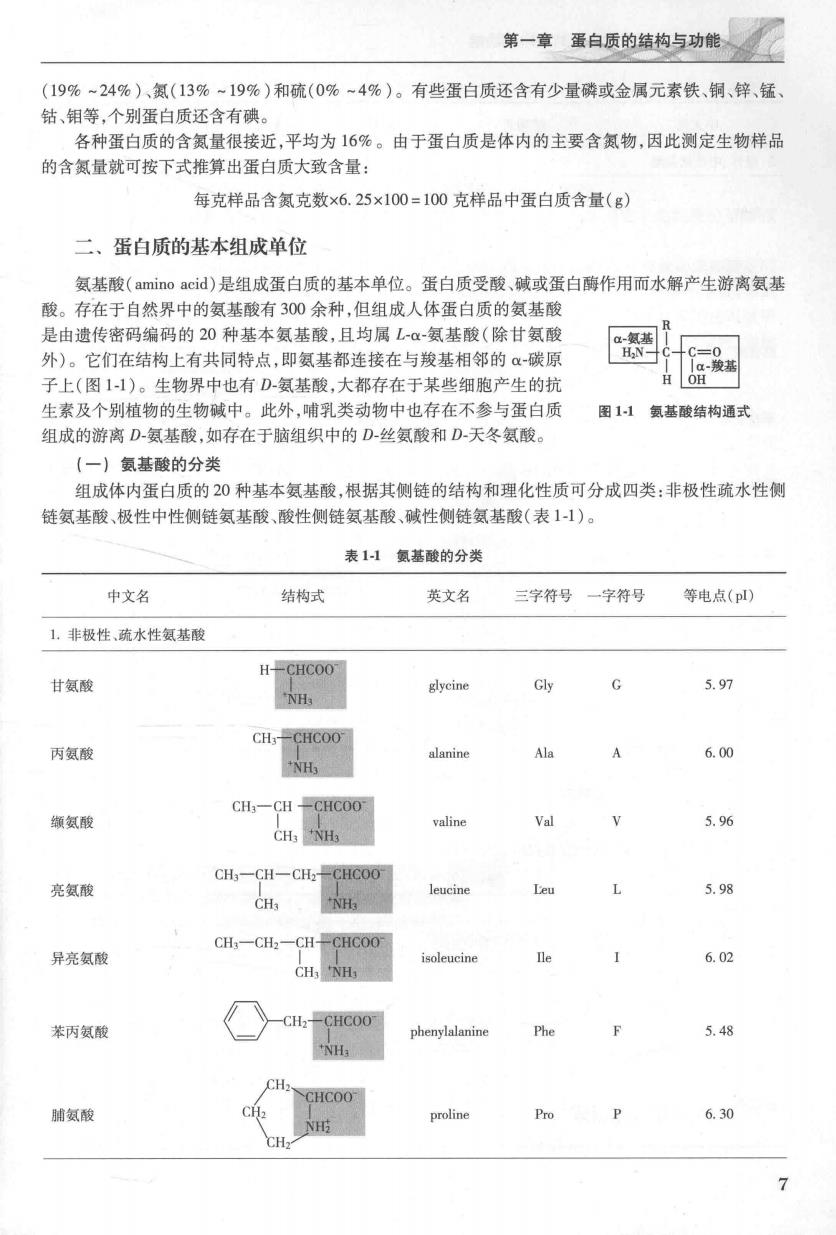
第一章蛋白质的结的与功能 (199%~24%)、氮(13%~19%)和硫(0%~4%)。有些蛋白质还含有少量磷或金属元素铁、铜、锌、锰 钴、钼等,个别蛋白质还含有碘。 各种蛋白质的含氮量很接近,平均为16%。由于蛋白质是体内的主要含氮物,因此测定生物样品 的含氮量就可按下式推算出蛋白质大致含量: 每克样品含氮克数×6.25×100=100克样品中蛋白质含量(g) 二、蛋白质的基本组成单位 氨基酸(amino acid)是组成蛋白质的基本单位。蛋白质受酸、碱或蛋白酶作用而水解产生游离氨基 酸。存在于自然界中的氨基酸有300余种,但组成人体蛋白质的氨基酸 是由遗传密码编码的20种基本氨基酸,且均属L-α-氨基酸(除甘氨酸 外)。它们在结构上有共同特点,即氨基都连接在与羧基相邻的α-碳原 子上(图11)。生物界中也有D-氨基酸,大都存在于某些细胞产生的抗 生素及个别植物的生物碱中。此外,哺乳类动物中也存在不参与蛋白质 图11氨基酸结构通式 组成的游离D氨基酸,如存在于脑组织中的D-丝氨酸和D-天冬氨酸。 (一)氨基酸的分类 组成体内蛋白质的20种基本氨基酸,根据其侧链的结构和理化性质可分成四类:非极性疏水性侧 链氨基酸、极性中性侧链氨基酸、酸性侧链氨基酸、碱性侧链氨基酸(表1-1)。 表11氨基酸的分类 中文名 结构式 英文名 三字符号一字符号 等电点(pl) 1非极性、疏水性氨基酸 甘氨酸 H-CHCOO glycine Gly 5.97 丙氨酸 CH-CHCOO alanine Ala A 6.00 NH、 CH:-CH -CHCOO 缬氨酸 valine 5.96 CH3-CH-CHz-CHCOO 亮氨酸 leucine Leu L 5.9 CH NH CH3-CH2-CH-CHCOO 异亮氨酸 isoleucine 6.02 苯丙氨酸 -CH2-CHCOO phenylalanine Phe F 5.48 NH. CHCOO 脯氨酸 proline Pro 6.30 CH

第一篇生物大分子的结构与功能 续表 中文名 结构式 英文名三字符号一字符号等电点(p) 2.极性、中性氨基酸 色氨酸 HO-CH 丝氨酸 serine 5.68 酪氨酸 -CH:-CHCOO Tyr 5.6 HS-CH2-CHCOO 半胱氨酸 cysteine 5.0m CH:SCHCH -CHCOO 蛋氨酸 methionine Me 5.74 -CH 天冬酰胺 asparagine Asn 5.41 谷氨酰胺 -CHCOO glutamine 5.6的 苏氨酸 560 3.酸性氨基酸 天冬氨酸 HOOCCH -CHCOO aspartie acid NH Asp D 2.97 HOOCCH-CH2-CHCOO 谷氨酸 glutamic acid Glu 32 NH 4.碱性氨基酸 NH-CH.CH.CH.CHz -CHCOO 赖氨酸 lysine 9.74 NH 精氨酸 NHCNHCH.CH.CH arginine 10.76 -CH:CHCOO 组氨酸 histidine His H 7.59

第一章蛋白质的结构与功能 1.非极性疏水性氨基酸这类氨基酸的侧链R基团为非极性,具有大小不一的疏水性,在水溶液 中的溶解度小于极性中性氨基酸 2.极性中性氨基酸这类氨基酸的侧链上有轻基或硫基、酰被基等极性基团,具有亲水性,但在中 性水溶液中侧链R基团不解离。 3.酸性氨基酸 酸性氨基酸的R基团含有羧基,易解离出H而具有酸性 4.碱性氨基酸碱性氨基酸的R基团含有氨基、胍基或咪唑基。这些基团质子化而使分子带正 电荷 此外,在蛋白质翻译后的修饰过程中一些氨基酸残基被修饰,脯氨酸和赖氨酸可被修饰成羟明氨酸 和羟赖氨酸,它们存在于骨胶原和弹性硬蛋白质中。2个半胱氨酸通过脱氢后可以二硫键相结合,形成 胱氨酸。蛋白质中有不少半胱氨酸以胱氨酸形式存在。蛋白质分子中氨基酸残基的某些基团还可被甲 基化、甲酰化、乙酰化、异戊二烯化和磷酸化等。这些翻译后修饰,可改变蛋白质的溶解度、稳定性、亚细 胞定位和与其他细胞蛋白质的相互作用的性质等,体现了蛋白质生物多样性的一个方面 (二)氨基酸的理化性质 1.氨基酸两性解离和第由点由干所有氨基酸都含有碱性的氨基和酸性的龄基.可在酸性 液中与质子(H)结合呈带有正电荷的阳离子(一NH,*),也可在碱性溶液中与0H结合,失去质子变成 带负电荷的阴离子(一C00),因此氨基酸是一种两性电解质,具有两性解离的特性。氨基酸的解离方 式取决于其所处溶液的pH值。在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相 等,成为兼性离子,呈电中性,此时溶液的pH称为该氨基酸的等电点(isoelectric point,pl)(图1-2)。 H-NH,K)OH R ECH一NH OO 围12氨基酸的解离通式 氨基酸的pl是由a羧基和&-氨基的解离常数的负对数pK,和pK,决定的。pl计算公式为:pl=l/2 (pK,+pK,)。如丙氨酸pK,=2.34,DK,=9.69,所以pl=1/2(2.34+9.69)=6.02。若1个氨基酸有3个 可解离基团,写出它们电离式后取兼性离子两边的K值的 平均值,即为此氨基酸的pl值。 2.紫外吸收性质色氨酸、酪氨酸和苯丙氨酸因含有共 轭双键,可在波长250~290m处有特征紫外吸收峰。在中性 pH条件下,色氨酸、酪氨酸的最大吸收峰在280m处,而苯丙 氨酸最大吸收蜂在260nm处(图1-3)。由于色氨酸对280nm 光吸收的强度大约是酪氨酸和苯丙氨酸的十倍,因此色氨酸 对蛋白质溶液在280m的吸光度贡就最大。又由于大多数蛋 白质都含有芳香族氨基酸,所以测定蛋白质溶液280mm的光 吸收值,是分析溶液中蛋白质含量的快速简便的方法。 3.茚三酮反应(ninhydrin reaction)氨基酸与茚三j 水合物共加热,茚三酮水合物被还原,其还原物可与氨基酸 10 加热分解产生的氨结合,再与另一分子茚三酮缩合成为蓝 200 紫色的化合物.此化合物最大吸收峰在570m被长处。由 波长(nm》 于此吸收峰值的大小与氨基酸释放出的氨量成正比,因此 图13色氨酸、酪氨酸和苯丙 可作为氨基酸定性和定量分析方法。 氨酸的紫外吸收
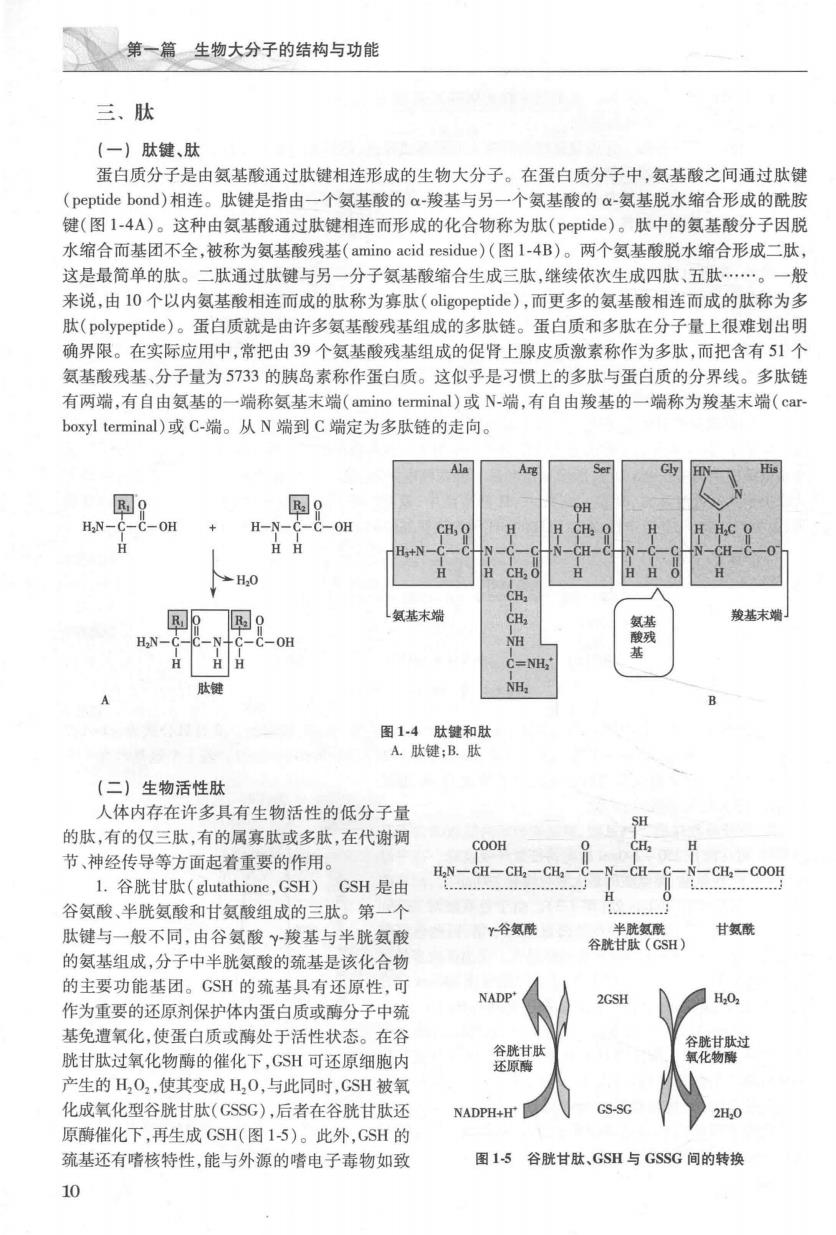
第一篇生物大分子的结构与功能 三、肽 (一)肽键、肽 蛋白质分子是由氨基酸通过肽键相连形成的生物大分子。在蛋白质分子中,氨基酸之间通过肽键 (peptide bond)相车。肽键是指由一个氨基酸的a-羧基与另一个氨基酸的a-氨基脱水缩合形成的酰胺 键(图1-4A)。这种由氨基酸通过肽键相连而形成的化合物称为肽(peptide)。肽中的氨基酸分子因脱 水缩合而基团不全,被称为氨基酸残基(amino acid residue)(图1-4B)。两个氨基酸脱水缩合形成二肽, 这是最简单的肽。二肽通过肽键与另一分子氨基酸缩合生成三肽,继续依次生成四肽、五肽. 来说,由10个以内氨基酸相连而成的肽称为寡肽(oligopeptide),而更多的氨基酸相连而成的肽称为多 肽(polypeptide)。蛋白质就是由许多氨基酸残基组成的多肽裤。蛋白质和多肽在分子量上很难划出明 确界限。在实际应用中,常把由39个氨基酸残基组成的促肾上腺皮质激素称作为多肽,而把含有51个 氨基酸残基、分子量为5733的胰岛素称作蛋白质。这似乎是习惯上的多肽与蛋白质的分界线。多肽链 有两端,有自由氨基的一端称氨基末端(amin ninal)或N-端,有自由羧基的一端称为羧基未端(car boxyl terminal)或C-端。从N端到C端定为多肽链的走向。 Ala Ser G R.o HN-C-C-OH R.9 氨基末端 肽 图14肚键和肽 A.肽键:B.肽 (二)生物活性肚 人体内存在许多具有生物活性的低分子量 的肽,有的仅三肽,有的属寡肽或多肽,在代谢调 COOH 节、神经传导等方面起着重要的作用。 HN一CH一CH,一CH -CH:-COOH L.谷胱甘肽(glutathione,GsH)GSH是由 谷氨酸、半胱氨酸和甘氨酸组成的三肽。第一个 肽键与一般不同,由谷氨酸Y羧基与半胱氨酸 Y谷氨配 谷甘《C) 甘氨酰 的氨基组成,分子中半胱氨酸的疏基是该化合物 的主要功能基闭。GSH的硫基具有还原性,可可 作为重要的还原剂保护体内蛋白质或酶分子中颈 NADP- 2GSH 基免遗氧化,使蛋白质或酶处于活性状态。在谷 胱甘肽过氧化物酶的催化下,GSH可还原细胞内 产生的H,O2,使其变成H,0,与此同时,CSH被氧 化成氧化型谷胱甘肽(GSSG),后者在谷胱甘肽还 NADPH+H GS-SG 2H,0 原酶催化下,再生成GSH(图15)。此外,GSH的 巯基还有嗜核特性,能与外源的嗜电子毒物如致 图15谷胱甘肽GSH与GSSG间的转换

第一章蛋白质的结构与功能 癌剂或药物等结合,从而阻断这些化合物与DNA、RNA或蛋白质结合,以保护机体免遭毒物损害。 2.多肽类激素及神经肽体内有许多激素属寡肽或多肽,例如属于下丘脑垂体肾上腺皮质轴的 催产素(9肽)、加压素(9肽)、促肾上腺皮质激素(39肽)、促甲状腺素释放激素(3肽)等。体内有一类 在神经传导程中起信县转导作用的肽米被弥为神经肽(neuropeptide)。较早发现的有脑啡肽(5肽) B-内啡肽(31肽)和强啡肽(17肽)等。近年还发现孤啡肽(17肽),其一级结构类似于强啡肽。它们与 中枢神经系统产生痛觉抑制有密切关系,因此很早就被用于临床的镇痛治疗。除此以外,神经肽还包括 P物质(10肽)、神经肽Y等。随着脑科学的发展,相信将发现更多的在神经系统中起着重要作用的生 物活性肽或蛋白质。 第二节蛋白质的分子结构 人体内具有生理功能的蛋白质都有特定结构,即一定的氨基酸百分组成和氨基酸排列顺序,以及肽 链空间的特定构象。因此蛋白质分子结构能够真正体现蛋白质的个性,是每种蛋白质具有独特生理功 能的结构基础。 一、蛋白质的一级结构 在蛋白质分子中,从N-端至C-端的氨基酸排列顺序称为蛋白质的一级结构(primar町y structure)。这 种顺序由DNA中基因的碱基序列所决定。一级结构中的主要化学键是肽键。1953年英国化学家F©d erick Sanger完成测定牛胰岛素的一级结构,牛胰岛素有A和B二条多肽链,A链有21个氨基酸残基,B 链有30个。分子中有3个二硫键,1个位于A链内,另2个二硫键位于A,B两链间(图1-6)。 - 6 腾米假天碳行酸女亮考甘-丝组亮-数谷-丙亮丽-宠多甘谷 精-甘-苯-苯-酪-苏-脯-婉-苏-0H 图16牛胰岛素的一级结构 一级结构是蛋白质空间构象和特异生物学功能的基础。随着蛋白质结构研究的深入,人们已认识 到蛋白质一级结构并不是决定蛋白质空间构象的唯一因素。肽链的正确折叠和正确高级构象形成需要 分子伴侣等分子参与。 二、蛋白质的空间结构 蛋白质的空间构象(conformation)是指蛋白质分子中的每一原子在三维空间的相对位置,它们是蛋 白质分子特有性质和功能的结构基础。蛋白质空间结构包括二级、三级、四级结构。由一条肽链形成的 蛋白质只有一级、二级和三级结构,由二条或二条以上多肽链形成的蛋白质才可能具有四级结构。 (一)蛋白质的二级结构 蛋白质的二级结构(secondar y structure)是指蛋白质分子中某一段肽链的局部空间结构,也就是该 段肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。肽链主链骨架原子即N(氨基 氮),C(α-碳原子)和C.(羰基碳)3原子依次重复排列。蛋白质的二级结构仅涉及主链构象而不涉及 R侧链的空间排布。 11
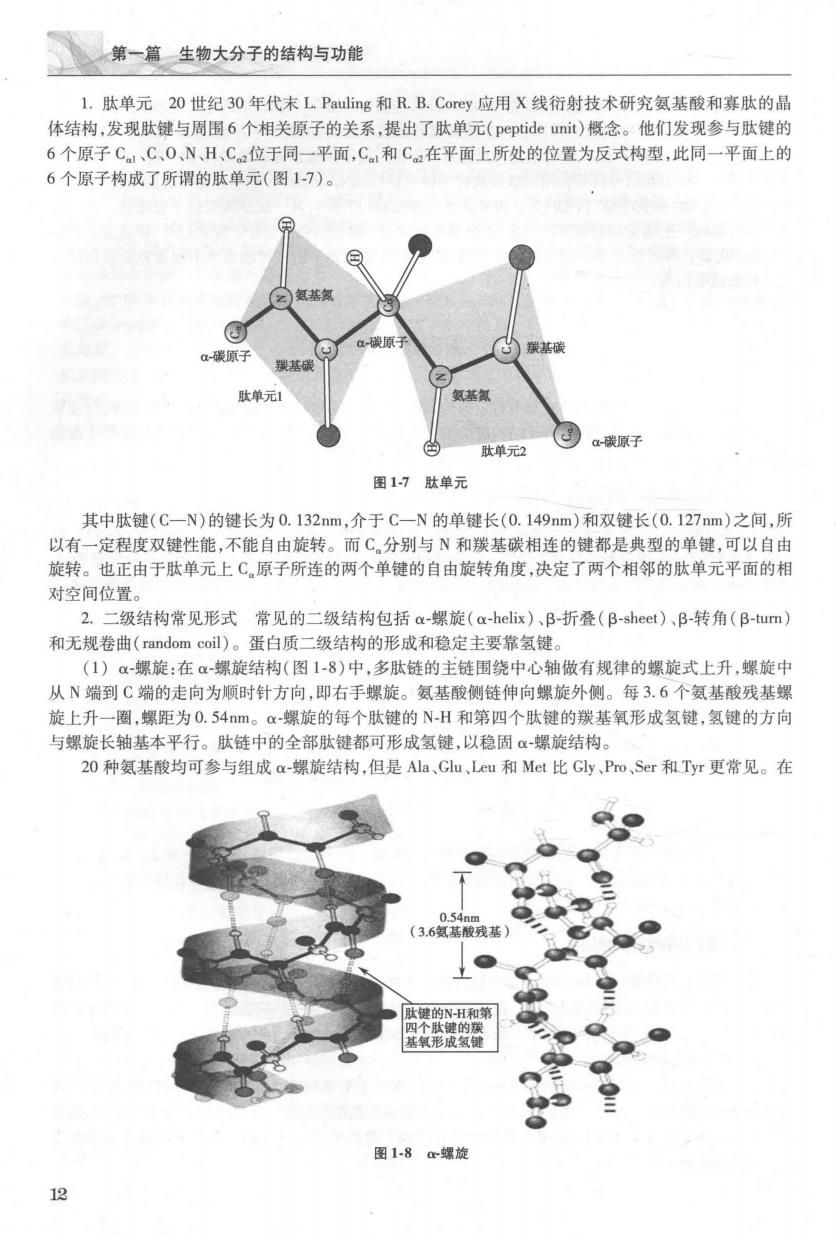
第一意生物大分子的结构与功能 1.肽单元20世纪30年代末L Pauling和R.B.Corey应用X线行射技术研究氨基酸和寒肽的晶 体结构,发现肽键与周围6个相关原子的关系,提出了肽单元(p©eptide unit)概念。他们发现参与肽键的 6个原子C、C、0、NH,C位于同一平面,C和Ca在平面上所处的位置为反式构型,此同一平面上的 6个原子构成了所谓的肽单元(图1-7)。 色肽单元 )a-碳原子 图17肽单元 其中肽键(C-N)的键长为0.132nm,介于C-N的单键长(0.149mm)和双键长(0.127mm)之间,所 以有一定程度双键性能,不能自由旋转。而C,分别与N和羰基碳相连的键都是典型的单键,可以自由 旋转。也正由于肽单元上C原子所连的两个单键的自由旋转角度,决定了两个相邻的肽单元平面的相 对空间位置。 2.二级结构常见形式常见的二级结构包括a-螺旋(a-helix)、B-折叠(B-sheet)、B-转角(B-tum) 和无规卷曲(random coil)。蛋白质二级结构的形成和稳定主要靠氢键 (1)α螺旋:在α螺旋结构(图1-8)中,多肽链的主链围绕中心轴做有规律的螺旋式上升,螺旋中 从N端到C端的走向为顺时针方向,即右手螺旋。氨基酸侧链伸向螺旋外侧。每3.6个氨基酸残基螺 旋上升一圈,螺距为0.54m。a-螺旋的每个肽键的N-H和第四个肽键的羰基氧形成氢健,氢键的方向 与螺旋长轴基本平行。肽链中的全部肽键都可形成氢键,以稳固α-螺旋结构。 20种氨基酸均可参与组成a-螺旋结构,但是Ala、Gu,Lcu和Mct比Gly、Po,Scr和Tyr更常见。在 3.6氢基酸残基 键的NH和第 。 图1-8c螺旋 12

第一章蛋白质的结构与功能 蛋白质表面存在的α螺旋,常具有两性特点,即由几个疏水氨基酸残基组成的肽段与亲水氨基酸残基 组成的肽段交替出现,使之能在极性或非极性环境中存在。这种两性α~螺旋可见于血浆脂蛋白、多刷 激素等。肌红蛋白和血红蛋白分子中,有许多肽链段落呈α-螺旋结构。毛发的角蛋白、肌肉的肌球蛋 白以及血凝块中的纤维蛋白,它们的多肽链几乎全长都卷曲成α-螺旋。数条α-螺旋状的多肽链缠绕起 来,形成缆索,从而增强了其机械强度,并具有可伸缩性(弹性)。 (2)B-折叠:B折叠与α-螺旋的形状截然不同,呈折纸状。在B-折叠结构(图19A)中,多肽链充 分伸展,每个肽单元以C,为旋转点,依次折叠成锯齿状结构,氨基酸残基侧链交替地位于锯齿状结构的 上下方。所形成的锯齿状结构一般比较短,只含5~8个氨基酸残基,但两条以上肽链或一条肽链内的 若干肽段的锯齿状结构可平行排列,两条肽链走向可相同,也可相反。走向相反时,两条反平行肽链的 间距为0.70m,并通过肽链间的肽键羰基氧和亚氨基氢形成氢键从而稳固B-折叠结构,蚕丝蛋白几乎 都是B-折叠结构,许多蛋白质既有α-螺旋又有B-折叠。 3朵 图19B折叠和B转徐 AB-折香:B.B转角 (3)B-转角:B-转角常发生于肽链进行180°回折时的转角上。在B-转角中,伸展的肽链形成U形 结构(图1-9B)。该结构通常有4个氨基酸残基组成,其第一个残基的羰基氧(0)与第4个残基的氨基 氢(H)可形成氢键,起到稳定B-转角的作用。B-转角的结构较特殊,第二个残基常为脯氨酸,其他常见 残基有甘氨酸、天冬氨酸、天冬酰胺和色氨酸。 (4)无规卷曲:无规卷曲又称为有序非重复结构,是一种无确定规律的主链构象,普遍存在于蛋白质分 子中。这些区域曾被认为是用来阐述没有确定规律性的那部分肽链结构。实际上,随机的、无序的卷曲这些 区域是一些稳定的、有序的非重复结构。这些区域通常参与二级结构的连接,或参与肽链折叠方向的改变。 3.模体(moti) 在许多蛋白质分子中,可发现二个或三个具有二级结构的肽段,在空间上相互接 近,相互作用,形成一个有规则的二级结构组合,称为超二级结构(super-secondary structure),又称为模 体,已知的有:aa、BaB、BB(图1-10A)。一个模体往往有其特征性的氨基酸序列,并发挥特殊的功能。 例如,在许多钙结合蛋白分子中通常有一个结合钙离子的模体,它由α-螺旋-环-α-螺旋三个肽段组成 (图110B),在环中谷氨酸和天冬氨酸的亲水侧链通过氢键提供了结合钙离子的部位。近年发现的锌 指结构也是一个常见的模体例子。它由1个-螺旋和2个反平行的B折叠组成(图1-10C).形似手指 具有结合锌离子功能。该模体的N端有1对半胱氨酸残基,C-端有1对组氨酸残基,这4个残基在空间 上形成一个洞穴,恰好容纳1个Zm2“。由于Z2“可稳固模体中的a-螺旋,致使此a-螺旋能镶嵌于D八A 的大沟中因此含锌指结构的蛋白质都能与DNA或RNA结合。可见模体的特征性空间构象是其特殊 功能的结构基础 (二)蛋白质的三级结构 L,三级结构及其稳定键蛋白质的三级结构(tertiary structure)是指整条肽链中全部氨基酸残基的 13

第一篇生物大分子的结构与功能 多肉 图110蛋白质模体示意图 A.超二级结构;B钙结合蛋白中的结合钙离子的模体:C锌指结构 相对空间位置,也就是整条肽链所有原子在三维空间的整体排布位置。在二级结构基础上,由于侧链R 基团的相互作用,整条肽链进行范围广泛的折叠和盘曲。球状蛋白质的三级结构有某些共同特征,即分 子中含有的多个二级结构单元再进一步的折叠成相对独立的三维空间构象,形成一个紧密包裹的、几近 球状或椭球状的空间结构,水侧链埋藏在分子内部,亲水侧链暴露在分子表面。 肌红蛋白是由153个氨基酸残基构成的单个肽链的蛋白质,含有1个血红素辅基。肌红蛋白分子 中螺旋占75%,构成8个螺旋区,两个螺旋区之间有一段无规卷曲,脯氨酸位于转角处。由于侧链R 基团的相互作用,多肽链缠绕,形成一个球状分子(4.5mm×3.5mm×2.5mm),球表面主要有亲水侧链, 疏水侧链则位于分子内部(图1-11)。所以,肌红蛋白有较好水溶性。 蛋白质三级结构的形成和稳定主要靠次级键 疏水作用 离子键(盐键)、氢键和范德华力等(图1-12)。 2.结构域(domain)分子量大的蛋白质三级结构常可分割 成一个和数个球状或纤维状的区域,折叠得较为紧密,各行其功 能,称为结构域。结构域与分子整体以共价键相连,具有相对独 立的空间构象和生物学功能。同一蛋白质中的结构域可以相同 或不同,不同蛋白质中的结构域也可以相同或不同。如纤连蛋 白,它由两条多肽链通过近C端的两个二硫键相连而成,含有6 个结构域,各个结构域分别执行一种功能,有可与细胞、胶原、 DNA和肝裁等配体结合的结构域(图1-13)。此外,个配体也 图111肌红蛋白 可与一个蛋白质分子中的多个结构域结合。结构域也可由蛋白 质分子中不连续的肽段在空间结构中相互接近而构成。 3.分子伴侣(chaperon) 蛋白质空间构象的正确形成,除一级结构为决定因素外,还需要一类称为 分子伴侣的蛋白质参与。分子伴侣是一大类参与肽链折叠、蛋白质空间构象形成的一类特殊蛋白质。 它们相互之间没有关系,但具有的共同功能是帮助其他含蛋白的结构在体内进行非共价的组装或卸装 但不是这些结构在发挥其正常的生物功能时的永久组成成分。它通过提供一个保护环境从而加速蛋白 14