
第十六章细胞内膜系统 学习目标 通过本章学习,你应该能够: 掌握内膜系统概念、内质网、高尔基体、溶酶体、过氧化物酶体结构功能等 熟悉内质网、高尔基体、溶酶体的结构、功能等。 了解内膜系统各细胞器异常与疾病的关系。 在直核细胞的细胞质中,有一些由膜构成的细胞器,它们被此相互关联,组成了一个精密而复杂的 膜系统,把细胞质分隔成了多个特异性的功能区,而每个功能区均含有自身特异性的酶和其他特定的成 分。通常我们把细胞质中由核膜、内质网膜和高尔基复合体膜的小管、小泡和扁囊组成的系统称为内膜 系统(endomembrane system)。内膜系统和质膜是相连的,同时和质膜一样,也是一种动态结构,具有流 动性、镶嵌性、不对称性和蛋白质极性。各种内膜之间可通过出芽和融合的方式进行交流,因此,溶酶 体、过氧化物酶体和分泌泡均可看做是内膜系统的衍生物。内膜系统不含有DNA,其功能活动和装配 完全受核DNA的控制。线粒体由于含有自身DNA,其功能活动和装配要受到核DNA和自身DNA的共 同调控,属半自主性细胞器。 内膜系统是真核细胞完成各种复杂生命活动所必需的基本结构,也是不同于原核细胞的重要特征。 真核细胞中,内膜系统把细胞质分隔为内膜系统的腔区和胞质溶胶区,而内膜系统中的各种成分又分为 更加精细的区域,从而使细胞质出现了高度区域化(compartmentalization)。 本章将着重描述内质网、高尔基复合体、溶酶体以及过氧化物酶体的结构、功能和病变。核膜部分 将在相关章节叙述。 第一节内质网 内质网(endoplasmic reticulum,ER)的概念是随着电子显微镜技术的发展而建立的。945年 KRP:用电镜观察培养的小鼠成纤维细胞时,发现位于细胞质内靠近细胞核的内质区分布着一些 小管、小毒连成的网结构,故称为内质网(endoplasmic reticulum,ER,这-名称一直沿用至今。 内质网广泛分布于除成熟红细胞以外的所有真核细胞的细胞质中,虽然体积仅占细胞总体积的 10%,但其面积却占整个细胞生物膜系统的50%以上。内质网是由单位膜围绕形成的膜性结构,形态 呈泡状、管状和扁囊状,它们相互连通形成封闭管道系统,并常与外层核膜相连续,内质网腔与核周间隙 相通。研究表明,内质网在蛋白质和脂类合成等方面具有非常重要的作用。 一、内质网的类型与形态结构 内质网是细胞内一个精细的膜囊结构,由内质网膜相互连接形成一个连续的内腔相通的膜性管道 888
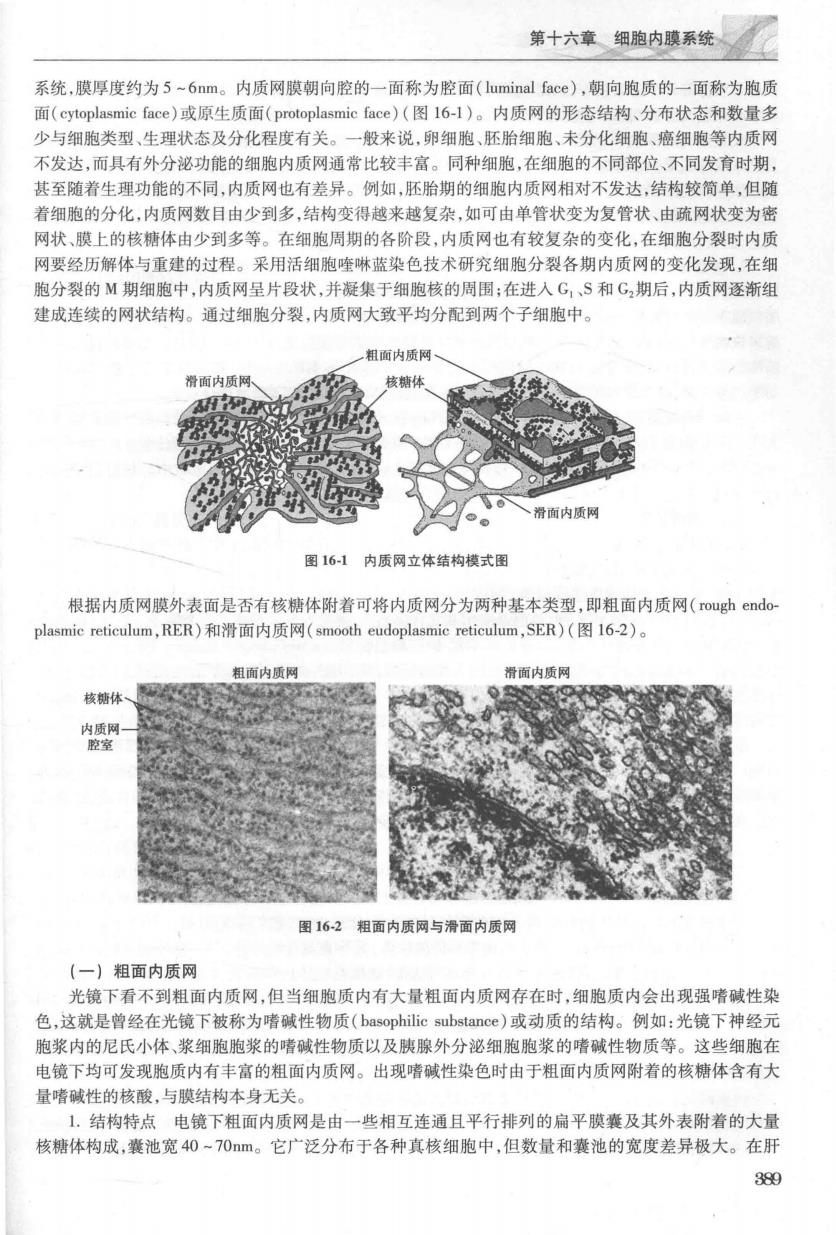
第十六幽内速系统 系统,膜厚度约为5-6nm。内质网膜朝向腔的一面称为腔面(luminal face),朝向胞质的一面称为胞质 面(cytoplasmic face)或原生质面(protoplasmic face)(图16-l)。内质网的形态结构、分布状态和数量多 少与细胞类型、生理状态及分化程度有关。一般来说,卵细胞、胚胎细胞、未分化细胞、癌细胞等内质网 不发达,而具有外分泌功能的细胞内质网通常比较丰富。同种细胞,在细胞的不同部位、不同发育时期 其至随着生理功能的不同,内质网也有差异。例如,胚胎期的细胞内质网相对不发达,结构较简单,但随 著细胞的分化,内质网数目由少到多,结构弯得战来城复杂,如可由单管状变为复管状、由疏网状变为密 网状、膜上的核糖体由少到多等。在细胞周期的各阶段,内质网也有较复杂的变化,在细胞分裂时内质 网要经历解体与重建的过程。采用活细胞喹啉蓝染色技术研究细胞分裂各期内质网的变化发现,在细 胞分裂的M期细胞中,内质网呈片段状,并凝集于细胞核的周围;在进人G,、S和G,期后,内质网逐渐组 建成连续的网状结构。通过细跑分裂,内质网大致平均分配到两个子细胞中。 一粗面内质 滑面内质网 核糖体 滑面内质网 图16-1内质网立体结构模式图 根据内质网膜外表面是否有核糖体附着可将内质网分为两种基本类型,即粗面内质网(rough endo plasmic reticulum,RER)和滑面内质网(smooth eudoplasmie reticulum,SER)(图16-2)。 粗面内质网 滑面内质网 核糖体 图162粗面内质网与滑面内质网 (一)粗面内质网 光镜下看不到粗面内质网,但当细胞质内有大量粗面内质网存在时,细胞质内会出现强嗜碱性染 色,文就是曾经在光镜下被称为嗜碱性物质(basophilic substance)或动质的结构。例如:光镜下神经元 胞浆内的尼氏小体、浆细胞胞浆的嗜碱性物质以及胰腺外分泌细胞胞浆的嗜碱性物质等。这些细胞名 电镜下均可发现胞质内有丰富的粗面内质网。出现嗜碱性染色时由于粗面内质网附着的核糖体含有大 量者碱性的核酸与草结构本身无关 1.结构特点电镜下粗面内质网是由一些相互连通且平行排列的扁平膜囊及其外表附着的大量 核糖体构成,囊池宽40~70m。它广泛分布于各种真核细胞中,但数量和囊池的宽度差异极大。在肝 39g

第四篇细胞的结构与功能 细胞和胰腺等外分泌细胞中,粗面内质网囊池很狭窄,囊池内中空或含有少量中等电子密度物质:而在 成纤维细胞及滑膜细胞中,粗面内质网囊池比较宽大 大量研究结果表明,相面内质网发秋程度可作为判新细胞分化程度和功能状态的一项重要指标 凡是未成熟或未分化细胞与相应的正常成熟细胞相比,其粗面内质网不发达,如干细胞、各种母细胞利 胚胎细胞、培养细胞。这些细胞生长快速,细胞质中有丰富的游离核糖体,主要合成内源性蛋白质以供 自身生长、分裂需要。而执行分泌功能的细胞,如胰腺腺泡上皮细胞、肝细胞和浆细胞等,其内质网比较 发达,但在分泌活动旺感或低下时,内质网也有数量多或少的变化 2.核糖体核糖体(0soe)是一种非膜性结构的生物大分子复合物.是细胞内蛋白质合成的场 所,普遍存在于原核细胞和真核细胞内。真核细胞内核糖体包括两种类型:一种是附着在内质网膜和 层核膜表面的核糖体,称附着核糖体(attached ribosome):另一种是游离在细胞质基质中的核糖体,称为 游离核糖体(f©e ribosome)。附着核糖体和游离核糖体在执行蛋白质合成功能过程中,都不是以单个核 糖体的形式进行的,而是由RNA链把多个甚至几十个核糖体串联在一一起,形成具有合成蛋白质特殊 功能的聚合体,即多聚核糖体(polyribosome),多聚核糖体极大地提高了蛋白质合成的速率。 电镜下观察显示,核糖体是一种直径15 25m的小颗粒,由大小两个亚基构成。真核细胞核糖体 大亚基为60S,含有5 S rRNA,5.8 S rRNA,28SRNA等3种类型rRNA和49种蛋白质:小亚基为40S,由 一条18SRNA和33种蛋白质构成。核糖体通常以大、小亚基的形式存在于细胞质中。只有当细胞在 合成蛋白质时,大、小亚基才结合在一起,蛋白质合成结束,大、小亚基又解离。 (二】滑面内质网 滑面内质网也同样广泛存在于各种细胞内的细胞器,但在形态与功能上都不同于粗面内质网。滑 面内质网由分支的管道形成较为复杂的立体结构,膜表面没有核糖体附着,因表面光滑而得名。多为分 支的小管,很少扩大形成小泡或扁囊。小管直径约为50~100nm,膜较薄约4-5m,它们相互连接成 网,在一定部位可与粗面内质网、核膜及高尔基复合体相车,偶见与质膜相连。在光镜下,由于细胞基质 和沿面内质网皆为老酸性物质,所以在苏木精伊红边伍法(hematoxylin-eosin staining,HE)热色切片下 不宜识别。 一般来说,细胞质内滑面内质网丰富的细胞,其嗜酸性较强,如:胃壁细胞、寥丸间质细胞、黄 体细胞和肾上腺皮质细胞等。有时,滑面内质网和集中于细胞质的某一局部,光镜下呈粉红色小体,常 称为嗜酸小体(body)。在病毒性肝炎的肝细胞中即可见到 滑面内质网的膜比粗面内质网的膜薄,电镜下不易分辨出单位膜的三层结构。构成滑面内质网膜 的蛋白质及脂类处于不断的代谢更新之中。同位素实验表明,H标记的氨基酸和脂类首先渗入粗面内 质网膜中,然后出现在滑面内质网的膜上。表明新生的膜蛋白和膜磷脂主要由粗面内质网合成,经连接 部位移向滑面内质网。而滑面内质网本身也可合成部分磷脂 二、内质网膜的化学组成 粗面内质网和滑面内质网可用物理方法分离。将组织或细胞匀浆后,其内质网可破碎成许多碎片 采用密度梯度离心技术可将这些内质网的碎片从细胞中分离出来,它们多是直径为100m的封闭小 囊,称为微粒体(nicrosome)。来自粗面内质网的微粒体,其外表面有核糖体附着,称粗面微粒体(rouh microsomes)。由于核糖体总是存在于微粒体的外表面,说明微粒体内部在生化上相当于内质网腔。在 匀浆中还有些微粒体大小与粗面微粒体相仿,但表面没有核糖体附着,称滑面微粒体(smooth micro soms)。滑面微粒体一部分来自滑面内质网,一部分可能来自细胞膜、高尔基体或其他细胞器的碎片 因此滑面微粒体的成分比较复杂。但在肝细胞中光面内质网丰富,因此肝匀浆中多数滑面微粒体来自 滑面内质网。 内质网化学组成方面的资料主要来源于对微粒体膜的研究。内质网膜是由脂类和蛋白质组成。内 质网膜含30%~40%脂类和60%~70%蛋白质,脂类成分中主要为磷脂,此外还有中性脂肪、磷脂酰肌 醇、缩醛磷脂和一些神经节苷脂等。各类磷脂的比例大致为:磷脂酰胆碱占55%,磷脂酰乙醇胺为 390

第十六章细胞内膜系统 209%~25%,磷脂酰丝氨酸5%~10%,磷脂酸肌醇5%~10%,鞘磷脂4%~7% 内质网的蛋白质含量比细胞膜多。这些蛋白质既有边周蛋白,也有整合膜蛋白,它们在膜上呈 不对称分布,有的偏向腔面,有的偏向胞质面。蛋白质成分中多为糖蛋白,其中一些为酶。内质网膜 中约含有30~40种酶,其中葡萄糖-6-磷酸酶(glucose-6-phosphatase,G-6-P)被视为内质网膜的标志 酶,另一类标志酶是电子传递体系。如:NADH细胞色素c还原酶、NADH细胞色素b5还原酶、细胞 色素b5、细胞色素P450等。细胞色素P450主要位于滑面内质网的胞质面,是滑面内质网特有的标 记酶。 三、内质网的功能 内质网是细胞内多功能细胞器,除了进行蛋白质合成、脂类合成、糖代谢和解毒作用之外,还与 物质运输、蛋白质折叠修饰以及为细胞提供物理支撑等密切相关。粗面内质网和滑面内质网在结构 上既有共性又存在差异。除了是否存在核糖体附着以外,两者在蛋白质种类和数量上,特别是酶系 统方面存在较大的差别。因此,两者在功能上存在差异。目前已知至少有两种膜蛋白是粗面内质网 所特有的,并与核糖体与粗面内质网的结合有关,这两种蛋白质称为核糖体结合糖蛋白(ibophorin) I和Ⅱ,其分子量分别为63kD和65kD,它们是膜的整合糖蛋白。另外,粗面内质网膜中还含有信号 识别颗粒的受体(signal-recognition partice receptor)等蛋白质,而滑面内质网中则没有上述这些蛋白 质的存在。 (一)粗面内质网的功能 1.粗面内质网与蛋白质合成由于粗面内质网与核糖体结合,且含有丰富的酶类,使得其功能呈 现多样化。粗面内质网主要参与合成分泌性蛋白质、膜整合蛋白质、内质网驻留蛋白(endoplasmic retic )及溶酶体蛋白等,其中分泌蛋白包括各种肽类激素、酶类和抗体等。由内质网合成 的分泌蛋白质首先会释放进入内质网腔室进行初步加工,然后输送到高尔基复合体进行进一步的加工、 修饰,最终包装成含有成熟分泌颗粒的分泌泡,再由细胞表面释放出去。由粗面内质网参与合成的分泌 蛋白,膜整合蛋白、驻留蛋白及溶酶体蛋白等,多数都需要在内质网腔室进行初步的糖基化修饰后,被转 运至相应的部位 核糖体是蛋白质合成的场所,胞质溶胶中的游离核糖体与mRNA结合以后形成的多聚核糖体是蛋 白质合成的开始。游离多聚核糖体与附着于内质网膜的多聚核糖体在结构上没有任何区别,但是游离 的多聚核糖体合成的蛋白质不会进入粗面内质网,而附着的多聚核糖体合成的肽链将进入粗面内质网 腔,其关键在于结合的mRNA不同。粗面内质网上蛋白质合成的过程遵循信号假说(signal hypothesis), 信号假说由G.Blobel和D.Sabatini等在1975年提出,该假说认为蛋白质N端序列可以作为信号肽,负 责指导蛋白质转运至内质网上完成合成,详细阐述了粗面内质网上合成蛋白质的生物学过程。 G.Blobel和D.Sabatini也因为提出这一假说而获得1999年诺贝尔生理学或医学奖。 (I)信号假说(signal hypothesis):蛋白质合成是在mRNA的指导下完成的。研究表明,所有在相 面内质网合成的蛋白质,其连接多聚核糖体的mRNA在起始端均有一段编码约18~30个氨基酸的信号 序列(signal sequence)。它们位于起始密码子(AUG)之后。由信号序列翻译出的肽链称为信号肽 (signal peptide),特指蛋白质多肽链上的一段连续的特定氨基酸序列,具有分选信号的功能。可位于多 肽链的任何部位,完成分选任务后常被切除。除了信号肽以外,还有一种信号斑(signal patch),指位于 多肽链不同部位的几个特定氨基酸序列经折叠后形成的斑块区,具有分选信号的功能。信号斑是一种 三维结构。完成分选任务后仍然存在(图16-3)。 当核糖体与mRNA起始端结合以后首先翻译出这段信号肽,这时,胞质内的信号识别颗粒(signal recognition particle,SRP)可以识别新生信号肽并与之结合形成SRP-核糖体复合体。SRP是由6个多时 亚单位和一个小的7SRNA(图16-4)组成的RNA-蛋白质复合体。SRP有两个功能域,一个功能域用以 识别信号肽,结合含有疏水核心的信号肽使其不能折叠而能穿越内质网:另一个功能域干扰氨基酰 391
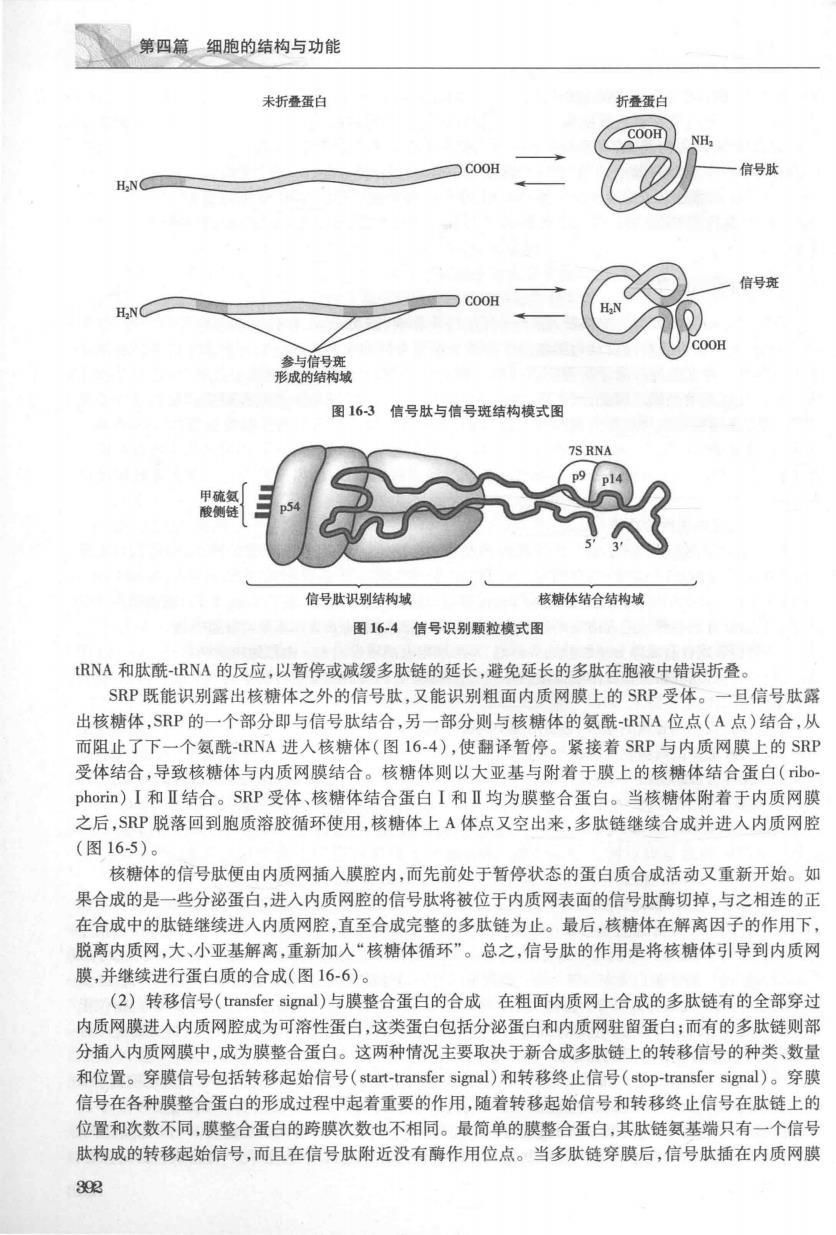
第四篇细胞的结构与功能 未折叠蛋白 折叠蛋白 信号 H.N 图16-3信号肽与信号斑结构模式图 信号肽识别结构域 核糖体结合结构城 图16-4信号识别颗粒模式图 RNA和肽酰-RNA的反应,以暂停或减缓多肽链的延长,避免延长的多肽在胞液中错误折叠。 SRP既能识别露出核糖体之外的信号肽,又能识别粗面内质网膜上的SRP受体」 一且信号肽露 出核糖体,SRP的一个部分即与信号肽结合,另一部分则与核糖体的氨酰-RNA位点(A点)结合,从 而阻止了下一个氨酰-RNA进入核糖体(图16-4),使翻译暂停。紧接着SRP与内质网膜上的SRP 受体结合,导致核糖体与内质网膜结合。核糖体则以大亚基与附着于膜上的核糖体结合蛋白(b0 pon)I和Ⅱ结合。SRP受体、核糖体结合蛋白I和Ⅱ均为膜整合蛋白。当核糖体附着于内质网膜 之后,SP脱落回到胞质溶胶循环使用,核糖体上A体点又空出来,多肽链继续合成并进入内质网脑 (图16-5)。 核糖体的信号肽便由内质网插入膜腔内,而先前处于暂停状态的蛋白质合成活动又重新开始。如 果合成的是一些分泌蛋白,进入内质网腔的信号肽将被位于内质网表面的信号肽酶切掉,与之相连的正 在合成中的肽链继续进入内质网腔,直至合成完整的多肽链为止。最后,核糖体在解离因子的作用下 脱离内质网,大、小亚基解离,重新加入“核糖体循环”。总之,信号肽的作用是将核糖体引导到内质网 膜,并继续进行蛋白质的合成(图16-6)。 (2)转移信号(ransfer signal)与膜整合蛋白的合成在粗面内质网上合成的多肽链有的全部穿起 内质网膜进入内质网腔成为可溶性蛋白,这类蛋白包括分泌蛋白和内质网驻留蛋白;而有的多肽链则部 分插人内质网膜中,成为膜整合蛋白。这两种情况主要取决于新合成多肽链上的转移信号的种类、数量 和位置。穿膜信号包括转移起始信号(start-transfer signal)和转移终止信号(stop-transfer signal)。穿膜 信号在各种膜整合蛋白的形成过程中起着重要的作用,随着转移起始信号和转移终止信号在肽链上的 位置和次数不同,膜整合蛋白的跨膜次数也不相同。最简单的膜整合蛋白,其肽链氨基端只有一个信号 肽构成的转移起始信号,而且在信号肽附近没有酶作用位点。当多肽链穿膜后,信号肽插在内质网膜 302
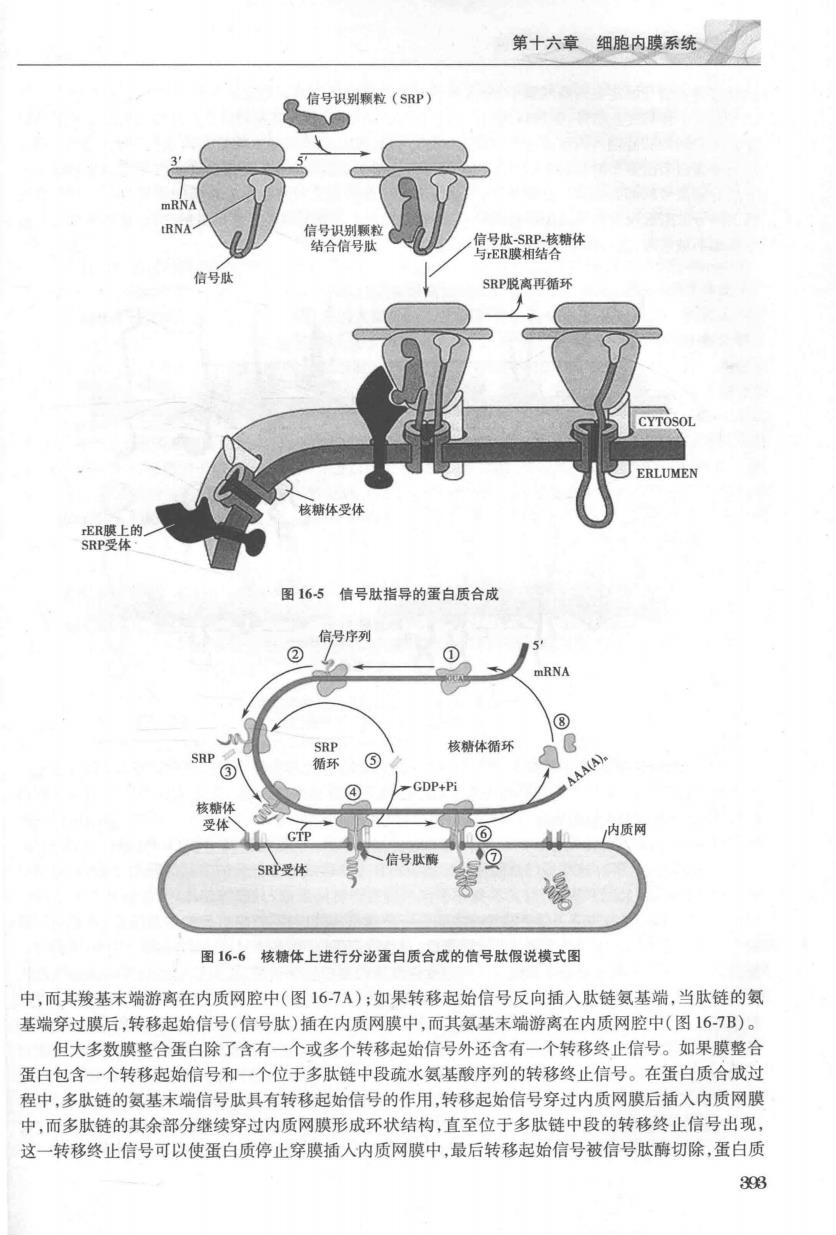
第十六章细胞内膜系统 信号识别颗粒(SP】 停2落糖体 SRP脱离再循环 图165信号肽指导的蛋白质合成 信号序列 核糖体循环 GDP+P 质两 信号肽酶 SRP受 图166核糖体上进行分泌蛋白质合成的信号肽假说模式图 中,而其羧基末端游离在内质网腔中(图167A):如果转移起始信号反向插入肽链氨基端,当肽链的氨 基端穿过膜后,转移起始信号(信号肽)插在内质网膜中,而其氨基末端游离在内质网腔中(图16-7B)。 但大多数膜整合蛋白除了含有一个或多个转移起始信号外还含有一个转移终止信号。如果膜整合 蛋白包含一个转移起始信号和一个位于多肽链中段硫水氨基酸序列的转移终止信号。在蛋白质合成过 程中,多肽链的氨基末端信号肽具有转移起始信号的作用,转移起始信号穿过内质网膜后插入内质网膜 中,而多肽链的其余部分继续穿过内质网膜形成环状结构,直至位于多肽链中段的转移终止信号出现, 这一转移终止信号可以使蛋白质停止穿膜插人内质网膜中,最后转移起始信号被信号肽酶切除,蛋白质 393
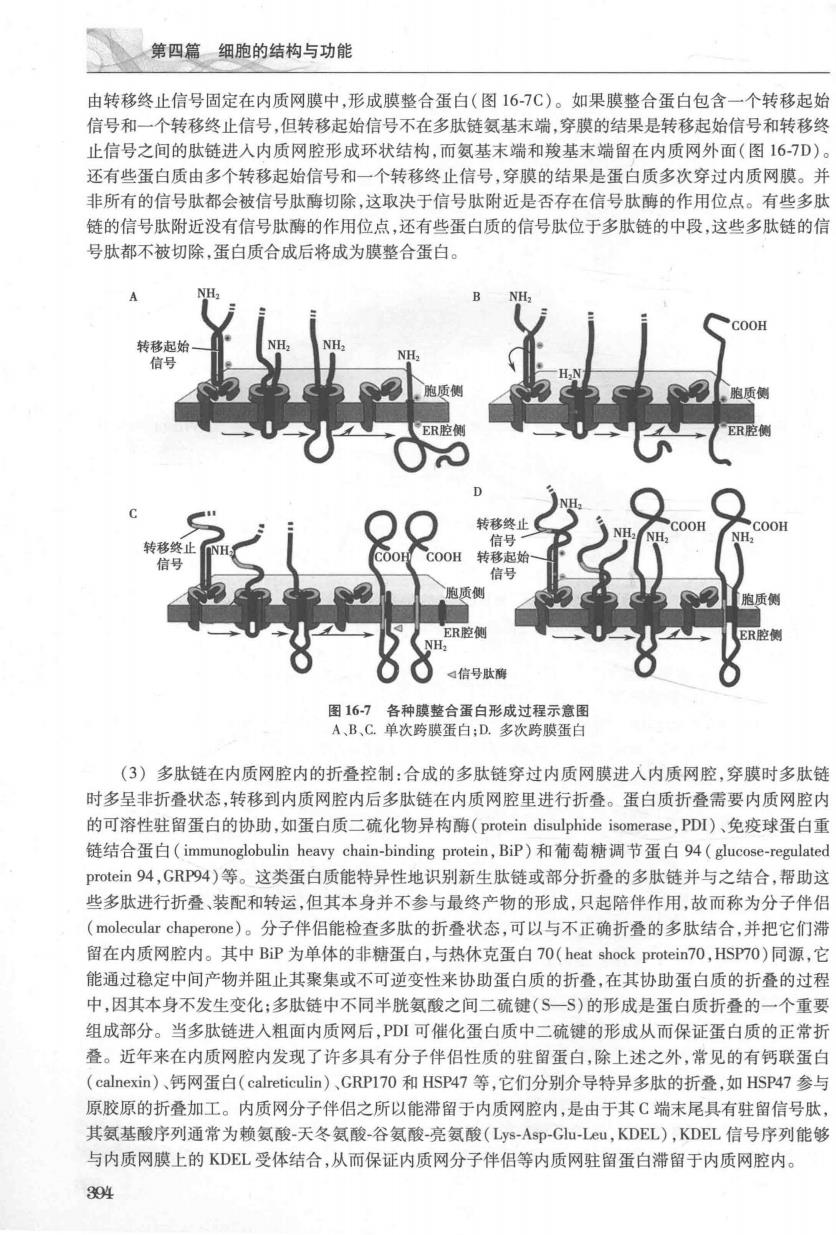
第四篇细胞的结构与功能 由转移终止信号固定在内质网膜中,形成膜整合蛋白(图16-7C)。如果膜整合蛋白包含一个转移起始 信号和一个转移终止信号,但转移起始信号不在多肽链氨基末端,穿膜的结果是转移起始信号和转移终 止信号之间的肽链进入内质网腔形成环状结构,而氨基末端和羧基末端留在内质网外面(图167D》 还有些蛋白质由多个转移起始信号和一个转移终止信号,穿膜的结果是蛋白质多次穿过内质网膜。并 非所有的信号肽都会被信号肽德切除这取决干信县肽附折是否存在信号肚酶的作用位占。有此多肽 链的信号肽附近没有信号肽酶的作用位点,还有些蛋白质的信号肽位于多肽链的中段,这些多肽链的信 号肽都不被切除,蛋白质合成后将成为膜整合蛋白。 ER腔 图16-]各种膜整合蛋白形成过程示意图 A、B,C单次跨膜蛋白:D.多次跨膜蛋白 (3)多肽链在内质网腔内的折叠控制:合成的多肽链穿过内质网膜进人内质网腔,穿膜时多肽链 时多呈非折叠状态,转移到内质网腔内后多肽链在内质网腔里进行折叠。蛋白质折叠需要内质网腔内 的可溶性驻留蛋白的协助,如蛋白质二硫化物异构酶(protein disulphide isomerase,PDI)、免疫球蛋白重 链结合蛋白(immunoglobulin heavy chain-binding protein,BP)和葡萄糖调节蛋白94(glucose-regulatec prot©in94,GRP94)等。这类蛋白质能特异性地识别新生肽链或部分折叠的多肽链并与之结合,帮助这 些多肽进行折叠、装配和转运,但其本身并不参与最终产物的形成,只起陪伴作用,故而称为分子伴侣 (molecular chaperone)。分子伴侣能检查多肽的折叠状态,可以与不正确折叠的多肽结合,并把它们 留在内质网腔内。其中BP为单体的非糖蛋白,与热休克蛋白70(heat shock protein70,HSPT0)同源,它 能通过稳定中间产物并阻止其聚集或不可逆变性来协助蛋白质的折叠,在其协助蛋白质的折叠的过稻 中,因其本身不发生变化:多肽链中不同半胱氨酸之间二硫键(S一S)的形成是蛋白质折叠的一个重要 组成部分。当多肽链进入粗面内质网后,PD可催化蛋白质中二硫键的形成从而保证蛋白质的正常折 叠。近年来在内质网腔内发现了许多具有分子伴侣性质的驻留蛋白,除上述之外,常见的有钙联蛋白 (calnexin)、钙网蛋白(calreticulin)、GRPI70和HsP47等,它们分别介导特异多肽的折叠,如HSP47参与 原胶原的折叠加工。内质网分子伴侣之所以能滞留于内质网腔内,是由于其C端末尾具有驻留信号肽, 其氨基酸序列通常为赖氨酸-天冬氨酸-谷氨酸-亮氨酸(Lys-Asp-G-Lu,KDEL),KDEL信号序列能够 与内质网膜上的KDEL受体结合,从而保证内质网分子伴侣等内质网驻留蛋白滞留于内质网腔内。 394

第十六章细胞内膜系统、 从内质网输送到高尔基复合体的蛋白质必须是正确折叠和组装的。错误折叠和未完全组装的蛋白 质则被保留在内质网之内,并通过内质网膜上的Sc61转位子从内质网内腔输送到细胞质,再被降解 因此,在蛋白质合成过程中,内质网还起到一个质量控制器的作用。这种质量控制过程主要由内质网腔 内的分子伴侣蛋白来完成。内质网腔内的分子伴侣蛋白可以特异性地识别错误折叠和未完全组装的蛋 白,并把它们滞留在内质网中,同时内质网腔内非折叠蛋白的积聚,可以引起内质网的未折叠蛋白反应 (unfolded protein response,UPR),使内质网腔内的分子伴侣蛋白表达升高,从而有利于蛋白质的正确折 叠和组装。 2.粗面内质网与蛋白质的糖基化修饰粗面内质网的另一个功能是蛋白质糖基化(lycosylation) 糖基化是指在酶的控制下,蛋白质或脂质附加上糖类的修饰过程。在胞质中游离多聚核糖体合成的可 溶性蛋白质都未被糖基化,而在内质网合成的大部分蛋白质都需要糖基化后形成船蛋白。例如由内质 网合成并输送到高尔基体、容酶体、细胞膜以及细胞外的蛋白质大多数是糖蛋白。研究表明,催化糖基 的酶在粗面内质网上,这些糖蛋白的糖基化过程从内质网开始,并最后在高尔基复合体中完成。现已知 最多见的部位是寡多糖以共价键形式与多肽链上天冬酰胺(Asn)残基的-NH2基团相连接,称N-结合型 寡多糖。N结合型寡多糖的糖基化(简称N-连接糖基化)过程在粗面内质网完成,连接的寡糖由N-乙 酰葡萄糖胺、甘露糖和葡萄糖组成:另一类发生于高尔基复合体中的糖基化称为0结合型寡多糖(简称 O-连接糖基化),寡糖分子以共价键形式与蛋白质上丝氨酸、苏氨酸、酪氨酸残基侧链的0H基团结合 形成0-连接寡糖糖蛋白,连接的糖为半乳糖或八-乙酰半乳糖胺。完成糖基化修饰的糖蛋白由多肽链和 结合在多肽链上的寡多糖侧链组成,若在蛋白质的许多部位都发生糖基化作用,无疑会干扰蛋白质 在粗面内质网膜上有一种带有高能键的特殊脂质分子多話醇(dolichol),它通过焦磷酸键与寡多糖 相连成为供体,然后把整个寡多糖链转移到多肽链上。寡多糖从多萜醇供体转移到多肽链的天冬酰胺 残基上是在内质网腔面进行的,催化这一过程的糖基转移酶是一种活性部位暴露在内质网腔侧面的膜 结合蛋白质。在蛋白质合成过程中,当内质网腔内多肽链上的天冬酰胺残基露出时,这种酶就将寡多糖 从多萜醇转移到天冬酰胺残基上 在相面内质网上进行的糖基化大多为N连接糖基化,由多萜醇提供的寡多糖含有2个分子N-乙酰 葡糖胺、9个分子甘露糖和3个分子葡萄糖,构成了寡多糖的核心区(core region)和末端区(terminal re g)。该结构与成熟糖蛋白中的寡多糖结构有较大的差别,因此需要修饰和改建。在粗面内质网中, 糖蛋白N糖基化寡糖链上的3个葡萄糖和1个甘露糖分子被切除,实现初步的糖基化修饰,进一步的修 饰和改建则在高尔基体中进行 3.粗面内质网与蛋白质运输研究蛋白质在细胞内的运输途径,电镜放射自显影是较早应用的方 法。早在20世纪60年代,就有人用这一技术研究胰腺细脑的蛋白质分泌活动。胰腺细胞的功能比较 单纯,主要合成供分泌的蛋白质,有利于用放射自显影方法示踪蛋白质在细胞内的合成和运输途径。实 验结果表明,用[H]标记亮氨酸,5分钟后可在粗面内质网探测到放射自显影银粒,再过数分钟后可在 高尔基复合体中见到,37分钟后便进人浓缩泡之中。说明胰腺细胞摄取氨基酸后在内质网参人新合成 的蛋白质然后经高尔基体、分泌颗粒而分泌到细胞外。后来发现,在各种类型的分泌蛋白质细胞中,由 核糖体合成的分泌蛋白质进入内质网腔之后,经过折叠和糖基化作用之后并不能直接分泌,必须经内质 网和高尔基体,到分泌颗粒这一途径。这是分泌蛋白的常见胞吐途径。另一种途径是含有分泌蛋白质 的小泡由内质网脱落后直接形成浓缩泡,再由浓缩泡变为分泌颗粒而出胞。 (二)滑面内质网的功能 虽然在绝大多数细胞中,滑面内质网的形态相似,但其化学组成、酶的种类和含量以及大分子结构 等均存在差异。因此,滑面内质网的功能比较复杂,即使在同一种细胞,滑面内质网也可能有多种功能 1.滑面内质网与脂类、类固醇激素的合成滑面内质网中含有膜脂合成以及胆固醇合成、激素转 化的全套酶系,是细胞内脂类合成的主要场所。脂质分子如磷脂和胆固醇等是由滑面内质网合成的。 395
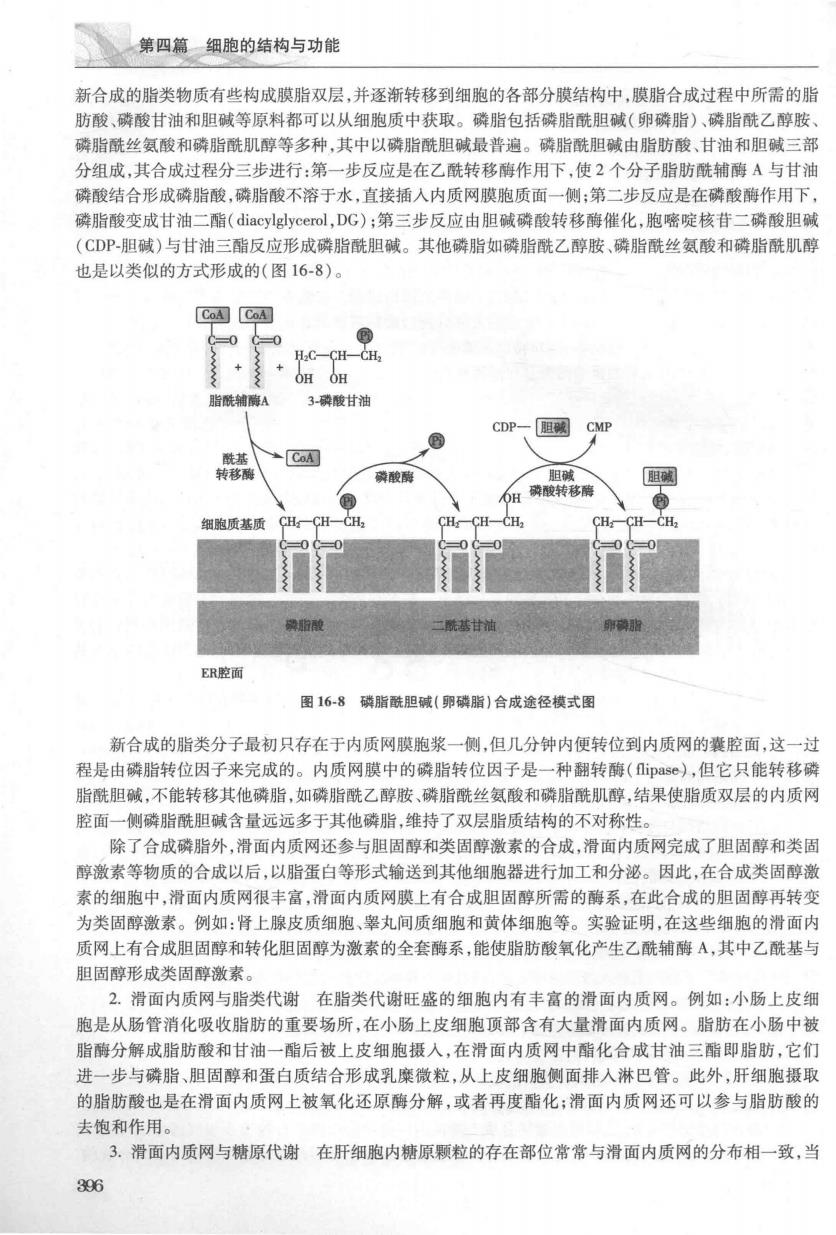
第四篇细胞的结构与功能 新合成的脂类物质有些构成膜脂双层,并逐渐转移到细胞的客部分膜结构中,膜脂合成过程中所需的脂 肪酸,磷酸甘油和胆碱等原料都可以从细胞质中获取。磷脂包括磷脂酰胆碱(卵磷脂)、磷脂酰乙醇胺 曦脂酰丝氨酸和陵脂胜肌醇等多种,其中以磺脂酰胆碱最普骗。磷脂酰胆减由脂肪酸、甘油和胆碱三部 分组成,其合成过程分三步进行:第一步反应是在乙酰转移酶作用下,使2个分子脂肪酰辅酶A与甘油 磷酸结合形成磷脂酸,磷脂酸不溶于水,直接插入内质网膜胞质面一侧:第二步反应是在磷酸酶作用下 破脂酸变成甘油二酯(diacylglycerol,DG):第三步反应由胆碱酸酸转移酶催化,胞嘧啶核苷二硫酸胆碱 (CDP胆碱)与甘油三酯反应形成磷脂酰胆碱。其他磷脂如磷脂酰乙醇胺、,脂酰丝氨酸和磷脂酰肌醇 也是以类似的方式形成的(图16-8) CoA CaA H-C-C CH 3酸甘油 CDP、阻啊CM CoA 磷酸 南酸转移降 细跑质其质CH一CH一CH CH:CH-CH, CH:-CH-CH, 酰基甘油 ER腔面 图16-8碳脂酰胆碱(卵横脂)合成途径掉式图 新合成的脂类分子最初只存在于内质网膜胞浆一侧,但几分钟内便转位到内质网的囊腔面,这一过 程是由磷脂转位因子来完成的。内质网膜中的磷脂转位因子是一种翻转酶(即s©,但它只能转移 脂酰胆碱,不能转移其他磷脂,如磷脂酰乙醇胺、磷脂酰丝氨酸和磷脂酰肌醇,结果使脂质双层的内质网 腔面一侧磷脂酰胆碱含量远远多于其他磷脂,维持了双层脂质结构的不对称性 除了合成磷脂外,滑面内质网还参与胆固醇和类固醇激素的合成,滑面内质网完成了胆固醇和类固 脑激素等物质的合成以后,以脂蛋白等形式输送到其他细胞器讲行加工和卧泌。因此,在合成类固醇 素的细胞中,滑面内质网很丰富,滑面内质网膜上有合成胆固醇所需的酶系,在此合成的胆固醇再转变 为类固醇激素。例如:肾上腺皮质细跑、娶丸间质细胞和黄体细胞等。实验证明,在这些细跑的滑面内 质网上有合成胆固醇和转化胆固醇为激素的全套酶系,能使脂肪酸氧化产生乙酰辅酶A,其中乙酰基与 胆固醇形成类周醇激素 2.滑面内质网与脂类代谢在脂类代谢旺盛的细胞内有丰富的滑面内质网。例如:小肠上皮细 胞是从肠管消化吸收脂肪的重要场所,在小肠上皮细胞顶部含有大量滑面内质网。脂肪在小肠中被 脂酶分解成脂肪酸和甘油一脂后被上皮细胞摄人,在滑面内质网中酯化合成甘油三酯即脂肪,它们 进一步与磷脂、胆固醇和蛋白质结合形成乳糜微粒,从上皮细胞侧面排入淋巴管。此外,肝细胞摄 的脂肪酸也是在滑面内质网上被氧化还原酶分解,或者再度酯化:滑面内质网还可以参与脂肪酸的 去饱和作用。 3.滑面内质网与糖原代谢在肝细胞内糖原颗粒的存在部位常常与滑面内质网的分布相一致,当 396

第十六章细胞内膜系统 糖原颗粒丰富时,滑面内质网被遮盖而不易辨认。在动物被禁食数天之后,糖原减少,滑面内质网明 显可见,提示糖原的代谢似与滑面内质网有关。对于这种现象有不同的解释,有学者认为这是由于 滑面内质网代谢需要能量,可使糖原继发性迁移或聚集;而有的学者认为滑面内质网参与了糖原的 合成和分解 通过对滑面微粒体的生化分析,滑面内质网含有葡萄糖6磷酸酶,与糖原的分解有关。而其他与 糖原合成的酶类均位于细胞溶胶而非滑面内质网。当体内需要化学能时,肝细胞内的糖原在激素的调 控下被磷酸化酶降解为葡萄糖1磷酸,于胞质中再转化为葡萄糖6-磷酸,但质膜对葡萄糖6磷酸具有 不可通透性,因而无法离开肝细胞,也不能被其他细胞所利用。滑面内质网膜中的葡萄糖-6-磷酸酶可 将葡萄糖-6磷酸中的磷酸根脱掉而使其降解为葡萄糖,这样葡萄糖便能穿越内质网膜进入滑面内质网 控,再通膜流系统给送至血液中,以供其他细胞使用 4.滑面内质网与解毒作用 某些脂溶性的代谢产物和药物,具有一定的毒性,而且不能直接被体 内排除,需经过氧化、还原、水解和结合等生物转化过程,使其成为易溶与水的物质而利于排出,这就是 解毒作用(detoxification)。这个生物转化过程主要在滑面内质网上进行。研究表明,滑面内质网中含有 参与这个过程的各种酶系,如还原性辅酶I(NADH)、NADPH-细胞色素c还原酶和细胞色素P450等,其 中细胞色素P450最为重要。细胞鱼素P450相对分子质量为50kDa,为一种末端氧化酶,在肝中具有解 毒作用,它可通过羟基化而使脂溶性废物或代谢产物失活并溶解于水,使一些农药或其他药物失活, 出细胞后送入尿液,从而发挥其解毒作用。服用大量药物的动物,其与解毒有关的酶活性大量增加,引 起滑面内质网增生;但一旦药物消失,多余的滑面内质网便会被溶酶体消化。几天内又恢复至原来的大 小。如给动物服用大量的苯巴比妥,可引起肝细胞内的滑面内质网增生,同时,与解毒作用有关的酶含 量也明显增多。较长期地给动物喂以紫巴比妥,可使肝细跑内的细胞色素P450和NADPH-细胞色素C 还原含量增加50% 100% 5.滑面内质网参与C2·储存和浓度调节。滑面内质网是个多功能的细胞器,在一些特殊的细胞内 可形成特化结构,参与特定的生理过程。如在包括骨骼肌和心肌细胞在内的所有哺乳类动物细胞中形 成一种特化的结构称为肌浆网(sarcoplasmic reticulum),其膜上大量的Ca2泵(Ca2-ATP酶),也称arco olasmic reticulum ca+-ATPase(SERCA),可持续不断地把胞质中的Ca2抽取到内质网腔中,浩成了跨 电化学梯度。SERCA是一种跨膜10次的阳离子转运ATP酶,其结构为四聚体,2端和C2端都位于胞 浆内,似球型结构,能主动把胞浆钙泵人肌浆网内。因此,SERCA在心肌细胞钙稳态的调节中起重要作 用。此外,在肌浆网中还含有捕钙蛋白(calseq i),该蛋白呈强酸性的,对钙具有高度亲和性,实际 上是钙离子的贮存蛋白。因此,当肌肉静息时,肌浆网端池腔中的Ca2“浓度可达(8~10)×10mol/L,为 肌浆中的数千倍。当受到冲动刺激后,肌浆网释放Ca2,引起肌丝收缩:收缩后,肌浆网便利用钙泵讯神 将Ca“从肌浆中予以回收,靠捕钙蛋白将Ca“贮存在肌浆中。 四、内质网与疾病 (一」内质网应激 1。内质网应激的概令当细胞受到外界各种理化因素圳激(如紫外线缺每营养物质缺乏,病壳 氧化应激等),此时细胞内质网功能的内稳态体系被完全打破,内质网由正常状态转变为应激状态,即 内质网应激(endoplasmic reticulum stress,ER stress)。在应激状态下,随着错误折叠和未折叠蛋白在内 质网腔内大量聚集,C2·平衡出现异常。细胞通过激活未折叠蛋白反应等信号通路,直接指导和参与内 质网中异常蛋白质的降解和再折叠,帮助内质网承受并减轻这一压力,维持内质网内环境的稳定,实现 对细胞的保护。内质网应激是细胞内一种话应性机制,持续或过强的内质网应激则诱导细胞周亡浩成 组织损伤。 2.内质网应激的机制内质网应激主要通过三条途径引发应激反应,分别是未折叠蛋白反应 (unfold protein response,UPR)、内质网超负荷反应(endoplasmic reticulum oveload response,EOR)和固醇 397