
第二篇物质代谢及其调节 生命的基本特征之一是生物体内各种物质按照一定规律不断进行新陈代谢(称为“物 质代谢”),借此实现生物体与外界环境的物质交换、自我更新、维持机体内环境的相对恒 定。物质代谢包括合成代谢与分解代谢,并伴随有多种形式的能量变化。这些代谢也不 断处于动态平衡之中。通过物质的合成代谢完成“新物质”的合成,此过程通常需要能量 (消耗能量):而分解代谢往往是对“旧物质”的分解,此过程通常释放能量(产生能量)。 此外,各类物质代谢之间有着广泛的联系,而且机体具有精确调节物质代谢的能力,以满 足不同生理状态所需。若物质代谢及其调节发生了素乱,则往往是一些疾病发生的重要 原因。因此,物质代谢是医学生物化学的重要内容。 本篇主要讨论体内糖、脂类、氨基酸、核苷酸等物质的代谢过程及其调节机制,包括生 物氧化、糖代谢、脂类代谢、氨基酸代谢、核苷酸代谢以及物质代谢的相互联系与调节,共 六章。在学习这一篇内容时,重点应注意掌握各类物质代谢的基本途径、关键酶与主要调 节机制、重要生理意义、各类物质代谢的相互联系等,也需明确物质代谢的异常与疾病的 关系

第四章生物氧化 学习目标 通过本章学习,你应该能够: 掌握 生物氧化、呼吸链、氧化磷酸化的概念,ATP的生成方式、储存和利用。 熟悉 呼吸链中各复合体的组成及作用,两条呼吸链的排列顺序,P/0比值的概 念,影响氧化碳酸化的因素高能磷酸键与高能磷酸化合物的概令。 了解 生物氧化的酶类,了解机体C0的生成方式,了解生物氧化与体外燃烧的 主要异同,递氢体与递电子体的概念,氧化磷酸化的偶联部位,氧化磷酸 化的偶联机制即化学渗透假说,常见的高能磷酸化合物,胞液中NADH氧 化的两种穿梭转运机制,线粒体外其他氧化体系,反应活性氧类的概念, 反应活性氧类对机体的影响,机体主要的抗氧化体系及其作用。 生物氧化(oxidation)是指物质在生物体内所发生的氧化反应。由于自然界中发生的氧化 反应总是与还原反应相伴随即氧化还原反应,因此,生物氧化泛指生物体内发生的所有氧化还原反应, 也包括糖类、脂类、蛋白质等营养物质在生物体活细胞内氧化生成C0,和水并逐步释放能量的过程,所 释放能量用于合成ATP和维持体温。因生物氧化过程消耗氧并产生CO,故又称细胞呼吸。 生物氧化根据其在细胞中的发生部位分为主要位于线粒体的生成ATP的氧化体系和位于微粒体 等细胞器中的不生成ATP的氧化体系。 在体内,生成ATP的生物氧化过程可大体分为三个阶段:①营养物质在线粒体外分解为其基本单 位(葡萄糖、脂肪酸、氨基酸等),释能约低于总能量1%,以热能散发:②葡萄糖等基本单位分解为其相 关代谢中间产物,进人线粒体,转变为乙酰辅酶A。此过程释能约为总能量1/3,经底物水平磷酸化 (substrate-level phosphorylation)合成部分ATP:③乙酰辅酶A经三羧酸循环脱羧、脱氢、并经氧化磷酸化 phosphoryation)合成大量ATP。因此,氧化磷酸化是体内生成ATP的最主要方式。 第一节生物氧化的特点及其酶类 一、生物氧化的特点及方式 营养物质在体内、外氧化的本质是相同的,如消耗氧、终产物(C0,和水)和释出的能量数值均与体 外反应相同。但体外氧化(即燃烧)是有机物中的氢、碳直接与空气中氧生成水及C0,能量以光和热的 形式骤然大量向环境散发。而生物氧化是体内进行的酶促反应,有以下的特点:①氧化反应在近中性 37℃、有水的温和环境中进行;②CO2由脱羧产生,水由底物脱下的氢(以NADH或FADH2的形式)经呼 86

第四章生物氟化 吸链逐步传递电子、最后与氧结合生成:③能量逐步释放,利用率高,其中部分以ATP形式储存、转移和 利用,部分以热能散发用于维持体温:④氧化速率受生理功能需要、体内外环境变化的调控。 生物氧化包括脱电子(得电子)、脱氢(加氢)、加氧(脱氧)等反应方式,其中失去电子或氢原子的物 质称为供电子体或供氢体,接受电子或氢原子的物质称为受电子体或受氢体。 (一)脱电子(得电子)反应 底物在反应过程中脱去电子,脱去的电子由另一物质接受。如细胞色素C,脱去电子,而细胞色素C 得到电子。 细胞色素C-P。 →细胞色素C-F 细胞色素CF。 细胞色素C-F。2 (二)脱氢(加氢)反应 底物在反应过程中脱去一对氢(2H),脱下的氢由受氢体接受,如乳酸脱氢,同时NAD'接受氢(加 氢)。 COOH 乳酸CHOH、 NAD CH, COOH 丙酮酸C=01 NADH+H (三)加氧反应 底物分子中直接加入氧分子或氧原子。 RH+2O2→R-OH 二、生物氧化中C0,的生成 生物氧化的终产物C0,来自脱羧酶催化的有机酸脱羧基作用。根据脱去C0,的羧基位置,脱羧反 应可分为α脱羧和B-脱羧:根据脱羧是否同时伴有脱氢反应,脱羧反应又可分氧化脱羧和单纯脱羧。 (一)c脱羧 1.α-单纯脱羧底物脱去x-羧基生成C02,但不伴有脱氢的过程。 COOH HaN-H- 氨基酸股发酶→HN一(H+C0, 氨基酸 2.α-氧化脱羧底物脱去α羧基生成C02,同时伴有脱氢的过程。 NAD' NADH+H' 丙酮酸 乙酰辅酶入 87

第二篇物质代谢及其调节 (二)B脱羧 1.B-单纯脱羧底物脱去B羧基生成CO2,但不伴有脱氢的过程。 COOH CH3 COOH COOH 草酰乙酸 丙酮酸 2.B-氧化脱羧底物脱去B-羧基生成C02,同时伴有脱氢的过程。 COOH CH 苹果酸-0+0, CH-OH NADP NADPH+H COOH 苹果酸 丙酮酸 三、参与生物氧化的酶类 生物氧化的反应是在一系列酶的催化下进行,这些酶类可分为氧化酶类、脱氢酶类、加氧酶类和氢 过氧化物酶类等。 (一)氧化酶类 氧化酶类(oxidase)能催化代谢底物脱氢,将氢直接交给活化的氧分子生成水,如细胞色素氧化酶、 抗坏血酸氧化酶等。此类酶多为含有铁、铜等金属离子的金属结合酶 2g 代物-2、2 \上0 (二)脱氢酶类 1.需氧脱氢酶需氧脱氢酶(aerobic dehydrogenase)主要存在于过氧化物酶体,催化底物脱氢,脱 下的氢经其辅基FMN或FAD传递给氧分子生成H,O。需氧脱氢酶由于需要FMN或FAD为其辅基, 它们又被称为黄酶类,如黄素蛋白、L氨基酸氧化酶、黄嘌吟氧化酶等。 2H 代谢物-2H 已氧化代物八D分0 2.不需氧脱氢酶不需氧脱氢酶(anaerobic dehydrogenase)能催化底物脱氢,但又不以氧作为直接 受氢体,其直接受氢体为NAD(或NADP)、FMN(或FAD),其中NAD'、FAD是连接代谢物与呼吸链的 环节。不需氧脱氢酶是生物氧化最主要的酶类,如异柠檬酸脱氢酶、琥珀酸脱氢酶等

第西生化 代谢物-2H一H,FAD或NAD 传体-2H宁0, 不需氧脱氢酶 已氧化代谢物 FADH,或NADH+r ,传递体0 (三)加氧酶类 加氧酶(oxyg©nase)主要存在于微粒体,催化向底物加氧原子的酶类,根据向底物分子中加入氧厉 子数目的不同,分为以下两种: 1.加单氧酶加单氧酶(monooxygenase)催化一个氧原子加到底物分子中,又称羟化酶(hydroxy- lase),如苯丙氨酸羟化酶等。 苯丙氨 酪氨酸 2.加双氧酶 加双氧酶(dioxygenase)催化两个氧原子加到底物分子中,如色氨酸加双氧酶等 P -CH,CH-COOH NH NH-G-H 色氨酸 N甲酰犬尿氨酸 (四)氢过氧化物酶类 氢过氧化物酶类主要分布于过氧化物碑体,是催化有机过氧化物或过氧化氢还原的酶,前者为过氧 化物酶(peroxidase,Px),如谷胱甘肽过氧化物酶;后者为过氧化氢酶(catalase,CAT),又称触酶。其辅基 均为铁卟啉。 2CSH+H,0,谷跳甘肤过氯化物鹿,CSC+2H,0 2H,0,过氧化氢群2H,0+0, 第二节生成ATP的氧化体系 一、呼吸链 线粒体内膜上存在的多种酶与辅酶组成的复合体,按一定顺序排列成的连锁性电子传递链,可使代 谢物脱下的氢传递到氧生成水,称为呼吸链(respiratory chain)。其中传递氢的酶或辅酶称为递氢体,传 递电子的酶或辅酶称为递电子体,二者都有传递电子的作用(2H+一→2H+2),故呼吸链也称电子传递 electron transfer chain) 【一】睡吸链的组成 线粒体内膜经化学试剂处理及离子交换层析等方法分离纯化后可得到4种由递氢体和递电子体构 成的酶复合体(表41),其中复合体I、Ⅲ和Ⅳ完全镶嵌在线粒体内膜中,复合体Ⅱ镶嵌在线粒体内膜 的基质侧。复合体各组分相互协调,并在两种游离物质辅酶Q(coenzyme Q,CoQ或Q)和细胞色素 (cytochrome c,Cytc)的共同参与下,完成电子和H的传递

集二有吸代安天精行 表41人线粒体呼吸链复合体 复合体 酶复合体名称 多肽链数目 辅基 NADH-泛碍还原酶 43 FMN.Fe-S 號珀酸泛醒还原酶 4 FAD.Fe-S 泛醒细胞色素C还原酶 11 血红素b,血红素c,Fe-S 细胞色素C氧化酶 13 血红素a,血红素a、Cu 1.复合体1 复合体I(complex I)即NADH-泛醌氧化还原酶(NADH-), 是跨线粒体内膜的酶复合体,分子量1000kDa,由43条多肽链组成,其构象呈倒“L”形状(图4 I),卧臂位于内膜中,竖臂突入基质。复合体I含有以FMN为辅基的NADH脱氢酶和以铁硫中心 (iron-sulfur cluster)为辅基的铁硫蛋白(iron~sulfur protein),接受来自NADH+H'的电子并转移给 泛醌。 胞液侧 2 基质侧 琥珀酸 120+2 NADH+H NAD 延胡索酸 A 图41呼吸链中酶复合体的电子传递示意图 NAD'(烟酰胺腺嘌吟二核苷酸,)是脱氢酶的辅酶,可接受代谢物形 下的2H,形成还原型的烟酰胺腺嘌吟二核苷酸(NADH+H)。NAD'分子中烟酰胺芳环中的氮为5价 (图42),易接受电子被还原,同时芳环也接受1个质子进行加氢反应,但另外一个质子则游离在周围 介质中,因此,还原型的烟酰胺腺嘌吟二核苷酸写为NADH+H(图4-3)。 氧化型FMN(黄素单核苷酸,flavin mononucleotide)也作为递氢体,其分子中的异咯嗪环可接受1个 电子和I个质子生成半醌型FMN或FAD自由基(FMNH'或FADH),再接受1个电子和1个质子成还 原型FMNH2或FADH2(图4-4)。 呼吸链中有多种铁硫蛋白,其中的F离子通过与无机硫(S)原子或(和)铁硫蛋白多肽链的半胱氨 酸残基连接形成铁硫中心(Fe-S,图4-5)而得名。铁硫中心有3种类型:Fe-S、Fe,S,、Fe,S,(图4-6),其 中的铁离子可进行:Fe+e 一→F©2“的可逆反应传递1个电子,故为单电子传递体。 泛醌又称辅酶Q,是一种含有脂溶性多异戊二烯侧链的辅酶,人的CQ侧链含有10个异戊二烯单 位,用CoQ表示。由于CoQ能在线粒体内膜中自由流动,同时传递质子和电子,可在复合体间募集并 穿梭传递还原当量(图4-7),在呼吸链中具有重要作用。 复合体I可催化两个同时进行的过程:将一对电子从NADH传递给CoQ的过程中,可同时偶 联质子的泵出过程,将4个H从内膜的基质侧泵到内膜的胞质侧,泵出质子所需能量来自电子传 90
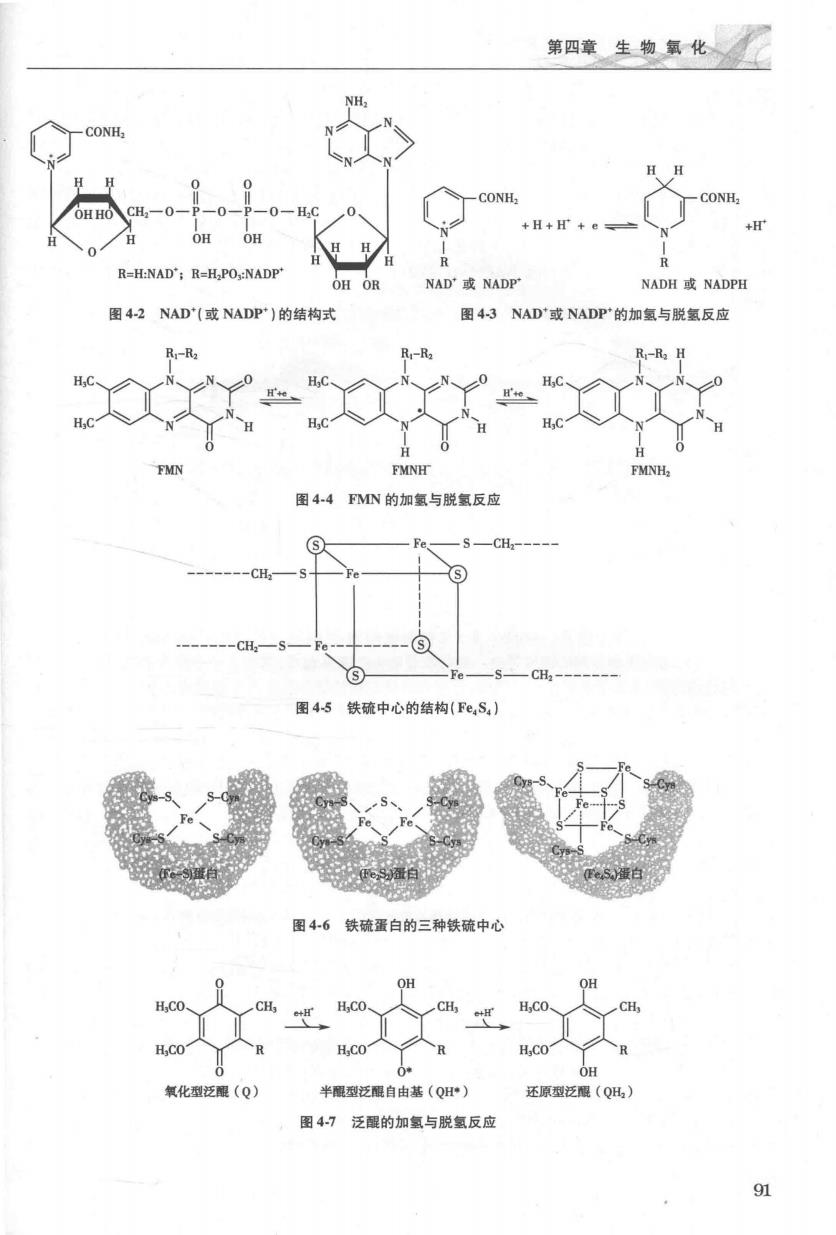
第西生典化 CONH ⊙ =H:NAD':R=H PONAD ADH E或NADPE 图4-2NAD'(或NADP)的结构式 43 ADP的加氢与脱氢反应 图44FMN的加氢与脱氯反应 S-CH CH CH 图45铁硫中心的结构(Fe,S,) 围46铁硫蛋白的三种铁硫中心 化型泛眼(0) 半醌型泛醌自由基(QH) 还原型泛限(0 图4-7泛醒的加氢与脱氢反应
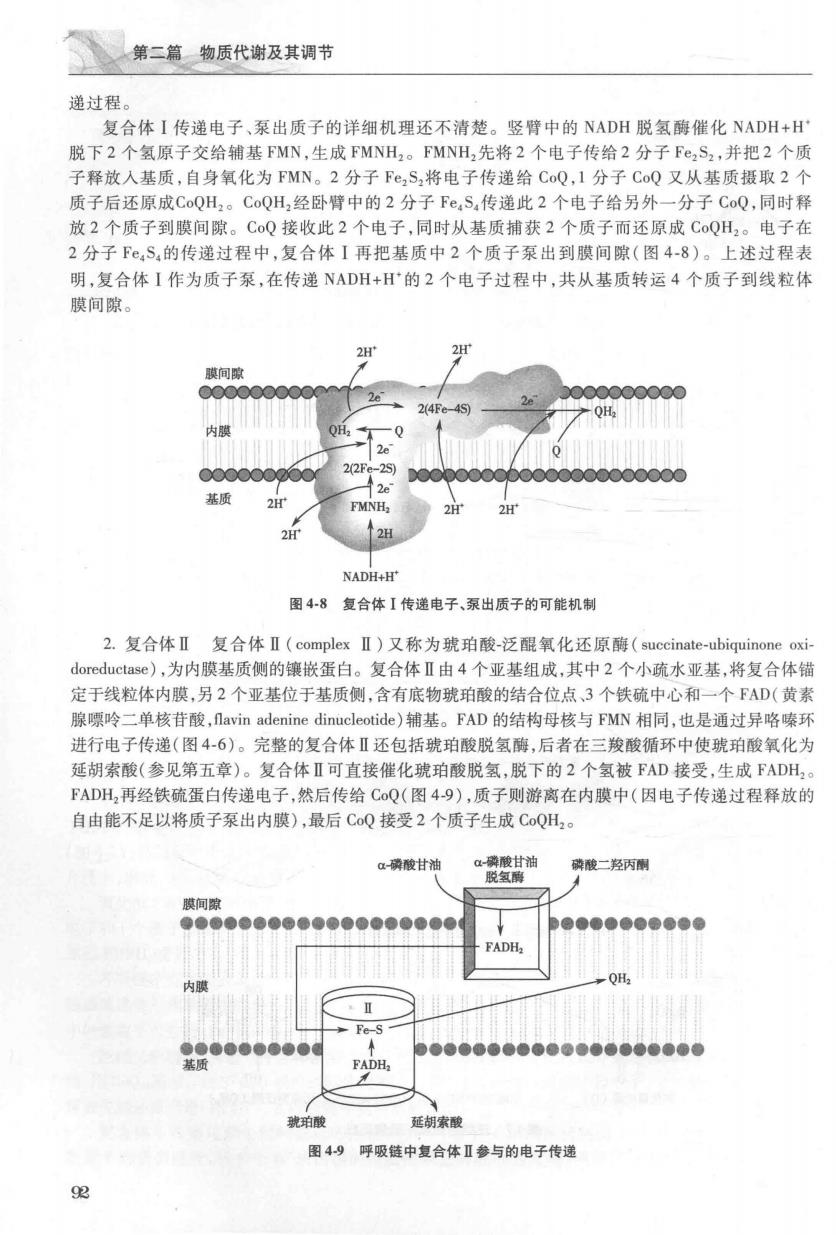
体二黄物奶代卷及共得节 递过程。 复合体I传递电子、泵出质子的详细机理还不清楚。竖臂中的NADH脱氢酶催化NADH+H 脱下2个氢原子交给辅基FMN,生成FMNH,。FMNH,先将2个电子传给2分子Fe,S2,并把2个质 子释放入基质,自身氧化为FMN。2分子Fe,S,将电子传递给CoQ,1分子CoQ又从基质摄取2个 质子后还原成CoQH2。CoQH,经卧臂中的2分子Fe,S,传递此2个电子给另外一分子CoQ,同时释 放2个质子到膜间隙。Co0接收此2个电子,同时从基质捕获2个质子而还原成Co0H,。电子在 2分子F,S,的传递寸程中,复合体I再把基质中2个质子泵出到膜间隙(图4.8)。上术过程表 明,复合体I作为质子泵,在传递NADH+H的2个电子过程中,共从基质转运4个质子到线粒体 膜间隙。 间配 NADH-H' 图48复合体【传递电子、泵出质子的可能机制 2.复合体Ⅱ复合体Ⅱ(complexⅡ)又称为琥珀酸-泛醒氧化还原酶(succinate-ubiquinone oxi doreductase),为内膜基质侧的镶按蛋白。复合体Ⅱ由4个亚基组成,其中2个小硫水亚基,将复合体错 定于线粒体内膜,另2个亚基位于基质侧,含有底物琥珀酸的结合位点,3个铁硫中心和一个FAD(黄素 腺嘌呤二单核苷酸,favin adenine dinucleotide)辅基。FAD的结构母核与FMN相同,也是通过异咯嗪环 进行电子传递(图4-6)。完整的复合体Ⅱ还包括琥珀酸脱氢酶,后者在三羧酸循环中使琥珀酸氧化为 延胡索酸(参见第五章)。复合体Ⅱ可直接催化琥珀酸脱氢,脱下的2个氢被FD接受,生成FADH FADH,再经铁硫蛋白传递电子,然后传给CoQ(图49),质子则游离在内膜中(因电子传递过程释放的 自由能不足以将质子泵出内膜),最后CQ接受2个质子生成CQH,。 α磷酸甘油 酸二羟丙 ●0●●●●●●●●● FADH. .I 珀酸 延胡索酸 图49呼吸链中复合体Ⅱ参与的电子传递 92

第四康生物化 此外,代谢途径中一些以FAD为辅基的脱氢酶,如线粒体的α磷酸甘油脱氢酶、脂酰CoA脱氢酶 等,可以将相应底物脱下的2个电子和2个质子交给FAD生成FADH,再由FADH,传递给CQ,生 成QH2。 3.复合体Ⅲ复合体Ⅲ(complexⅢ)又称泛醌-细胞色素氧化还原(ubiquinone doredutase)。人复合体Ⅲ含有三种细胞色素(cytochrome,Cyt)和铁硫蛋白(Fe,S,)。三种Cyt分别是Cyt b(辅基为高还原电位血红素b,)、Ctb(辅基为低还原电位血红素b,)和Cvtc,(铺基为血红素c,) 细胞色素由David Keilin首先发现的一类含血红素样辅基的催化电子传递的酶类,通过血红素分子 中Fe“+e→Fe2“的可逆反应传递电子,为单电子传递体。根据细胞色素吸收光谱和最大吸收波长的 不同,可分为a、b,©三类以及不同亚类。其辅基血红素也相应分为血红素a、血红素b和血红素©。血 红素b辅基为原啉Ⅸ,血红素a辅基含有聚异戊烯的侧链,而血红素©辅基的乙烯侧链则与蛋白质中半 胱氨酸残基的巯基以共价罐相连(图4-10)。 蛋白质 CH CH,fCHa-CH=C-CH H.C CH=CH LC. CH CH. C00 C00 C00 C00 cyt基 c辅 图410细胞色素(辅基)的结构 复合休Ⅲ的作用是把OH的2个由千经铁硫蛋白传递给Ctc.甘付得主要诵付0循环(0cve) 成。Q循环是一个较为复杂的电子传递过程,2分子QH,将2个电子传递到Cy1c的同时,偶联泵出4个 质子到膜间隙,又生成1分子QH,和1分子Q,故实际只氧化了1分子QH, Cytc是由一条肽链组成、分子量13kDa、辅基为血红素c的水溶性球状蛋白。Cytc靠静电引力疏 松地结合在线粒体内膜外表面,可沿外表面在复合体Ⅲ、V间滑动,依其血红素中Fe·+e→Fe2“的可 逆反应把电子从Cytc,传递到复合体N。 4.复合体N人复合体V(complex IV)又称细胞色素c氧化酶(cytochrome e oxidase),是分子量为 200kDa的由13个亚基组成的跨膜蛋白复合体,其中由线粒体基因编码的亚基、亚基Ⅱ和亚基Ⅲ是 功能必不可少的,其余亚基则作为酵活性的调节基团起作用。亚基I横跨线粒体内膜,含Cyta、Cya (辅基分别为血红素a、a3,因二者结合紧密,常写作Cyt aa,)和一个铜离子,称为CuB。Cyta与CuB共 同构成使O,还原为H,0的活性中心。亚基Ⅱ含有2个与半胱氨酸的巯基相连接的铜离子,称为CuA, 形成铜中心。蛋白结合的Cu可发生C←一→Cu2+e的可逆反应,也属单电子传递体。亚基Ⅲ的功能 主要与泵出质子有关。 复合体V的功能是把Cytc传递来的电子经Cyt aa,传递给O,从而生成水。其基本过程是:2分子 Ctc先后把2个电子经Cu构成的铜中心传给Cyta,Cyta再传递电子到Cyta,-Cu构成的活性中心, 进而氧被还原成氧离子,并与从基质摄取的2个质子结合生成1分子水,同时把另外2个质子从基质泵 出到膜间隙(图4-11)。NADH+H或FADH,进入呼吸链传递的电子最后都经复合体V传递后生成水。 呼吸链的4个复合体中,复合体I、Ⅲ、V均有质子泵(proton pump)的功能,它们在传递电子的同时

第二篇物质代谢及其调节 膜间 ●●●●●●●●●● ●●●●●●●● ●●色●● 基质 120,2 图411复合体Ⅳ的结构及传递电子、泵出质子的过程 把质子从基质泵出到膜间隙,每传递一对电子,它们分别向线粒体膜间隙泵出4、4和2个H。由于质 子泵的作用,基质成为负电性空间,而膜间隙成为正电性空间,从而形成电化学梯度,蕴藏着电化学势 能。此势能可部分用于合成ATP,部分以热能散发,维持体温。 (二)呼吸链各组分的排列顺序 线粒体内膜中呼吸链的4种复合体均独立存在,并可在一定范围移动,CQ因呈脂溶性移动更活 跃,C©也可在内膜外表面移动。这种移动使它们可相互碰撞接触,形成连锁性氧化还原反应而成为 呼吸链。呼吸链各组分的排列顺序通过综合分析以下4个方面实验结果确定:①测定呼吸链各组分的 标准氧化还原电位。标准氧化还原电位是指在特定条件下,参与氧化还原反应的组分对电子的亲和力 大小。电位高的对电子的亲和力强,易接受电子:相反,点位低的组分倾向于给出电子。因此,呼吸链中 电子应从电位低的组分向电位较高的组分进行传递(表42):②体外将呼吸链组分拆开,通过各独立成 员的体外重组来鉴定其排列顺序;③在底物存在时,利用氧化特异的抑制剂阻断某一组分的电子传递 在阻断部位以前的组分处于还原状态,后面的组分处于氧化状态。根据各组分的氧化和还原状态吸收 光谱的改变分析其排列顺序:④利用呼吸链各组分特有的吸收光谱,以离体线粒体无氧时处于还原状态 为对照,在缓慢给氧状态下,观察各组分被氧化的顺序。综合分析上述4个方面实验结果,确定了呼吸 链各组分的排列顺序及电子传递方向(图4-12)。 表42呼吸链各电子传递体的标准氧化还原电位(伏特,V) 氧化型/还原型 传递电子数 E'(v) NAD/NADH+H 2 -0.32 FMN/EMNH. 2 -0.219 FAD/FADH 2 -0.219 Coo/CoOH 2 .060 Cyt b(Fe)/Cyt b(Fe") 1 0.100 Cyte(Fe)/Cyt e (Fe) 1 0.20 Cyt e(Fe)/Cyt c(Fe) 0.254 Cyt a(Fe)/Cyt a(Fe) 1 0.290 Cyta(Fe)/Cyta Fe 1 0.550 1/20+2H/H,0 0.816 ·E°表示在pH7.0,温度为25℃,电子传递体浓度为1/L时,测得的标准氧化还原电位(伏特,V)。 04