
第七章氨基酸代谢 学习目标 通过本章的学习,你应该能够: 掌握氨平衡的概念,营养必需氨基酸的概念,蛋白质腐败作用的概念,氨基酸 的转氨基作用,丙氨酸氨基转移酶催化的反应及其辅酶,联合脱氨基作 用,体内氨的来源、去路与转运,尿素合成的部位、基本过程、关健酶及其 生理意义,一碳单位的概念、载体、生成原料及主要生理作用,S腺苷甲硫 氨酸的生成、作用及其与一碳单位代谢的联系,甲基与硫酸根在体内的活 化形式。 熟悉食物蛋白质在胃肠的消化过程,氧化脱氨基作用,α酮酸的代谢途径,氨 酸的脱羧基作用,苯丙氨酸转变成酪氨酸的过程,苯丙氨酸羟化酶及其 酸 了解蛋白质的生理功能,蛋白质生理需要量,营养必需氨基酸的种类,蛋白 质营养价值和互补作用的概念,氨基酸在小肠的吸收方式,假神经递质 的概念,蛋白质腐败产物及其对人类健康的利弊,体内蛋白质降解方 式,氨基酸代谢库的概念,嘌呤核苷酸循环,非氧化脱氨基作用,尿素合 成的调节,高血氨症和氨中毒,生糖氨基酸、生酮氨基酸、生糖兼生酮氨 基酸的概念,Y氨基丁酸、组胺,5-羟色胺、多胺类物质的生成及作用, 碳单位的种类、一碳单位的生成及相互转变,甲硫氨酸循环及其生理意 义,维生素B在甲硫氨酸循环中的作用,活性硫酸根、牛磺酸的生成 肌酸与磁酸肌酸的代谢,路氨酸在体内转恋的主要活性物质,儿茶酚砖 的合成与帕金森氏病的关系,黑色素的合成与白化病的关系,酪氨酸的 彻底氧化与尿黑酸尿症的关系,支链氨基酸的分解代谢,氨基酸衍生的 其他重要含氮氨化合物。 氨基酸具有重要的生理功能,在机体的物质代谢和能量代谢中具有重要意义。氨基酸是蛋白质的 组成单位,利用氨基酸合成蛋白质的过程将在第十三章蛋白质的生物合成中介绍。除了作为蛋白质合 成的原料外,许多氨基酸在机体代谢过程中还能以各种方式转变,生成具有重要生理功能的含氮化合 物,如儿茶酚胺、甲状腺激素、嘌、嘧啶等,也可产生一些重要的化学基团。有些氨基酸本身具有特殊 的生理功能,如:丙氨酸和谷氨酰胺参与组织间的运氨作用:谷氨酸和天冬氨酸是兴奋性神经递质:甘氨 酸是抑制性神经递质,还参与生物转化作用等。氨基酸还可氧化分解供能。氨基酸在体内的代谢包括 分解代谢和合成代谢,本章主要讨论分解代谢。 182

第七家县装酸代凿 第一节蛋白质的营养作用 一、蛋白质的生理功能 (一)维持细胞组织的生长、更新和修补 蛋白质是细胞组织的主要成分。因此,参与构成各种细胞组织是蛋白质最重要的功能。食物蛋白 质是体内氨基酸的重要来源。提供足量、优质的食物蛋白质以获得机体所需的氨基酸,维持细胞组织生 长、更新和修补的需要,这对于生长发育期的儿童及康复期的患者尤为重要。 (二)参与多种重要的生理活动 蛋白质是机体生命活动的重要物质基础。体内具有多种特殊功能的蛋白质,例如酶、抗体、某些激 素和调节蛋白等。肌肉收缩、物质运输、血液凝固等也均有蛋白质参与。此外,氨基酸代谢过程中还可 产生嘌呤、嘧啶、胺类、神经递质等重要含氮化合物。 (三)氧化供能 般成人每日约有18%的能量来自蛋白质分解代谢。但是氧化供能只是蛋白质的次要功能,可由 糖或脂肪代替。 二、氮平衡 氮平衡(nitrogen balance)是指每日氮的摄入量与排出量之间的关系,是反映体内蛋白质代谢状况 的一项指标。蛋白质的含氮量平均约为16%。摄入氮主要来源于食物中的蛋白质,主要用于体内蛋白 质的合成;而排出氮主要来源于粪便和尿液中的含氮化合物,主要是体内蛋白质分解代谢的终产物。因 此,测定摄入食物中的含氯量与排泄物中的含氮量之间的关系基本可以反映体内蛋白质合成与分解代 谢的状况。人体氮平衡有三种情况,即氨的总平衡、氮的正平衡及氨的负平衡。 氮的总平衡,即摄入氮=排出氯,反映体内蛋白质合成与分解处于动态平衡,即氮的收支平衡,见于 营养正常的成人。正常成人不再生长,每日进食的蛋白质主要用于维持组织结构、功能蛋白质更新。 氨的正平衡,即摄入氮>排出氮,反映体内蛋白质合成大于分解,以满足生长发育的需要,儿童、孕 妇及康复期的患者属于此种情况。 氮的负平衡,即摄入氮<排出氮,反映体内蛋白质合成小于分解,见于饥饿、严重烧伤、消耗性疾病 或长期营养不良等。 当正常成人食用不含蛋白质的膳食约8天后,每日排出的氯量逐渐趋于恒定,此时每千克体重每日 排出的氮氨量约为53mg,故一位60kg体重的成人每日蛋白质的最低分解量约为20g。由于食物蛋白质和 人体蛋白质中氨基酸组成的差异,不可能全部被利用,为维持氮的总平衡,成人每日蛋白质的最低生理 需要量为30-50g。为了长期保持氮的总平衡,我国营养学会推荐成人每日的蛋白质需要量为80g。 三、蛋白质的营养价值 营养学上把机体需要而又不能自身合成,必须由食物提供的氨基酸称为营养必需氨基酸 (amino acid)。人体内营养必需氨基酸有8种,它们是:缬氨酸,异亮氨酸、亮氨酸 苯丙氨酸、甲硫氨酸、色氨酸、苏氨酸、赖氨酸。其余12种氨基酸可以在人体内合成,称为营养非必需氨 基酸(nutritionally non-essential amino acid)。其中,组氨酸和精氨酸虽然能在人体内合成但合成量较 少,需要从食物中补充,也有人将其归为营养必需氨基酸。合成酪氨酸需要消耗苯丙氨酸,合成半胱 酸需要消耗甲硫氨酸,酪氨酸和半胱氨酸通过消耗营养必需氨基酸而间接依赖食物供给。如果膳食中 提供了足够的酪氨酸和半胱氨酸,则人体对苯丙氨酸和甲硫氨酸的需要可分别减少50%和30%。 183

蛋白质的营养价值(nutrition value)是指食物蛋白质在体内的利用率,其高低主要取决于食物蛋白 质中营养必需氨基酸的种类、数量和比例。一般来说,含营养必需氨基酸种类多、数量足的蛋白质营养 价值高,反之则营养价值低。 将几种营养价值较低的蛋白质混合食用,彼此间营养必需氨基酸可以得到互相补充,从而提高蛋白 质的营养价值,这种作用称为食物蛋白质的互补作用(complementary action)。例如,谷类蛋白质含赖氨 酸较少而含色氨酸较多,豆类蛋白质含赖氨酸较多而含色氨酸较少,两者混合食用即可提高营养价值。 某些疾病情况下,为了保证患者氨基酸的需要,可进行混合氨基酸输液 第二节体内氨基酸的来源 一、食物蛋白质的消化、吸收及腐败作用 (一)食物蛋白质的消化 食物蛋白质的消化、吸收是体内氨基酸的主要来源。同时,消化过程还可消除食物蛋白质的抗原 性,避免引起过敏反应和毒性反应。食物蛋白质需经消化道中一系列酶促反应,分解为小肽和氨基酸才 能被吸收。口腔的唾液中没有水解蛋白质的酶,食物蛋白质的消化自胃开始,而主要的消化过程是在小 肠进行。 胃肠道中的蛋白水解酶根据对蛋白质水解的部位可分为内肽酶和外肽酶。内肽酶特异地水解肽链 内部的肽键;外肽酶则特异地水解肽链末端的肽键,自肽链N-末端(称氨基肽酶)或C-末端(称羧基肽 酶)的氨基酸开始水解肽链,每次水解掉一个氨基酸残基(图7)。这些蛋白水解酶对不同氨基酸组成 的肽键具有一定的专一性(表71)。 氨基肽酶 H -NH-CH-COO 氮基 H-GH一CO0E R 氨基酸 图71蛋白水解作用示意图 表71蛋白水解作用的专一性 蛋白水解酶 专一性 内肽酶 胃蛋白酶 R,=Tp,Phe、Tyr、Ala,Met,Lcu 凡=任何氨基酸残基 胰蛋白酶 R,=Arg、Lys R=任何氨基酸残基 糜蛋白酶 R=Phie,Tr、Tp R,=任何氨基酸残基 184

年七康复基程代世 续表 蛋白水解酶 专一性 弹性蛋白酶 R,=胎防族氨基酸残基 凡,=任何氨基酸残基 外肽酶 羧基肽酶A 民=任何氨基酸残基 R,=除Arg,Lys,Pm外任何氨基酸残基 发基肽酶B R=任何氨基酸残基 R4=Arg、Lys 氨基肽酶 R,=任何氨基酸残基 R=除Pm外任何氨基酸残基 1.胃中的消化食物蛋白质进入胃后,经胃蛋白酶作用水解生成多肽和少量氨基酸。胃黏膜主细 胞合成分泌胃蛋白酶原,经胃酸激活或胃蛋白酶自身激活,去除N末端42个氨基酸残基后转变成有活 性的胃蛋白酶。胃蛋白酶的最适pH为1.5~2.5。酸性胃液可使蛋白质变性,有利于蛋白质的水解 胃蛋白酶对肽键的特异性较低,主要水解由芳香族氨基酸、亮氨酸或甲硫氨酸残基等所形成的肽键。胃 蛋白酶还具有凝乳作用,可使乳汁中的酪蛋白与C“形成凝乳块,使乳汁在胃中的停留时间延长,有利 于乳汁中蛋白质的消化。 2.小肠中的消化食物在胃中的停留时间较短,因此食物蛋白质在胃中的消化是不完全的。小肠 是食物蛋白质消化的主要部位。胃中消化不完全及未被消化的蛋白质进入小肠,由胰腺及肠黏膜细胞 分泌的多种蛋白水解酶和肽酶协同作用,进一步水解成小肽和氨基酸。 (1)胰液蛋白酶及其作用:进入小肠的蛋白质消化主要靠胰液中的胰酶完成,这些酶最适pH为 7.0左右,包括胰蛋白酶、糜蛋白酶、弹性蛋白酶及羧基肽酶A和羧基肽酶B。蛋白质在胰液蛋白酶作 用下最终产物为氨基酸和一些寡肽。 胰腺细胞最初分泌的各种蛋白酶和肽酶都是以酶原的形式分泌到十二指肠,之后被肠激酶激活 肠激酶也是一种蛋白水解酶,由十二指肠黏膜细胞分泌,特异地作用于胰蛋白酶原,从其八末端水解掉 1分子六肽,生成有活性的胰蛋白酶。胰蛋白酶的自身激活作用较弱,但能迅速激活糜蛋白酶原、弹性 蛋白酶原及羧基肽酶原(图72)。由于胰液中各种蛋白酶均以酶原的形式存在,同时胰液中还存在胰 蛋白酶抑制剂,议样能保护胰腺组织免受蛋白酶的自身谐化 胰蛋白牌原 一肠激阿 一胰蛋白酶 弹性蛋白晚原。己 ·弹性蛋白酶 图72胰酶的激活过程 (2)小肠黏膜细胞寡肽酶的作用:蛋白质经胃液和胰液中各种酶消化,产物仅1/3为氨基酸,2/3 为寡肽。寡肽的水解主要在小肠黏膜细胞内进行。小肠黏膜细胞存在着两种寡肽酶:氨基肽酶和二肽 酶。氨基肽酶从氨基末端逐个水解出氨基酸,剩下的二肽再经二肽酶水解,最终水解成氨基酸。 食物蛋白质在胃和小肠中各种酶的协同作用下,消化效率很高,95%的食物蛋白质可被完全水解成 氨基酸和少量的二肽和三肽,直接被机体吸收。 (二)氨基酸的转运吸收 氨基酸的吸收主要在小肠进行。食物蛋白质消化水解生成的氨基酸和小肽,通过主动转运机制被 185

第二篇物质代谢及其调节 吸收。转运的方式主要有以下两种方式: 1,转运蛋白已知体内至少有七种转运蛋白参与氨基酸和小肽(主要是二肽、三肽)的转运。这些 转运蛋白包括中性氨基酸转运蛋白、碱性氨基酸转运蛋白、酸性氨基酸转运蛋白、亚氨基酸转运蛋白、B 氨基酸转运蛋白、二肽转运蛋白及三肽转运蛋白。这些转运蛋白能与氨基酸或小肽和N结合形成 联体复合物,将氨基酸或小肽和Na'同向转运人细胞内,N阳'则借钠泵排出细胞外,并消耗ATP 某些氨基酸由于在结构上有一定的相似性,它们共用同一种转运载体,在吸收过程中彼此竞争。转 运蛋白吸收氨基酸的方式不仅存在于小肠黏膜细胞,还存在于肾小管细胞、肌细胞等的细胞膜上。小肽 转运载体主要分布于小肠近端,故肽吸收入细胞甚至先于游离氨基酸。 2.v-谷氨酰基循环小肠黏膜细跑、肾小管细胞和脑组织吸收氨基酸还可通过γ-谷氨酰基循环 (y-glutamyl cycle)进行。此循环由Meister提出,也称Meister循环。其反应过程是首先通过细胞内谷胱 甘肽的水解,释放出Y谷氨酰基,再从细胞外结合1分子氨基酸转运至胞内,然后再进行谷胱甘肽的合 成,由此构成一个循环(图73) 细胞外 细胞膜 细胞内 COOH COOH HN-C-H 900H NH H 转移酶 氨基酸 一H 0 氨燕酸 谷甘驾酸个 半胱氨酸 人ADP+PR 谷氨酸 AP合成 A ATP Y-谷氨酰半跳氨酸 ADP+Pi 图73Y谷氨酰基循可 催化上述反应的各种酶中,γ谷氨酰基转移酶是关键酶,位于细胞膜上,其余的酶均存在于胞液中 此循环每转运1分子氨基酸需消耗3分子ATP,均用于谷胱甘肽的再合成。Y谷氨酰基循环对不同种 类氨基酸的转运活性有所不同,对谷氨酰胺、半胱氨酸及一些中性氨基酸的转运活性最高,而对天冬氨 酸、某些支链氨基酸及芳香族氨基酸则活性较差,对脯氨酸完全不起作用。 (三)蛋白质的肠内腐败作用 肠道细菌对肠道中未被消化的蛋白质及未被吸收的氨基酸的分解作用称为腐败作用 (putrefaction)。实际上,腐败作用是肠道细菌本身的代谢过程,以无氧分解为主。腐做作用的产物大多 数对机体有害,如胺、氨、酚、吲噪及硫化氢等,但也有小部分产物对人体具有一定的营养作用,如脂肪酸 及维生素等。 1.胺类物质的生成未被消化的蛋白质经肠道细菌蛋白酶的作用水解生成氨基酸,氨基酸再在细 菌氨基酸脱羧酶作用下脱去羧基生成胺类(amines)。例如,组氨酸,赖氨酸、色氨酸、酪氨酸及苯丙氨酸 脱羧基分别生成相应的组胺、尸胺、色胺、酪胺及苯乙胺。这些衡败产物大多有毒,例如组胺和尸胺有降 低血压的作用,酪胺有升高血压的作用。这些有毒物质通常经肝的生物转化作用转化为无毒形式排出 体外。酪胺和苯乙胺若不能在肝中及时转化,则易进入脑组织,分别经B羟化酶作用生成B-多巴胺(羟 酪胺)和苯乙醇胺。由于它们的分子结构与脑内的神经递质儿茶酚胺相似,故称假神经递质(false neu rotransmitter)。假神经递质增多时,可竞争性干扰脑内儿茶酚胺的合成及作用,阻碍神经冲动传递,引起 186

第七章氨基酸代谢 大脑产生异常抑制。这可能是肝性脑病发生的原因之一。 CH,NH, CHaNH CHNH H-C-OH H-C-OH OH 苯乙胺 苯乙醇胺 略胺 B-羟略胺 2.氨的生成未被吸收的氨基酸在肠道细菌作用下,通过脱氨基作用生成氨(ammonia),这是肠道 氨的重要来源之一。此外,肠道氨的另一来源是血液中的尿素渗入肠道,经肠道细菌尿素酶水解而生成 氨。肠道内产生的氨可进入血液,成为血氨的来源之一。降低肠道的pH,可减少氨的吸收。 3。其他有害物质的生成除胺类和氨外,通过腐败作用还可产生其他有害物质,如:酪氨酸可产生 苯酚、甲苯酚:色氨酸可产生吲引哚、甲基吲哚,导致粪便臭味;半胱氨酸可分解产生H,S,导致消化吸收不 良、腹胀等。 正常情况下,腐败作用产生的有害物质大部分随粪便排出体外,只有小部分被吸收进入血液,经肝 的生物转化而解毒,故不会发生中毒现象。但习惯性便秘、肠梗阻、蛋白质食用过量或消化吸收障碍者」 腐败产物吸收增加,严重时可产生中毒现象。 二、组织蛋白质的降解 虽然机体依靠食物蛋白质补充氨基酸,但机体内游离氨基酸并非全部来自食物蛋白质。在人体的 生命活动中,体内蛋白质处于不断合成与降解的动态平衡。所以,机体内游离氨基酸也包含由体内组织 蛋白质降解产生的氨基酸。 正常情况下,成人体内的蛋白质每天约有1%一2%被隆解其中主要是肌肉蛋白质。在特殊生理 情况下的组织,如妊娠期间的子宫、严重饥饿和长期大量体能消耗下的骨酪肌组织等,其组织蛋白质会 发生快速降解。蛋白质降解产生的氨基酸,大约75%~80%又被重新利用合成新的蛋白质,其余 20%~25%机体不予储存,全部进入氨基酸代谢库,参加氨基酸的分解与转化代谢 (一)蛋白质降解速率 所有生命体的蛋白质都在不断更新。体内的任何一种蛋白质都不会长期存在而不被降解,也就 是说体内的任何蛋白质都会被降解。蛋白质降解速率可用半寿期(half life,ta)表示,即指蛋白质降 解到其原浓度一半所需要的时间。蛋白质降解速率随生理需要而变化,在各种蛋白质之间有很大差 异。细胞内必要的结构蛋白寿命都比较长,而负责细胞特殊应变的调节蛋白寿命往往比较短。例 如.肝中大部分蛋白质的t,为1~8天,人血浆蛋白质的约为10天,结缔组织中的一些蛋白质的 t可达180天以上,眼晶体蛋白质的2更长。体内许多关键酶的都很短,如HMG-CoA还原酶的 为0.5~2小时。有些调控基因表达和细胞间信息传递的蛋白因子的t仅在分秒之间。细胞内 蛋白质寿命与其结构相关。通常认为在蛋白质N端特定区域的氨基酸序列中包含了决定其半寿期 的结构信号。 (二)真核细胞蛋白质降解途径 细胞内蛋白质的降解也是通过一系列蛋白酶和肽酶完成的。蛋白质被蛋白酶水解成肽,肽被肽酶 降解成游离氨基酸。但是,这些酶不能任意水解细胞内的蛋白质,否则细胞会被迅速破坏。细胞内蛋白 质的降解是主动调节的过程。真核细胞内蛋白质的降解主要有两条途径:一条是蛋白质通过不依赖 ATP的溶酶体途径降解,另一条是蛋白质通过依赖ATP的泛素-蛋白南体途径降解 1.不依赖ATP的溶酶体途径 溶酶体是细胞内的消化器官,含有多种酸性蛋白水解酶,又称组织 蛋白酶。这些酶对所降解蛋白质选择性较差。此途径主要降解外源性蛋白、膜蛋白和胞内长寿命蛋白。 187

第二篇物质代谢及其调节 蛋白质通过此途径降解,不需要消耗ATP 根据完成生理功能的不同阶段,溶酶体可分为初级溶酶体、次级溶酶体和残体。初级溶酶体由高尔 基体分泌形成,含有多种水解酶原,当其他物质进入溶酶体或溶酶体破裂时酶才被激活。除组织蛋白酶 外,初级溶酶体还含有磷脂酶、核酸酶、磷酸酶、硫酸酯酶等多种酸性水解酶,反应的最适pH5左右。次 级溶酶体是正在进行或完成消化作用的消化泡,含有水解酶和相应底物,自噬溶酶体消化来自细胞自身 的各种组分,异噬溶酶体消化外源物质。残体又称后溶酶体,已经失去酶活性,仅留未消化的残渣。残 体可以通过外排作用排出细胞,也可以留在细胞内逐年增多。具有摄人胞外物质能力的细胞,可以通过 内吞作用摄入胞外蛋白质,由溶酶体的组织蛋白酶将其降解。溶酶体也可以清除细胞自身无用的生物 大分子、衰老细胞器等,即自体吞噬,并将其降解。 2.依赖ATP的泛素蛋白酶体途径泛素-蛋白酶体途径广泛存在于细胞核和胞质内,主要降解异 常蛋白质和短寿命蛋白质。整个降解过程在碱性(H7.8)条件下进行。此途径需要泛素、蛋白酶体和 ATP的参与. 泛素(ubiquitin,Ub)是种由76个氨基酸残基组成的小分子蛋白质.分子量为8.5kDa.因其广 存在于真核细胞而得名。泛素介导的蛋白质降解过程是一个复杂的过程。首先泛素与被选择降解的 蛋白形成共价连接,使其带上泛素标记并被激活,然后蛋白酶体(proteasome)特异性识别泛素标记的蛋 白质并将其降解,泛素的这种标记作用称为泛素化。粑蛋白的泛素化包括三种酶参与的3步反应,并消 耗ATP(图7-4)。一种蛋白质的降解需进行 多次泛煮化反应.形成聚多素裤。泛素错 w-&-+s- ATP AMP+PPI 如同贴在靶蛋白上的“死亡”标签。标签有长 有短,酵母细胞中一般是4聚泛素链,哺乳动 物中一般为6或7聚泛素链。其后,聚泛素化 HS Ea HS-E Ub- -5-E 蛋白质在蛋白酶体降解,产生一些7~9个氨 基酸残基组成的寡肽,寡肽进一步水解生成 氨基酸。 -S-Ea Ea 蛋白酶体是1个26S的蛋白质复合物,由 围74蛋白质降解的泛素化反应 1个20S的核心颗粒和2个19S的调节颗粒 Ub:泛素:E,:泛素激活酶:E:泛素结合酶:E:泛素蛋白连 组成。核心颗粒是由4个环(2个a环和2个 接酶 B环)组成的圆柱体,中心是空腔。2个α环 分别位于圆柱体的上下两端,2个B环则夹在2个a环之间。每个a环由7个α亚基组成,每个B环由 7个B亚基组成。核心顺粒是蛋白酶体的水解核心,活性位点位于2个B环上,B环7个亚基中有3个 亚基具有蛋白酶活性,可催化不同蛋白质降解。2个19S的调节颗粒分别位于柱形核心颗粒的两端,形 成空心圆柱的帽盖。每个调节颗粒由18个亚基组成,其中某些亚基识别、结合待降解的聚泛素化蛋白 质,有6个亚基具有ATP酶活性,与蛋白质的去折叠、解聚合有关。 三、营养非必需氨基酸的体内合成 人体可以通过不同代谢途径合成营养非必需氨基酸,其碳骨架主要来自糖酵解和三羧酸循环的中 间代谢产物,少数由营养必需氨基酸生成。合成流程短。 (一)谷氨酸的合成 -铜戊二酸是三酸酸循环的中间产物,也是合成谷氨酸的重要原料。在L-谷氨酸脱氢酶催化下,α 酮戊二酸氨化并还原生成谷氨酸。此反应不仅催化谷氨酸的合成,还构成了许多其他氨基酸合成途径 中关键性的一步。 (二)丙氨酸和天冬氨酸的合成 丙酮酸通过转氨基作用生成丙氨酸,草酰乙酸通过转氨基作用生成天冬氨酸 二者均可从谷氨酸获 188
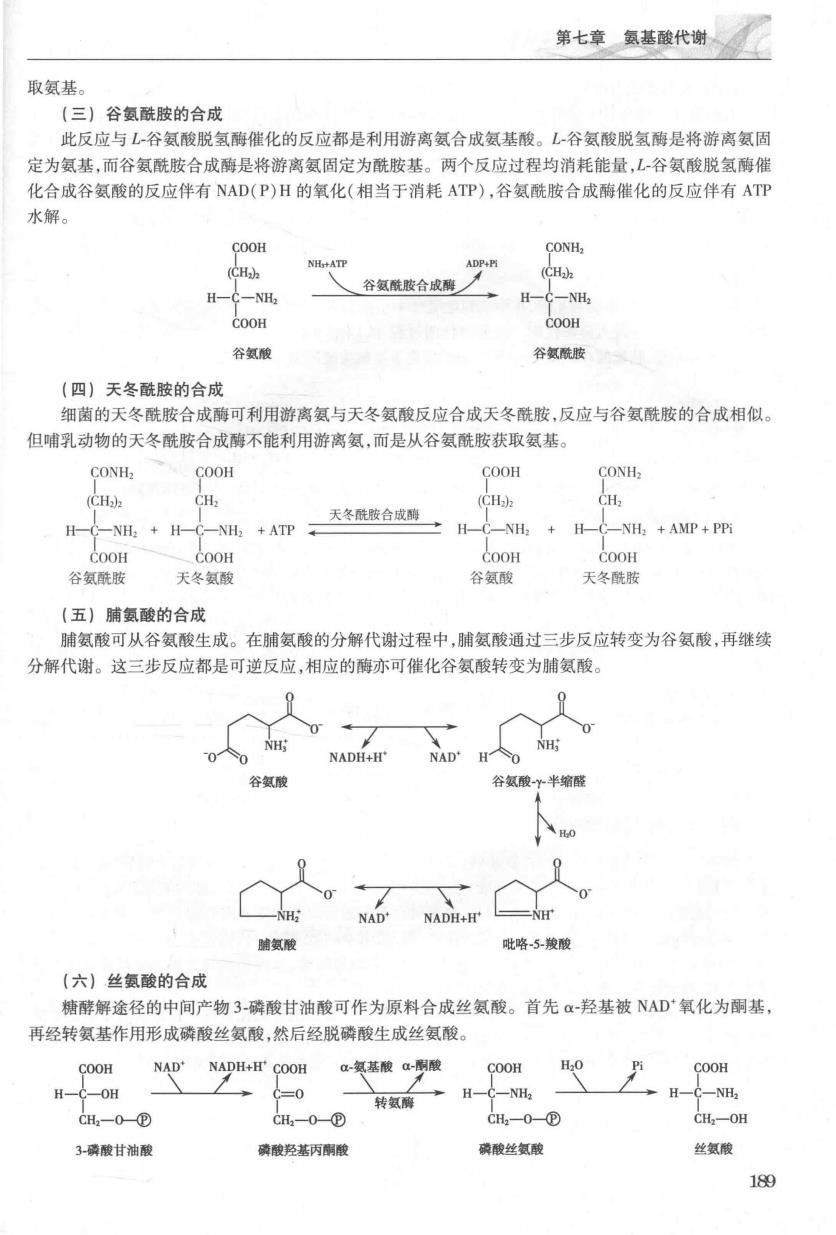
第七章氨基酸代谢 取氨基 (三)谷氨酰胺的合成 此反应与L谷氨酸脱氢酶催化的反应都是利用游离氨合成氨基酸。L谷氨酸脱氢酶是将游离氨固 定为氨基,而谷氨酰胺合成薄是将游离氨固定为酰胺基。两个反应过程均消耗能量,L-谷氨酸脱氢酶性 化合成谷氨酸的反应伴有NAD(P)H的氧化(相当于消耗ATP),谷氨酰胺合成酶催化的反应伴有ATP 水解。 COOH CONH (CH) (CH H-C-NH H-C-NH COOH COOH 谷氨酸 谷氨酰胺 (四】天冬酷胺的合成 细菌的天冬酰胺合成酶可利用游离氨与天冬氨酸反应合成天冬酰胺,反应与谷氨酰胺的合成相似。 但哺乳动物的天冬酰胺合成酶不能利用游离氨,而是从谷氨酰胺获取氨基。 CONH COOH COOH CONH (CH) CH (CH) 天冬酰胺合成酶 H-NH+H-C-NH+ATP H-C-NH +H-C-NH+AMP+P COoH 00 COOH Coon 谷氨酰胺 天冬氨酸 谷氨酸 天冬酰 (五)脯氨酸的合成 脯氨酸可从谷氨酸生成。在脯氨酸的分解代谢过程中,脯氨酸通过三步反应转变为谷氨酸,再继续 分解代谢。这三步反应都是可逆反应,相应的酶亦可催化谷氨酸转变为脯氨酸 NH:0 NADH+H' NH: 半缩 氨酸 毗略5骏酸 (六)丝氨酸的合成 糖酵解途径的中间产物3磷酸甘油酸可作为原料合成丝氨酸。首先α羟基被NAD氧化为酮基 再经转氨基作用形成磷酸丝氨酸,然后经脱磷酸生成丝氨酸。 COOH NADNADH+H'COOH-氨基酸a酸 COOH C-OH 转氨→H一一NH, C-NH CH2一0@ CH一0① CH0② CH,-OH 3-磷酸甘油酸 磷酸羟基丙酮酸 膜酸丝氨酸 丝氨酸 189

第二篇物质代谢及其调节 (七)甘氨酸的合成 肝细胞胞质中有甘氨酸转氨酶,能催化氨基从谷氨酸转移到乙醛酸从而合成甘氨酸。此外,还 有两条甘氨酸合成途径:一条是由胆碱合成甘氨酸,另一条是由丝氨酸在羟甲基转移酶催化下合成 甘氨酸。 NH, H0-CH一H-C0OHH,是甲基转移猜一NN-0H一FH+H,N一CH一0OOH 丝氨酸 N3N0甲烯四氢叶酸 甘氨酸 (八)半胱氨酸的合成 甲硫氨酸是营养必需氨基酸,在甲硫氨酸循环中生成同型半胱氨酸。同型半胱氨酸可重新甲基化 生成甲硫氨酸,也可进人分解代谢。在分解代谢过程中,同型半胱氨酸与丝氨酸经胱硫醚B合酶的催 化缩合成胱硫醚,胱硫醚在胱硫醚Y裂解酶的催化下水解生成同型丝氨酸和半胱氨酸。 00H COOH COOH COOH NH:-:H COOH COOH H-NH2 H-(-NH2 (CH22 (CHa)2 CHz-OH CHa-S-(CHa) CHz-SH 丝氨酸 同型半胱氨 胱硫脒 半酰氨酸 同型丝氨酸 (九)酪氨酸的合成 苯丙氨酸在苯丙氨酸羟化酶的催化下可生成酪氨酸。此反应不可逆。苯丙氨酸羟化酶主要存在于 肝组织,是一种加单氧酶,辅酶是四氢生物蝶呤。苯丙氨酸是营养必需氨基酸。食物中有足量苯丙氨酸 时,不需提供酪氨酸。食物中酪氨酸含量充足时,可以减少苯丙氨酸向酪氨酸的转变。 COOH COOH H C-NH> 苯丙氨酸羟化→ H-C-NH: +0 苯丙氨酸 NADP NADPH+H' 酪氨酸 四、氨基酸代谢库 食物蛋白质经消化而被吸收的氨基酸(外源性氨基酸)与体内组织蛋白质降解产生的氨基酸以及 体内合成的非必需氨基酸(内源性氨基酸)混合在一起,分布于体内各处,参与体内氨基酸的代谢,称为 氨基酸代谢库(amino acid metabolic pool)。怎基酸代谢库通常以游离氨基酸总量计算.由于氨基酸不 能自由通过细胞膜,所以在体内的分布是不均一的,肌肉中的氨基酸占代谢库的50%以上,肝中约占 10%,肾中占4%,血浆中占1%~6%。消化吸收的大多数氨基酸,如丙氨酸和芳香族氨基酸等主要在 肝中分解,而支链氨基酸主要在骨骼肌中分解。 体内氨基酸的主要功能是合成蛋白质和多肽,也可转变成其他含氮化合物。正常人尿中排出的氨 基酸极少,每日约1g左右。由于各种氨基酸具有共同的结构特点,因而代谢途径有共同之处。但不同 氨基酸由于结构的差异,代谢方式也有各自不同之处。体内氨基酸代谢的概况见图7-5。 190

第七卓氨基酸代湖 非必需氨基 食物蛋白质消化吸收 →a-啊酸 脱氨基作用 组织蛋白质分解 →NH,→尿素 合成 脱骏作用类+60, 体会 代谢转变、其他含氯化合物(眼吟、密啶等】 图75氨基酸代谢概况 第三节氨基酸的一般代谢 氨基酸具有共同的结构特点,因而它们的代谢途径有共同之处。氨基和α酮酸是氨基酸最具代表 性的共性结构,本节主要讨论氨基酸的脱氨基作用、体内氨的代谢以及氨基酸骨架α酮酸的代谢。 一、氨基酸的脱氨基作用 氨基酸脱去氨基生成氨及相应的α-酮酸的过程,称为氨基酸脱氨基作用。这是氨基酸的主要分钢 代谢途径。氨基酸的脱氨基作用在体内大多数组织中均可进行。氨基酸可以通过多种方式脱去氨基, 例如转氨基、氧化脱氨基和联合脱氨基等,其中以联合脱氨基最为重要。 (一)转氨基作用 1.转复基作用与转氨酶转复基作用(transamination)是指在转氨酶(transaminase)催化下,a-氨其 酸的氨基转移到α酮酸的酮基碳原子上,结果是原来的氨基酸脱去氨基生成了相应的α-酮酸,而原来 的α-酮酸则转变成相应的氨基酸。 R R2 H-C-NHz COOH COOH COOH 这是一种体内普遍存在的脱氨基方式,但在转氨基作用中没有游离氨的生成。转氨基作用的平衡 常数接近于1,反应可逆。因此,转氨基作用既是氨基酸的分解代谢过程,也是体内某些氨基酸(营养非 必需氨基酸)合成的重要途径。除赖氨酸、苏氨酸、脯氨酸及羟脯氨酸外,体内大多数氨基酸都可以参 与转氨基作用。除了α-氨基外,氨基酸侧链末端的氨基,如鸟氨酸的8氨基也可通过转氨基作用而 脱去 转氨酶也称为氨基转移酶(aminotransferase),广泛分布于体内各组织中,具有底物专一性,不同氨 基酸与α酮酸之间的转氨基作用只能由专一的转氨酶催化。体内存在着多种转氨酶,其中以L谷氨酸 和a-酮酸的转氨酶最为重要,例如,谷丙转氨酶(glutamic pyruvic transaminase,GPT)又称丙氨酸转氨酶 (alanine transaminase,ALT)和谷草转氨酶(glutamic oxaloacetic transaminase,C0T)又称天冬氨酸转氨酶 (aspartate transaminase,AST),在氨基酸代谢中最为活跃,它们在体内广泛存在,但在各组织中含量不同 (表7-2)。 191