
在血液或体液内除!:分子外,还发现另一族参予免疫效应的大分子,称为补体分子,早在19世纪末,发现在新鲜免疫血清内加入相应细 菌无论讲行体内或体外实验均证明可以格细溶解格这种现之为免疫溶菌象如加格免疫血洁加热60C30分钟则可丧失溶菌能 进一步证明免疫血清中含有二种物质与溶菌现家有关,即对热稳定的组分称为杀菌素,即抗体(com plement,C),其后又证实了抗各 细胞的抗体加入补体成分亦可引起红细胞的溶解现象,自此建立了早期的补体念,即补体为正常血清中的单一组分,它可被抗原与抗体形成 的复合物所活化,产生溶菌和溶细跑现象。而单独的杭体或补体均不能引起细狗溶解现象」 第一节补体系统的组成和理化性质 一、补体分子的组分和命名 进入60年代后,由于蛋白质化学和免疫化学技术的进步,自血液中分离、纯化补体成分成功,现已证明补体是单一成分的论点是不正确 它是由三组球白大分子组成即第一组分是由9种补体成分组成,分别命名为C1、C2、C3,C4、C5、C6、C7、C8、C9,其中C1是由 C5,因此第一组分是由11种球蛋白大分子组成。在70年代又发现一些新的血清因子参予补体活化,但它 不是经过抗原抗体复合物的活化途径。而是通过旁路活化途径。这此些因子包活B因子、D因P因子,它们构成补体的第二组分。其后又发现多 种参矛控制补体活化的抑制因子或灭活因子,如I抑制物、1因子、H因子。C4结合蛋白。过敏毒素灭活因子等。这些因子可控制补体分子的活 化,对维持补体在体内的平衡起调节作用,它们构成了补体的第三组分。 由于补体活化另一途径的深入研究,对补体系统的生物学意义有了新的识别,从而打破了对补体的传统观点,建立了新的概念。即补体系 统是由将近20多种血清蛋白组成的多分子系统,具有酶的活性和自我调节作用。它至少有二种不同的活化途径,其生物学意义不仅是抗体分子 的辅助或增强因子,也具有独立的生物学作用,对机体的防御功能、免疫系统功能的调节以及免疫病理过程都发挥重要作用。 1968年世界卫生组织(WH0)的补体命名委员会对补体进行了统一命名。分别以C1C9命名.1981年对新发现的一些成分和因子也进行 了统一命名,每一补体的肽锁结构用希醋字母表示如C3和B城等.每一分子的南解断片可用小写英文字母表示如C3和C3b等蒂解断片,具有 葡活性分子可在其上画横线表示之,如C1为无确活性分子,而C1为有南活性分子。对具有瑞活性的复合物则应用其断片表示,如C3转化确可 用C4b,2a表示 表31WH0对部分补体成分的命名(1981) C3 活剂前体转化,GBGase苦 补体分子是分别由肝细胞、巨噬细胞以及肠粘膜上皮细胞等多种细胞产生的,其理化性质及其在血清中的含量差异甚大。全部补体分子的 化学组成均为多糖蛋白,各补体成分的分子量变动范围很大,其中C4结合蛋白的分子量最大,为55万,D因子分子量最小仅为2.3万。大多数补 体成分的电泳迁移率属β球蛋白,少数属球蛋白及Y球蛋白。血清中补体蛋白约占总球蛋白的10%,其中含量最高的为C3,约含1mg/ml,而D 因子仅含1gm,二者相差约干倍。人类某些疾病其总补含量或单一成分含量可发生变化,因而对体液中补体水平的测定,或组织内补体定位 观察,对一些疾病的诊断具有一定意义。 二、补体的理化性质 -390KD之间.在 体旋中备感分的性状质括列于电表现。补体减分大色是球重身少数色风分子在” 的为 其次为C 其中C7的产4 的理化性状 解片 s1 5150 CXA因子 1300 Ba,Bh 8
在血液或体液内除Ig分子外,还发现另一族参予免疫效应的大分子,称为补体分子。早在19世纪末,发现在新鲜免疫血清内加入相应细 菌,无论进行体内或体外实验,均证明可以将细菌溶解,将这种现象称之为免疫溶菌现象。如将免疫血清加热60°C30分钟则可丧失溶菌能力。 进一步证明免疫血清中含有二种物质与溶菌现象有关,即对热稳定的组分称为杀菌素,即抗体(complement,C)。其后又证实了抗各种动物红 细胞的抗体加入补体成分亦可引起红细胞的溶解现象。自此建立了早期的补体概念。即补体为正常血清中的单一组分,它可被抗原与抗体形成 的复合物所活化,产生溶菌和溶细胞现象。而单独的抗体或补体均不能引起细胞溶解现象。 第一节 补体系统的组成和理化性质 一、补体分子的组分和命名 进入60年代后,由于蛋白质化学和免疫化学技术的进步,自血液中分离、纯化补体成分成功,现已证明补体是单一成分的论点是不正确 的,它是由三组球蛋白大分子组成。即第一组分是由9种补体成分组成,分别命名为C1、C2、C3、C4、C5、C6、C7、C8、C9。其中C1是由 三个亚单位组成,命名为Clq、Clr、Cls,因此第一组分是由11种球蛋白大分子组成。在70年代又发现一些新的血清因子参予补体活化,但它们 不是经过抗原抗体复合物的活化途径。而是通过旁路活化途径。这此些因子包括B因子、D因P因子,它们构成补体的第二组分。其后又发现多 种参矛控制补体活化的抑制因子或灭活因子,如CI抑制物、I因子、H因子、C4结合蛋白、过敏毒素灭活因子等。这些因子可控制补体分子的活 化,对维持补体在体内的平衡起调节作用,它们构成了补体的第三组分。 由于补体活化另一途径的深入研究,对补体系统的生物学意义有了新的识别,从而打破了对补体的传统观点,建立了新的概念。即补体系 统是由将近20多种血清蛋白组成的多分子系统,具有酶的活性和自我调节作用。它至少有二种不同的活化途径,其生物学意义不仅是抗体分子 的辅助或增强因子,也具有独立的生物学作用,对机体的防御功能、免疫系统功能的调节以及免疫病理过程都发挥重要作用。 1968年世界卫生组织(WHO)的补体命名委员会对补体进行了统一命名。分别以C1……C9命名,1981年对新发现的一些成分和因子也进行 了统一命名。每一补体的肽链结构用希腊字母表示,如C3a和β链等。每一分子的酶解断片可用小写英文字母表示如C3a和C3b等酶解断片,具有 酶活性分子可在其上画横线表示之,如C1为无酶活性分子,而C1为有酶活性分子。对具有酶活性的复合物则应用其断片表示,如C3转化酶可 用C4b,2a表示。 表3-1 WHO对部分补体成分的命名(1981) 统一名称 曾用名称 B因子 C3激活剂前体,热稳定因子等 D因子 C3激活剂前体转化酶,GBGase等 P因子 备解素 H因子 C3bINA促进因子 I因子 C3b灭活因子,KAF等 补体分子是分别由肝细胞、巨噬细胞以及肠粘膜上皮细胞等多种细胞产生的。其理化性质及其在血清中的含量差异甚大。全部补体分子的 化学组成均为多糖蛋白,各补体成分的分子量变动范围很大,其中C4结合蛋白的分子量最大,为55万,D因子分子量最小仅为2.3万。大多数补 体成分的电泳迁移率属β球蛋白,少数属a球蛋白及γ球蛋白。血清中补体蛋白约占总球蛋白的10%,其中含量最高的为C3,约含1mg/ml,而D 因子仅含1μg/ml,二者相差约千倍。人类某些疾病其总补含量或单一成分含量可发生变化,因而对体液中补体水平的测定,或组织内补体定位 观察,对一些疾病的诊断具有一定意义。 二、补体的理化性质 补体系统中各成分的理化性状概括列于表3-2。由表见,补体成分大多是β球蛋白,少数几种属a或γ球蛋白,分子量在25~390KD之间。在 血清中的含量以C3为最高,达1300μg/ml,其次为C4、S蛋白和H因子,各约为C3含量的1/3;其他成分的含量仅为C3的1/10或更低。 补体成分的产生部位如表3-3所示,其中C7的产生部位尚不清楚。 表3-2 补体系统各成分的理化性状 补体成分 分子量(KD) 电泳区带 肽链数目 血清含量 裂解片段 Clq 390 γ2 18 70 Clr 95 β 1 35 Cls 85 α 1 35 C2 117 β1 1 30 C2a,C2b C3(A因子) 190 β1 2 1300 C3a,C3b C3c,C3d C4 180 β2 3 430 C4a,C4b C4c,C4d C5 190 β1 2 75 C5a,C5b C6 128 β2 1 60 C7 120 β2 1 55 C8 163 γ1 3 55 C9 79 α 1 200 B因子(C3PA) 95 β 1 240 Ba,Bb D因子(C3PA酶原) 25 α 1 2 P因子(备解素) 220 γ2 4 25 C1INH 105 α 1 180 C4bp 1100 6~8 250 I因子(C3bINA) 93 β 2 50 H因子(β1H) 150 β 1 400 S蛋白 80 α 1 500

表33补体系统各成分产生部位 血小板 第二节补体系统的激活 补休系统各成分通常多以非活性状态存在于血浆之中,当其被激活物质活化之后,才表现出各种生物学活性。补体系统的激活可以从开 始也可以越过C 种涂径称为经典途径(classic 早年从抗原体复合物激活补体的过程来研究补体激活的机制时,发现补体系统是从℃1开始激活的连锁反应。从种系发生角皮而言,旁路途径是 更为古者的百 的活涂径。从同一个体而言在尚形成得 生免疫,即未产生抗体之前,经旁路途径激 补体,即可直接作用于入侵的 微生物等异物, 作为非结 异性免疫 发挥效应。由于对旁路途径的认识】 远远晚在经 加上人们先入为主 造成了 命名的不 一、经典激活途径 参与补体经典激活途径的成分包括C1一C9,按其在激活过程中的作用,人为地分成三组,即识别单位(C4、C、C15)、活化单位 (C4、C2、C3)和暖攻击单位(C5~C9),分别在激活的不同阶段即识别阶段、活化阶段和膜功击阶段中发挥作用. (一)识别阶段 图31C1q示章图 C1与抗原抗体复合物中免疫球蛋的补体结合点相结合至C1酯离形成的阶段, C1是由三个单位Clg、C1r和C1s依赖Ca+结合成的牢固的非活性大分子, Cg:C1q分子有6个能与免疫球蛋白分子上的补体结合点相结合的部位。当两个以上的结合部位与免疫球蛋白分子结合时,即C1g桥联免疫 球蛋白之后,才能激活后续的补体各成分(图3)gG为单体,只有当其与抗原结合时,才能使两个以上的gG分子相互靠找,提供两个以上 相邻的补体结合点不能与C19接触,只有当1gM与抗原结合,发生构型改变,暴露出补体结合部位之后,才能与C1q结合。一个分子的1gM激活 补体的能力大于gG。C1q与补体结合点桥联后,其构型发生改变,导致C和C1s的相继活化。 CrCr在C1大分子中起着连接CIq和CIs的作用。Clq启动后可引起Cr构型的改变,在活性的Cr,后者可使Cls活化. C1s:CIr使CIs的肽链裂解,其中一个片段C1s具有酯南活化,即CI的活性。此确活性可被C1H灭活。 在经典途径中,一旦形成Cs,即完成识别阶段,并进入活化阶段。 (二)活化阶段 C1作用于后续的补体成分,至形成C3转化酶(C42)和C5转化藤(C423)的阶段. C4:C4是C1的底物。在Mg2+存在下,C使C4裂解为C4a和C4b两个片段,并使被结合的C4b迅速失去结合能力.C1与C4反应之后能更好 地显露出C1作用于C2的萌活性部位
表3-3 补体系统各成分产生部位 补体成分 产生部位 C1 小肠上皮细胞、脾、巨噬细胞 C2 巨噬细胞 C3 巨噬细胞、肝 C4 巨噬细胞、肝 C5 巨噬细胞 C6 肝 C7 ? C8 肝 C9 肝 B因子 巨噬细胞、肝 D因子 巨噬细胞、血小板 P因子 巨噬细胞 I因子 巨噬细胞 H因子 巨噬细胞、血小板 第二节 补体系统的激活 补体系统各成分通常多以非活性状态存在于血浆之中,当其被激活物质活化之后,才表现出各种生物学活性。补体系统的激活可以从C1开 始;也可以越过C1、C2、C4,从C3开始。前一种激活途径称为经典途径(classical pathway)或替代途径。“经典”,“传统”只是意味着,人们 早年从抗原体复合物激活补体的过程来研究补体激活的机制时,发现补体系统是从C1开始激活的连锁反应。从种系发生角度而言,旁路途径是 更为古老的、原始的激活途径。从同一个体而言,在尚未形成获得性免疫,即未产生抗体之前,经旁路途径激活补体,即可直接作用于入侵的 微生物等异物,作为非特异性免疫而发挥效应。由于对旁路途径的认识,远远晚在经典之后,加上人们先入为主观念,造成了命名的不合理。 一、经典激活途径 参与补体经典激活途径的成分包括C1~C9。按其在激活过程中的作用,人为地分成三组,即识别单位(Clq、Clr、Cls)、活化单位 (C4、C2、C3)和膜攻击单位(C5~C9),分别在激活的不同阶段即识别阶段、活化阶段和膜功击阶段中发挥作用。 (一)识别阶段 图3-1 CIq示意图 C1与抗原抗体复合物中免疫球蛋的补体结合点相结合至C1酯酶形成的阶段。 C1是由三个单位Clq、Clr和Cls依赖Ca+结合成的牢固的非活性大分子。 Clq:Clq分子有6个能与免疫球蛋白分子上的补体结合点相结合的部位。当两个以上的结合部位与免疫球蛋白分子结合时,即Clq桥联免疫 球蛋白之后,才能激活后续的补体各成分(图3-1)IgG为单体,只有当其与抗原结合时,才能使两个以上的IgG分子相互靠拢,提供两个以上 相邻的补体结合点不能与Clq接触,只有当IgM与抗原结合,发生构型改变,暴露出补体结合部位之后,才能与Clq结合。一个分子的IgM激活 补体的能力大于IgG。Clq与补体结合点桥联后,其构型发生改变,导致Clr和Cls的相继活化。 Clr:Clr在C1大分子中起着连接Clq和Cls的作用。Clq启动后可引起Clr构型的改变,在活性的Clr,后者可使Cls活化。 Cls:Clr使Cls的肽链裂解,其中一个片段Cls具有酯酶活化,即CI的活性。此酶活性可被C1INH灭活。 在经典途径中,一旦形成Cls,即完成识别阶段,并进入活化阶段。 (二)活化阶段 CI作用于后续的补体成分,至形成C3转化酶(C42)和C5转化酶(C423)的阶段。 C4:C4是CI的底物。在Mg2+存在下,CI使C4裂解为C4a和C4b两个片段,并使被结合的C4b迅速失去结合能力。CI与C4反应之后能更好 地显露出CI作用于C2的酶活性部位

C2:C2虽然也是CI的底物,但C1先在C4作用之后明显增强了与C2的相互作用.。C2在Me2+存在下被C1裂解为两个片段C2和C2b,当C4b 与C2a结合成C4b2b(简写成C42)即为经典途径的C3转化确. C3:C3被C3转化酶裂解在C3a和C3b两个片段,分子内郎的疏酯基(←S.C0-)外露,成为不稳定的结合部位。硫酯基经加水分解,成为 SH和.COOH也可与细萄或细跑表面的NH2和-0H反应而共价结合。因此,C3h通过不稳定的结合都位,结合到抗原抗体复合物上或结合到C4 激活C3所在部位附近的微生物、高分子物质及细跑膜上,这点,对于介导调理作用和免陵粘附作用具有重要意义,C3b的另一端是个稳定的结 合部位。C3b通过此部位与具有C3b受体的细胞相结合(图3-2)。C3b可被1因子灭活。C3a留在液相中,具有过敏毒素活性,可被羟肽磷B灭 活。 醇 来R→ 社化降作丽吾位 了经隆装香 【州子作测第仪 32C3分子及其裂解产物生物活性示意 生的C423(C4b2b3b)为经典途径的C5转化酶.至此完成活化阶段 (但)膜攻击阶假 C5转化裂程 定,当其与C6结合成C56复合物则较为稳定,但此C5b6并无活性。C5b6与C7结合成三分子的复合物C5b67时,校 定,不易从细胞膜上解 可吸附于 致敏的细胞膜上 吸附在邻近的 未经致敏的细胞膜上(即未结合有抗体的细胞膜上),C5b67是使细膜受 伤的 个关键组分 即插入的磷脂双层结构中 67未与话当的细胞膜结合,则其中的C5b仍可衰变 ,失去与细抱膜结合和裂解细 的活性 7面高国,自分子排方时C形C6真中C8是结合部他国此健接形成C5~9,即外体的攻击单位 可使细胞膜穿孔受 目前已经证明,不C5b,C6C7结合到细 膜下是细膜仍完整无损:只有在吸附C8之后才出现轻微的损伤,细跑内容物开始渗漏。在结 合C以后才加速细胞膜的损伤过程,因而认为C9是C8的促进因子,(图33), (调E喜表以】 (注用年境〉 G14女 C-Cah C 面单 图3经典途径的激活 二、旁路激活途轻 旁路激活途径与经典激活途径不同之处在于激活是越过了C1、C4、C2三种成分 ,直接激活C3维而完成C5至C9各成分的连锁反应,还在于 激活物质并非抗原抗体复合物而是细菌的细孢壁成分一 脂多,以及多糖、肽聚糖、磷壁酸和凝聚的gA和gG4等物质。旁路微活途径在细
C2:C2虽然也是CI的底物,但CI先在C4作用之后明显增强了与C2的相互作用。C2在Mg2+存在下被CI裂解为两个片段C2a和C2b。当C4b 与C2a结合成C4b2b(简写成C42)即为经典途径的C3转化酶。 C3:C3被C3转化酶裂解在C3a和C3b两个片段,分子内部的疏酯基(-S-CO-)外露,成为不稳定的结合部位。硫酯基经加水分解,成为- SH和-COOH也可与细菌或细胞表面的-NH2和-OH反应而共价结合。因此,C3b通过不稳定的结合部位,结合到抗原抗体复合物上或结合到C42 激活C3所在部位附近的微生物、高分子物质及细胞膜上。这点,对于介导调理作用和免疫粘附作用具有重要意义。C3b的另一端是个稳定的结 合部位。C3b通过此部位与具有C3b受体的细胞相结合(图3-2)。C3b可被I因子灭活。C3a留在液相中,具有过敏毒素活性,可被羟肽酶B灭 活。 图3-2 C3分子及其裂解产物生物活性示意图 C3b与C42相结合产生的C423(C4b2b3b)为经典途径的C5转化酶。至此完成活化阶段。 (三)膜攻击阶段 C5转化酶裂解C5后,继而作用于后续的其他补体成分,最终导致细胞受损、细胞裂解的阶段。 C5:C5转化酶裂解C5产生出C5a和C5b两个片段。C5a游离于液相中,具有过敏毒素活性和趋化活性。C5b可吸附于邻近的细胞表面,但其 活性极不稳定,易于衰变成C5bi。 C6~C9:C5b虽不稳定,当其与C6结合成C56复合物则较为稳定,但此C5b6并无活性。C5b6与C7结合成三分子的复合物C5b67时,较稳 定,不易从细胞膜上解离。 C5b67即可吸附于已致敏的细胞膜上,也可吸附在邻近的,未经致敏的细胞膜上(即未结合有抗体的细胞膜上)。C5b67是使细胞膜受损 伤的一个关键组分。它与细胞膜结合后,即插入膜的磷脂双层结构中。 若C5b67未与适当的细胞膜结合,则其中的C5b仍可衰变,失去与细胞膜结合和裂解细胞的活性。 C5b67虽无酶活性,但其分子排列方式有利于吸附C8形成C5678。其中C8是C9的结合部位,因此继续形成C5~9,即补体的膜攻击单位, 可使细胞膜穿孔受损。 目前已经证明,不C5b、C6、C7结合到细胞膜下是细胞膜仍完整无损;只有在吸附C8之后才出现轻微的损伤,细胞内容物开始渗漏。在结 合C9以后才加速细胞膜的损伤过程,因而认为C9是C8的促进因子。(图3-3)。 图3-3 经典途径的激活 二、旁路激活途径 旁路激活途径与经典激活途径不同之处在于激活是越过了C1、C4、C2三种成分,直接激活C3继而完成C5至C9各成分的连锁反应,还在于 激活物质并非抗原抗体复合物而是细菌的细胞壁成分—脂多糖,以及多糖、肽聚糖、磷壁酸和凝聚的IgA和IgG4等物质。旁路激活途径在细菌

性感染早期,尚未产生特异性抗体时,即可发挥重要的抗感染作用。 (一)生理情况下的准备阶段 在正常生理情况下,C3与B因子、D因子等相互作用,可产生极少量的C3B和C3bBb(旁路途径的C3转化酶),但迅速受H因子和I因子的 作用,不再能激活C3和后续的补体成分(图34,左)。只有当H因子和因子的作用被阻挡之际,旁路途径方得以激活(图34,右)· C3:血家中的C3可自然地.缓慢地裂解,持续产生少量的C3b,释入液相中的C3b迅速被1因子灭活。 B因子:液相中缓馒产生的C3b在Mg2+存在下,可与B因子结合形成C3Bb, D因子:体液中同时存在着无活性的D因子和有活性的D因子(B因子转化离),D因子作用于C3bB,可使此复合物中的B因子裂解,形成 C3bBb和Ba游离于液相中。C3bBb可使C3裂解为C3a和C3b,但烊际上此酶效率不高亦不稳定,H因子可置换C3bBb复合物中的Bb,使C3b与Bb 解离,解离或游离的C3弘立即被因子灭活。因此,在无激活物质存在的生理情况下,C3bBb保持在极低的水平,不能大量裂解3,也不能激活 后续补体成分。但是这种C3的低速度裂解和低浓度C3bBb的形成,只有重大意义。可比喻为处于“箭在弦上,一触即发"的状态, (二)旁路途径的邀活 旁路途径的激活在于激活物质(例如细菌脂多糖、肽聚糖:病素感染细胞、肿瘤细胞,痢疾阿米巴原虫等)的出现。目前认为,激活物质的 存在为C3b或C3bBb提供不易受H因子置换Bb,不受1因子灭活C3b的一种保护性微环境,使旁路激活途径从和缓进行的准备阶段过渡到正式激 活的阶段(国34)。 C 3 C35 可产生出少量C3bBb,但迅即被激活 右:在激活物存在下,C3h不易被因子灭活, 3bBh中的B6不易被H因子雪换,使激活过程得以进行 P因子旧称爸 群条properdin 正常血浆中也有可以互相转换的两种P因子,P和P,C3bBb的半袁期甚短,当其与P因子结合成 为C3bBbP时 半明可延 这样可试得 定的、活性史强的C3转化的 C3bBb3b:C3blBh与其裂解C3所产生的C3b可进一步形成多分子复合物C3bBb3b.C36Bb3b像经典途径中的C5转化璃C423一样,也可使C 裂解成C5和C5b。后续的C6~C9各成分与其相互作用的情况与经典途经相同, (但)激活效应的扩大 C3在两条激活途径中都占据着重要的地位。C4是血清中含量最多的补体成分,这也正是适应其作用之所需。不论在经途径还是在旁路 径,当C3被激活物质激活时,其裂解产物C3b又可在B因子和D因子的参与作用下合成新的C3bBb,后者又进一步使C3裂解.由于血浆中有丰 富的C3,又有足够的B因子和Mg2+,因此这一过程一旦被触发。就可能激活的产生显著的扩大效应。有人称此为依赖C3Bb的正反馈途径,或 称C3b的正反馈途径(图3.5)
性感染早期,尚未产生特异性抗体时,即可发挥重要的抗感染作用。 (一)生理情况下的准备阶段 在正常生理情况下,C3与B因子、D因子等相互作用,可产生极少量的C3B和C3bBb(旁路途径的C3转化酶),但迅速受H因子和I因子的 作用,不再能激活C3和后续的补体成分(图3-4,左)。只有当H因子和I因子的作用被阻挡之际,旁路途径方得以激活(图3-4,右)。 C3:血浆中的C3可自然地、缓慢地裂解,持续产生少量的C3b,释入液相中的C3b迅速被I因子灭活。 B因子:液相中缓慢产生的C3b在Mg2+存在下,可与B因子结合形成C3Bb。 D因子:体液中同时存在着无活性的D因子和有活性的D因子(B因子转化酶)。D因子作用于C3bB,可使此复合物中的B因子裂解,形成 C3bBb和Ba游离于液相中。C3bBb可使C3裂解为C3a和C3b,但烊际上此酶效率不高亦不稳定,H因子可置换C3bBb复合物中的Bb,使C3b与Bb 解离,解离或游离的C3b立即被I因子灭活。因此,在无激活物质存在的生理情况下,C3bBb保持在极低的水平,不能大量裂解C3,也不能激活 后续补体成分。但是这种C3的低速度裂解和低浓度C3bBb的形成,具有重大意义。可比喻为处于“箭在弦上,一触即发”的状态。 (二)旁路途径的激活 旁路途径的激活在于激活物质(例如细菌脂多糖、肽聚糖;病素感染细胞、肿瘤细胞,痢疾阿米巴原虫等)的出现。目前认为,激活物质的 存在为C3b或C3bBb提供不易受H因子置换Bb,不受Ⅰ因子灭活C3b的一种保护性微环境,使旁路激活途径从和缓进行的准备阶段过渡到正式激 活的阶段(图3-4)。 · 图3-4 旁路途径的激活 左:在正常后理情况下,可产生出少量C3bBb,但迅即被激活。 右:在激活物存在下,C3b不易被I因子灭活,C3bBb中的Bb不易被H因子置换,使激活过程得以进行。 P因子:P因子旧称备解素(properdin)。正常血浆中也有可以互相转换的两种P因子,P和P。C3bBb的半衰期甚短,当其与P因子结合成 为C3bBbP时,半衰期可延长。这样可以获得更为稳定的、活性更强的C3转化酶。 C3bBb3b:C3bBb与其裂解C3所产生的C3b可进一步形成多分子复合物C3bBb3b。C3bBb3b像经典途径中的C5转化酶C423一样,也可使C5 裂解成C5a和C5b。后续的C6~C9各成分与其相互作用的情况与经典途经相同。 (三)激活效应的扩大 C3在两条激活途径中都占据着重要的地位。C4是血清中含量最多的补体成分,这也正是适应其作用之所需。不论在经典途径还是在旁路途 径,当C3被激活物质激活时,其裂解产物C3b又可在B因子和D因子的参与作用下合成新的C3bBb。后者又进一步使C3裂解。由于血浆中有丰 富的C3,又有足够的B因子和Mg2+,因此这一过程一旦被触发。就可能激活的产生显著的扩大效应。有人称此为依赖C3Bb的正反馈途径,或 称C3b的正反馈途径(图3-5)
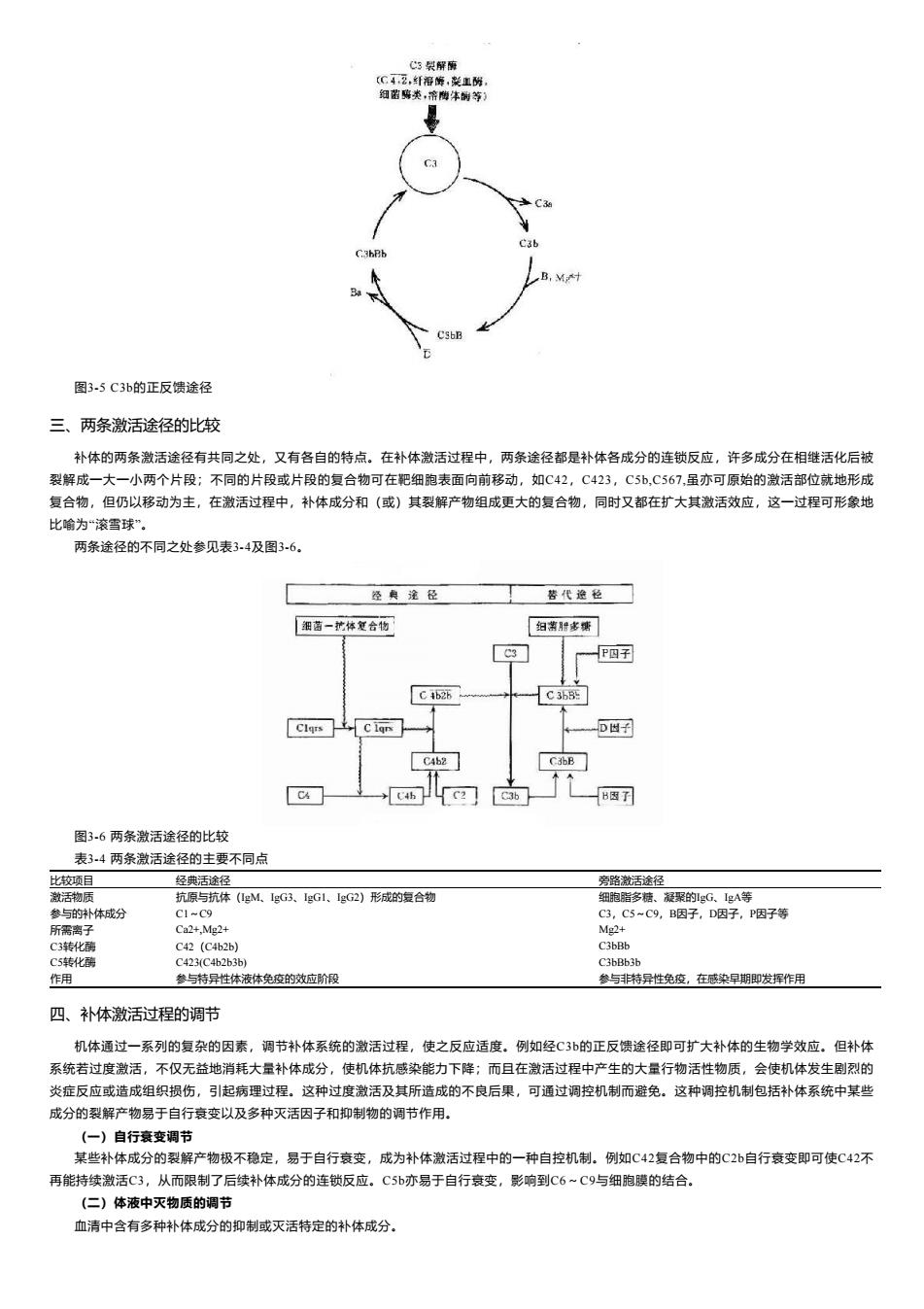
M 35C3b的正反馈途径 三、两条激活途径的此较 补体的两条激活途径有共同之处,又有各自的特点。在补体激活过程中,两条途径都是补体各成分的连锁反应,许多成分在相维活化后被 裂解成一大一小两个片段:不同的片段或片段的复合物可在肥细胞表面向前移动,如C42,C423,CSb,C567,虽亦可原始的激活部位就地形成 复合物,但仍以移动为主,在激活过程中,补体成分和(或)其裂解产物组成更大的复合物,同时又都在扩大其激活效应,这一过程可形象地 比喻为滚雪球”。 两条途径的不同之处参见表34及图36, 苦代丝☐ 国菌一艺体复合物 「妇常世常绣 c w 图3.6两多渤活涂径的出较 表34两条激活途径的主要不同点 比较项目 经典途 路激活 参与的 体分 抗体(M.G线.gG.g)形的宝合物 C港化 () 作用 参与持员性体液体免的效应阶段 参与特员性免废,在感染早即发挥作用 四、补体激活过程的调节 机体通过一系列的复杂的因素,调节补体系统的激活过程,使之反应适度。例如经C3b的正反馈途径即可扩大补体的生物学效应.但补体 系统若过度激活,不仅无益地消耗大量补体成分,使机体抗感染能力下降:而且在激活过程中产生的大量行物活性物质,会使机体发生刷烈的 炎症反应或造成组织损伤,引起病理过程。这种过度激活及其所造成的不良后果,可通过调控机制而避免。这种调控机制包括补体系统中某些 成分的裂解产物易于自行衰变以及多种灭活因子和抑制物的调节作用。 (一)自行衰变调节 某些补体成分的裂解产物极不稳定,易于自行衰变,成为补体激活过程中的一种自控机制.例如C42复合物中的C2b自行衰变即可使C42不 再能持续激活C3,从而限制了后续补体成分的连锁反应,C5b亦易于自行衰变,影响到C6~C9与细胞硬的结合, (二)体液中灭物质的调节 血清中含有多种补体成分的抑制或灭活特定的补体成分
图3-5 C3b的正反馈途径 三、两条激活途径的比较 补体的两条激活途径有共同之处,又有各自的特点。在补体激活过程中,两条途径都是补体各成分的连锁反应,许多成分在相继活化后被 裂解成一大一小两个片段;不同的片段或片段的复合物可在靶细胞表面向前移动,如C42,C423,C5b,C567,虽亦可原始的激活部位就地形成 复合物,但仍以移动为主,在激活过程中,补体成分和(或)其裂解产物组成更大的复合物,同时又都在扩大其激活效应,这一过程可形象地 比喻为“滚雪球”。 两条途径的不同之处参见表3-4及图3-6。 图3-6 两条激活途径的比较 表3-4 两条激活途径的主要不同点 比较项目 经典活途径 旁路激活途径 激活物质 抗原与抗体(IgM、IgG3、IgG1、IgG2)形成的复合物 细胞脂多糖、凝聚的IgG、IgA等 参与的补体成分 C1~C9 C3,C5~C9,B因子,D因子,P因子等 所需离子 Ca2+,Mg2+ Mg2+ C3转化酶 C42(C4b2b) C3bBb C5转化酶 C423(C4b2b3b) C3bBb3b 作用 参与特异性体液体免疫的效应阶段 参与非特异性免疫,在感染早期即发挥作用 四、补体激活过程的调节 机体通过一系列的复杂的因素,调节补体系统的激活过程,使之反应适度。例如经C3b的正反馈途径即可扩大补体的生物学效应。但补体 系统若过度激活,不仅无益地消耗大量补体成分,使机体抗感染能力下降;而且在激活过程中产生的大量行物活性物质,会使机体发生剧烈的 炎症反应或造成组织损伤,引起病理过程。这种过度激活及其所造成的不良后果,可通过调控机制而避免。这种调控机制包括补体系统中某些 成分的裂解产物易于自行衰变以及多种灭活因子和抑制物的调节作用。 (一)自行衰变调节 某些补体成分的裂解产物极不稳定,易于自行衰变,成为补体激活过程中的一种自控机制。例如C42复合物中的C2b自行衰变即可使C42不 再能持续激活C3,从而限制了后续补体成分的连锁反应。C5b亦易于自行衰变,影响到C6~C9与细胞膜的结合。 (二)体液中灭物质的调节 血清中含有多种补体成分的抑制或灭活特定的补体成分

CI抑制物:CI抑制物(Ciinhibitor,.CNH)可与C1不可逆地结合,使后者失去酯酶活性,不再裂解C4和C2,即不再形成C42(C3转化 葡),从而阻断或制弱后续补体成分的反应。遇传性H缺陷的患者,可发生多以面部为中心的皮下血管性水种,并常以消化道或呼吸道粘 摸的局限性血管性水肿为特征。其发生机制是C未被抑制,与C4、C2作用后产生的C2(旧称C2b的小片段)为补体激肽,或增强血管通透性, 因而发生血管性钟。 CNH缺陷时,C4、C2接连不断地坡活化,故体内C4、C2水平下降;因其不能在固相上形成有效的C42(C3转化酶),所以C3及其后续 成分不被活化。因此本病不像C3~C8缺陷那样容易发生感染, 大部分CINH缺陷病人与遗传有关,另有约IS%的病人无遇传史,其CINH虽有抗原性但无活性(部分可产生正常CINH,并非完全缺 陷),前者称为型血管性水肿,后者称为Ⅲ型血管性水种(Ase2等,1987), 血管性水肿可用提纯的CNH治疗,据称有效,亦可给以男性激素制剂以促进肝合成CINH,预防水肿的发生, C4结合蛋白:C4结合蛋白(C4 binding protein,C4bp)能竞争性地抑制C4b与C2b结合,因此能抑C42(C3转化酶)的形成. 1因子:1因子又称C3b灭活因子(C3 binactivator,.C3bINA)能裂解C3b,使其成为无活性的C3bi,因而使C42及C3bBb失去与C3b结合形 成C5转化确的机会, 当遗传性1因子缺陷时,C3b不被灭活而在血中持续存在,可对旁路途径呈正反馈作用,陆续使C3裂解并产生出更多的C3b,因此血中C3及 B因子的含量因消耗而降低。当发生细菌性感染时,因补体系统主要成分C3和B因子严重缺乏,削弱了抗感染作用,可因条件致病菌惹发严重 的甚至致命性后果。 H因子:H因子虽能灭活C3b,但不能使C3bBb中的C3b灭活.H因子(factor H)不仅能促进1因子灭活C3b的速度,更能竞争性地抑制B因子 与C3b的结合,还能使C3b从C3bBb中致换出来,从而加速C3bBb的灭活.由此可见,1因子和H因子在旁路途径中,确实起到重要的调节作 用。 S蛋白:S蛋白(Sprotein)能干扰C5b67与细胞膜的结合。C5b67虽能与C8、C9结合,但它若不结合到细胞膜(包括靶细跑的邻近的其他 细胞)上,战不会使细胞到螺 C8结合蛋白:C8结合蛋白(C8 binding proteinC8bp)又称为同源性限制因子(homologousrestriction factor,HRF),CS6与C7结合形成 C567即可插入细胞膜的磷密双层结构之中,但两者结合之前,可在体液中自由流动.因此,C567结合的细跑膜不限于引起补体激活的异物细 胞表面,也有机会结合在自身的细跑上,再与后续成分形成C5一9大分子复合物,会使细孢膜穿孔受损。这样会使补体激活都位邻近的自身细 胞也被殃及。 Cgb0可阻止C5678中的C8与C9的结合,从而避危及自身细胞膜的损伤作用,C8分子与C8bD之间的结合有种属特异性,即C5678中的C8与 同种CSbP反应:但与异性种动物的C8不反应,所以又称为HRF。据称C8bp也能抑制NK细胞和Tc细胞的杀伤作用,值得注意。 第三节补体受体及其免疫学功能 补体成分激活后产生的要解片段,能与免疫细跑表 特异性受休结合,这对于补体发挥其生物学活性只有重要意 补体受 C3受体等:但经详细研究后发现,补体受体并非仅与C3裂解产 而按其发现先后依次命名为CR1CD35 CR2 (CD21)CR3 (CDIINCDI8)CR4(8 p150.90:CD11c/CD18.其主要特征列于 、C3a受体、C5a受体等。因对其了解不够清楚,不拟介绍 表5补体受体的特 CRI CD35 C4B/C3b受体 C3e 肾小球上皮细胞 CR2EB病毒受体 C3d.EB病毒。 细、树突状细 IFN-a CDIbCDI8 1C3北、楂物凝集素、某些细的多糖 中性粒纸狗、单核细瓶、巨空细跑、树突状细电、K细海 CR4 中性粒、单核细瓶、巨壁细、血小板 -、CRI(CD35) CR1作为免疫粘附 1)受体而引起免疫粘附现象早已熟知。此受体也称 3b受体或C3b/C4b受体。报道,红细胞上的 其数目 和在 红细上 提纯的CR1为分子量约200kD的糖蛋白 但后来发现它有4种分子量不同的同种异型。最近,W0g等(1986)已经明,分子量的差异是 由于基因不同所致 RI的 能可能有以下 几方 中 安巨噬细胞上的CR 可与结合在细菌或病毒上的C3b结合促进吞噬纸 ②促进两 茶激活途 中的C3转化属 (C42 C3bE 于的书 促使C3b和C4b灭 上的CRI可 被调理(结合有C3b)的细 病毒或免度复合物等结合 以便运送 牌进行处理 SLE病人免夜复合物量明显增多,其红细胞膜上的 CR1在体内有运送免疫复合物的作用;⑤B淋巴细泡膜上的CRI与CR2协同作用下 可促使B细胞活化
CI抑制物:CI抑制物(Ci inhibitor,CIINH)可与CI不可逆地结合,使后者失去酯酶活性,不再裂解C4和C2,即不再形成C42(C3转化 酶),从而阻断或削弱后续补体成分的反应。遗传性CIINH缺陷的患者,可发生多以面部为中心的皮下血管性水肿,并常以消化道或呼吸道粘 膜的局限性血管性水肿为特征。其发生机制是CI未被抑制,与C4、C2作用后产生的C2a(旧称C2b的小片段)为补体激肽,或增强血管通透性, 因而发生血管性肿。 CIINH缺陷时,C4、C2接连不断地被活化,故体内C4、C2水平下降;因其不能在固相上形成有效的C42(C3转化酶),所以C3及其后续 成分不被活化。因此本病不像C3~C8缺陷那样容易发生感染。 大部分CIINH缺陷病人与遗传有关,另有约15%的病人无遗传史,其CIINH虽有抗原性但无活性(部分可产生正常CIINH,并非完全缺 陷)。前者称为I型血管性水肿,后者称为Ⅱ型血管性水肿(Alsenz等,1987)。 血管性水肿可用提纯的CIINH治疗,据称有效,亦可给以男性激素制剂以促进肝合成CIINH,预防水肿的发生。 C4结合蛋白:C4结合蛋白(C4 binding protein, C4bp)能竞争性地抑制C4b与C2b结合,因此能抑制C42(C3转化酶)的形成。 I因子:I因子又称C3b灭活因子(C3b inactivator, C3b INA)能裂解C3b,使其成为无活性的C3bi,因而使C42及C3bBb失去与C3b结合形 成C5转化酶的机会。 当遗传性I因子缺陷时,C3b不被灭活而在血中持续存在,可对旁路途径呈正反馈作用,陆续使C3裂解并产生出更多的C3b。因此血中C3及 B因子的含量因消耗而降低。当发生细菌性感染时,因补体系统主要成分C3和B因子严重缺乏,削弱了抗感染作用,可因条件致病菌惹发严重 的甚至致命性后果。 H因子:H因子虽能灭活C3b,但不能使C3bBb中的C3b灭活。H因子(factor H)不仅能促进I因子灭活C3b的速度,更能竞争性地抑制B因子 与C3b的结合,还能使C3b从C3bBb中致换出来,从而加速C3bBb的灭活。由此可见,I因子和H因子在旁路途径中,确实起到重要的调节作 用。 S蛋白:S蛋白(Sprotein)能干扰C5b67与细胞膜的结合。C5b67虽能与C8、C9结合,但它若不结合到细胞膜(包括靶细胞的邻近的其他 细胞)上,就不会使细胞裂解。 C8结合蛋白:C8结合蛋白(C8binding protein,C8bp)又称为同源性限制因子(homologousrestriction factor,HRF)。C56与C7结合形成 C567即可插入细胞膜的磷脂双层结构之中,但两者结合之前,可在体液中自由流动。因此,C567结合的细胞膜不限于引起补体激活的异物细 胞表面,也有机会结合在自身的细胞上,再与后续成分形成C5~9大分子复合物,会使细胞膜穿孔受损。这样会使补体激活部位邻近的自身细 胞也被殃及。 C8bp可阻止C5678中的C8与C9的结合,从而避危及自身细胞膜的损伤作用。C8分子与C8bp之间的结合有种属特异性,即C5678中的C8与 同种C8bp反应;但与异性种动物的C8不反应,所以又称为HRF。据称C8bp也能抑制NK细胞和Tc细胞的杀伤作用,值得注意。 第三节 补体受体及其免疫学功能 补体成分激活后产生的裂解片段,能与免疫细胞表面的特异性受体结合。这对于补体发挥其生物学活性具有重要意义。 补体受体(complementruceptor,CR)曾按其所结合配体而命名为C3b受体、C3d受体等;但经详细研究后发现,补体受体并非仅与C3裂解产 物反应,因而按其发现先后依次命名为CR1(CD35),CR2(CD21),CR3(CD11b/CD18),CR4(gp150,90:CD11c/CD18)。其主要特征列于 表3-5。此外,尚有其他补体成分的受体,如Ciq受体、C3a受体、C5a受体等。因对其了解不够清楚,不拟介绍。 表3-5 补体受体的特征 名称 别名 CD分类 配体特异性 细胞分布 CR1 IA受体 C3b受体 C4B/C3b受体 CD35 C3bi、C3b C4b、iC4b C3c 红细胞、中性粒细胞 单核细胞、巨噬细胞 B细胞、树突状细胞 肾小球上皮细胞 CR2 C3d受体 EB病毒受体 CD21 Ic3b、C3dg C3d、EB病毒、 1FN-α B细胞、树突状细胞 CR3 iC3b受体 Mac-1抗原 CD11b/CD18 IC3b、植物凝集素、某些细胞多糖 中性粒细胞、单核细胞、巨噬细胞、树突状细胞、NK细胞 CR4 gp150/95 CD11C/CD18 Ic3b、C3d、C3dg 中性粒细胞、单核细胞、巨噬细胞、血小板 一、CR1(CD35) CR1作为免疫粘附(immuneadherent,IA)受体而引起免疫粘附现象早已熟知。此受体也称为C3b受体或C3b/C4b受体。据报道,红细胞上的 CR1数约为50~1400个/细胞,其数目显着少于B细胞和吞噬细胞,但体内90%的CR1却存于红细胞上。 提纯的CR1为分子量约200kD的糖蛋白,但后来发现它有4种分子量不同的同种异型。最近,Wong等(1986)已经阐明,分子量的差异是 由于基因不同所致。 CR1的免疫功能可能有以下几方面:①中性粒细胞和单核-巨噬细胞上的CR1,可与结合在细菌或病毒上的C3b结合,促进吞噬细胞的吞噬 作用;②促进两条激活途径中的C3转化酶(C42),C3bBb)的激活;③作为I因子的辅助因子,促使C3b和C4b灭活;④红细胞上的CR1可与 被调理(结合有C3b)的细胞、病毒或免疫复合物等结合,以便运送到肝、脾进行处理,SLE病人免疫复合物量明显增多,其红细胞膜上的 CR1在体内有运送免疫复合物的作用;⑤B淋巴细胞膜上的CR1与CR2协同作用下,可促使B细胞活化

二、CR2(CD21) CR2旧称C3d受体,已经证明,它是B细跑上的EB病毒受体。CR2配体按其亲和性的高低程度依次为C3dg、C3d.1e3北。C3b亲和性虽低, 但亦可与其反应, CR2的免疫功能尚未阐明清楚范,但实验表明,当加入CR配体时可使B细孢活化。据此推想,在抗体的二次应答中它也许会想某种作用,即 借结合在抗原复合物上的C3裂解产物,引起针对该抗原的二次抗体应答。 三、CR3(CD11b/CD18) CR3亦称为Ic3b受体。CR3的配体是iC3b.但CRL,CR2.也和iC3b反应,CR3与配体结合时尚需有二价离子存在,为其特点 CR3是由分子量16SkD的u链(CD11b)和9SkD的B链CD18)非共价结合的糖蛋白,识别此分子的单克隆抗 本有Mc.I和MO.1等。CR3与CR (CD11C1CD18)有共同的链,因此其功能也多有相似之处,白细跑粘附缺陷病(Ie cy)病人缺乏这种共同的继 病人的中性粒细虽正常,但不能停留在感染的部位,因此病人易反复受感染,这表明CR3和CR4均与吞噬功能密切相关。 四、CR4(gp15095.,CD11eCD18) 中性粒细和单核巨噬细跑高度表达本受体,其配体为1C3b,但针对其他补体受体的单克隆抗体不能阳断CR4与C3b的结合,证明CR4的 存在.CR4与8p15095为 一分子,对其功能尚有诸多不明之处.据认为CR4在排除组织内与:C3b的结合的顾粒上起作用。它和CR3一样,与 配体结合需有二价离子的存在,CR3很可能在机体防御上有重要作用。 第四节补体的生物学活性 补体系统是人和某些动物种属,在长期的种系进化过程中获得的非特异性免疫因素之一,它也在特异性免疫中发挥效应,它的作用是多方 面的。补体系统的生物学活性,大多是由补体系统激活时产生的各种活性物质(主要是裂解产物)发挥的。补体成分及其裂解产物的生物活性 列于表36. 补体分配环解产物 物话性 用容道、杀菌作用 ,使细购膜穿孔、细内容物渗 作用 作用 一、细胞毒及溶菌、杀菌作用 补体能溶解红细胞、白细跑及血小板等。当补体系统的膜攻击单位C5~C9均结合到细跑摸上,细跑会出现肿张和超感结构的改变,细胞膜 表面出现许多直径为812mm的圆形损害灶,最导致细肉溶解 补体还能溶解或杀伤某些革兰氏阴性萄,如霍乱萄、沙门氏菌及嗜血杆菌等,革兰氏阳性菌一般不被溶解,这可能与细跑壁的结构特殊 或细胞表面缺乏补体作用的底物有关。 二、调理作用 ,可促进吞噬细胞的吞 端能与细 (或免疫复合物)结合 巨细胞 与吞表面之间 到桥染作用,从而促进了吞。LG类抗体借助于吞噬细 表面的gG-F受体也能起到调理作用;为区别于补体的调理作用而称其为免(抗 体)的调理作用。LM类抗体本身起调理作用,但在补体参与下才能间接起到调理作用 三、免疫粘附作用 免疫复合物激活朴体之后,可通过C3b而粘附到表面有C3b受体的红细胞.、血小板或某些淋巴细孢上,形成较大的聚合物,可能有助于被吞 噬清除。 四、中和及溶解病毒作用 在病毒与相应抗体形成的复合物中加入补体,则明显增强抗体对病毒的中和作用阻止病志对宿主细胞的吸附和穿入 近年来发现,不依赖特异性抗体,只有补体即可溶解病声的现象。例如RNA肿密病毒及C型RNA病声均可被灵长类动物的补体所溶解,据 认为这是由于此类病声包上的C受体结合C之后所造成的 五、炎症介质作用
二、CR2(CD21) CR2旧称C3d受体,已经证明,它是B细胞上的EB病毒受体。CR2配体按其亲和性的高低程度依次为C3dg、C3d、Ic3b。C3b亲和性虽低, 但亦可与其反应。 CR2的免疫功能尚未阐明清楚,但实验表明,当加入CR2配体时可使B细胞活化。据此推想,在抗体的二次应答中它也许会想某种作用,即 借结合在抗原复合物上的C3裂解产物,引起针对该抗原的二次抗体应答。 三、CR3(CD11b/CD18) CR3亦称为Ic3b受体,CR3的配体是iC3b,但CR1、CR2、也和iC3b反应。CR3与配体结合时尚需有二价离子存在,为其特点。 CR3是由分子量165kD的α链(CD11b)和95kD的β链(CD18)非共价结合的糖蛋白,识别此分子的单克隆抗体有Mac-1和Mo-1等。CR3与CR4 (CD11C/CD18)有共同的β链,因此其功能也多有相似之处,白细胞粘附缺陷病(leucocyteadhesion deficiency)病人缺乏这种共同的β链。 病人的中性粒细胞虽正常,但不能停留在感染的部位,因此病人易反复遭受感染。这表明CR3和CR4均与吞噬功能密切相关。 四、CR4(gp150/95,CD11c/CD18) 中性粒细胞和单核-巨噬细胞高度表达本受体。其配体为iC3b,但针对其他补体受体的单克隆抗体不能阻断CR4与iC3b的结合,证明CR4的 存在。CR4与gp150/95为同一分子,对其功能尚有诸多不明之处。据认为CR4在排除组织内与iC3b的结合的颗粒上起作用。它和CR3一样,与 配体结合需有二价离子的存在。CR3很可能在机体防御上有重要作用。 第四节 补体的生物学活性 补体系统是人和某些动物种属,在长期的种系进化过程中获得的非特异性免疫因素之一,它也在特异性免疫中发挥效应,它的作用是多方 面的。补体系统的生物学活性,大多是由补体系统激活时产生的各种活性物质(主要是裂解产物)发挥的。补体成分及其裂解产物的生物活性 列于表3-6。 补体成分或裂解产物 生物活性 作用机制 C5~C9 细胞毒作用溶菌、杀菌作用 嵌入细胞膜的磷脂双层结构中,使细胞膜穿孔、细胞内容物渗漏 C3b 调理作用 与细菌或细胞结合使之易被吞噬 C3b 免疫粘附作用 与抗原抗体复合物结合后,粘附于红细胞或血小板,使复合物易被吞噬 C1、C4 中和病毒作用 增强抗体的中和作用,或直接中和某些RNA肿瘤毒 C2a 补体激肽 增强血管通透性 C3a、C5a 过敏毒素 与肥大细胞或嗜碱性粒细胞结合后释放同组胺等介质,使毛细胞血管扩张 C3a、C5a 趋化因子 借其梯度浓度吸引中性粒细胞及单核细胞 一、细胞毒及溶菌、杀菌作用 补体能溶解红细胞、白细胞及血小板等。当补体系统的膜攻击单位C5~C9均结合到细胞膜上,细胞会出现肿胀和超威结构的改变,细胞膜 表面出现许多直径为8~12mm的圆形损害灶,最终导致细胞溶解。 补体还能溶解或杀伤某些革兰氏阴性菌,如霍乱弧菌、沙门氏菌及嗜血杆菌等,革兰氏阳性菌一般不被溶解,这可能与细胞壁的结构特殊 或细胞表面缺乏补体作用的底物有关。 二、调理作用 补体裂解产物C3b与细菌或其他颗粒结合,可促进吞噬细胞的吞噬,称为补体的调理作用。C3裂解产生出的C3b分子,一端能与靶细胞 (或免疫复合物)结合;其另一端能与细胞表面有C3b受体的细胞(单核细胞、巨噬细胞、中性粒细胞等)结合,在靶细胞与吞噬表面之间起 到桥染作用,从而促进了吞噬。LgG类抗体借助于吞噬细胞表面的lgG-Fe受体也能起到调理作用;为区别于补体的调理作用而称其为免疫(抗 体)的调理作用。LgM类抗体本身起调理作用,但在补体参与下才能间接起到调理作用。 三、免疫粘附作用 免疫复合物激活补体之后,可通过C3b而粘附到表面有C3b受体的红细胞、血小板或某些淋巴细胞上,形成较大的聚合物,可能有助于被吞 噬清除。 四、中和及溶解病毒作用 在病毒与相应抗体形成的复合物中加入补体,则明显增强抗体对病毒的中和作用,阻止病毒对宿主细胞的吸附和穿入。 近年来发现,不依赖特异性抗体,只有补体即可溶解病毒的现象。例如RNA肿瘤病毒及C型RNA病毒均可被灵长类动物的补体所溶解。据 认为这是由于此类病毒包膜上的Cl受体结合Clq之后所造成的。 五、炎症介质作用 炎症也是免疫防御反应的一种表现。感染局部发生炎症时,补体裂解产物可使毛细血管通透性增强,吸引白细胞到炎症局部。 (一)激肽样作用

C2a能增加血管通透性,☑引起炎症性充血,具有激肽样作用,故称其为补体激肽,前述CNH先天性缺陷引起的遗传性血管神经水种即因 血中C2a水平增高所致. (仁)过敏毒素作用 C3a,C5均有过敏毒素作用,可使肥大细胞或堵碱性粒细胞释放组胺,写引起血管扩张,增加毛细血管通透性以及使平滑肌收缩等。 C3a,C5的过敏毒素活性,可被血清中的羧肽璃B(过敏毒素灭活因子)所灭活。 (但)趋化作用 C5有趋化作用,故又称为趋化因子,能吸引具有C5a受体的吞噬细跑游走到补体被激活(即趋化因子浓度最高)的部 第五节血清补体水平与疾病 人血清补体含量相对稳定,只在去某些疾病时,血清补体总量或各成分含量才可能发生变动。目前可以根据补体的溶血活性测定其总含 量,亦可用免疫扩散法定某些补体成分的含量。 恶性肿密等少数疾病病人血清补体总量可较正常人高2一3倍,对其意义并不清楚。在某些传染病中亦可见到代偿性增高. 血清补体总量低于正常值者,称为低补体血症,低补体血症可见于以下几种情况:①补体成分的大量消抚:可发生在血清病、链球菌感染 后肾小球胃炎、系统性红珉狼疮、自身免疫性溶血性贫血,类风湿性关节炎及同种异体移植排斥反应等。在这些疾病,除补体总量下降外,尚 可伴有Cq、C4、C2、C3及C5各成分的减少.②补体的大量丢失,多见于外伤、手术和大失血的病人.补体成分随血清蛋白的扩大量丧失而丢 失,发生低补体血症。③补体合成不足:主要见于肝病人,刷如肝硬化、慢性活动性肝炎和急性肝炎的重症病例
C2a能增加血管通透性,引起炎症性充血,具有激肽样作用,故称其为补体激肽。前述Ci INH先天性缺陷引起的遗传性血管神经水肿即因 血中C2a水平增高所致。 (二)过敏毒素作用 C3a、C5a均有过敏毒素作用,可使肥大细胞或嗜碱性粒细胞释放组胺,引起血管扩张,增加毛细血管通透性以及使平滑肌收缩等。 C3a、C5a的过敏毒素活性,可被血清中的羧肽酶B(过敏毒素灭活因子)所灭活。 (三)趋化作用 C5a有趋化作用,故又称为趋化因子,能吸引具有C5a受体的吞噬细胞游走到补体被激活(即趋化因子浓度最高)的部 第五节 血清补体水平与疾病 人血清补体含量相对稳定,只在患某些疾病时,血清补体总量或各成分含量才可能发生变动。目前可以根据补体的溶血活性测定其总含 量,亦可用免疫扩散法定某些补体成分的含量。 恶性肿瘤等少数疾病病人血清补体总量可较正常人高2~3倍,对其意义并不清楚。在某些传染病中亦可见到代偿性增高。 血清补体总量低于正常值者,称为低补体血症。低补体血症可见于以下几种情况:①补体成分的大量消耗:可发生在血清病、链球菌感染 后肾小球肾炎、系统性红斑狼疮、自身免疫性溶血性贫血、类风湿性关节炎及同种异体移植排斥反应等。在这些疾病,除补体总量下降外,尚 可伴有Clq、C4、C2、C3及C5各成分的减少。②补体的大量丢失,多见于外伤、手术和大失血的病人。补体成分随血清蛋白的扩大量丧失而丢 失,发生低补体血症。③补体合成不足:主要见于肝病人,例如肝硬化、慢性活动性肝炎和急性肝炎的重症病例