《无机化学》教学大纲 (供制药工程、药学、中药学, 临床药学医学检验。卫生检验本科活用 、目的要求 无机化学是高等院校环境、生物、医药、化工、材料、轻工等专业的一门重要必修课,它是培养上 述各类专业应用型人才的整体知识结构及能力结构的重要组成部分,同时也是后续化学课程的基 通过本课程的教学,应使学生掌握必要的化学反应基本原理、物质结构基础理论、元素化学基本知 识以及实验基本技能,培养学生具有分析处理一般无机化学问题与实验操作的能力,自学一般无机 化学书刊以获取新知识的初步能力】 学时分配 章节 内容 理论学时实验学时总学时 第1音 化学热力学基础 3 6 第2章 化学反应速度和化学平衡 6 3 6 第3章 电解质溶预和溶液酸减性 6 第4章 沉淀溶解平衡 6 5音 氧化还原与电化学 3 第6章 配位化合物 3 9 第7吉 原子结构与元素周期系 9 第8音 分子结构与晶体 6 6 第9章 元素化学部分 总计 45 30 75 三.教学内容 第一章化学热力学基础 基本内容有热力学中常用的术语:体系、环境、过程、状态函数、热和功。 热力学第一定律、热化学、盖斯定律。 掌握标准生成热及标准燃烧热的定义、热化学反应方程式的书写和ess定律应用。 熟悉标准生成热及标准燃烧热的计算和查表,并能用其计算化学反应的热效应, 了解热力学常用的术语 第 章化学反应速度和化学平衡 第 节化学反应凍度 基本内容有化学反应速度的定义及表示方法、反应速度理论简介、影响化学反应速度的因素。 第一节化学平 基本内容有化学反应的可逆性和化学平衡、平衡特征、平衡常数的书写规则、Kc、K的关系、与平 衡常数有关的运算、分压定律及分体积定律、转化率、标准平衡常数与吉布斯自由能的关系、化学 平衡的移动。 掌握化学反应速度的定义及表示方法:浓度、温度及催化剂对化学反应速度的影响。分压定律及分 体积定律;标准平衡常数K与△G的关系;平衡常数的物理意义及书写规则;浓度平衡常数Kc与压力 平衡常数Kp的关系 熟悉基元反应速度常数、反应级数及活化能的计算。利用平衡常数求转化率的计算;应用化学反应 等温式解释浓度及体系总压力的改变对化学平衡的影响;定性解释温度对化学平衡的影响,同时会 定量计算。 了解碰撞理论及过渡状态理论化学平衡的特征 章电解质溶 和溶液酸碱 第一节 电解质溶液 基本内容有强电解质溶液理论、离子活度和活度系数、离子氛和离子强度等概念、弱酸、弱碱的电 离平衡、同离子效应和盐效应、多元弱酸的电力平衡
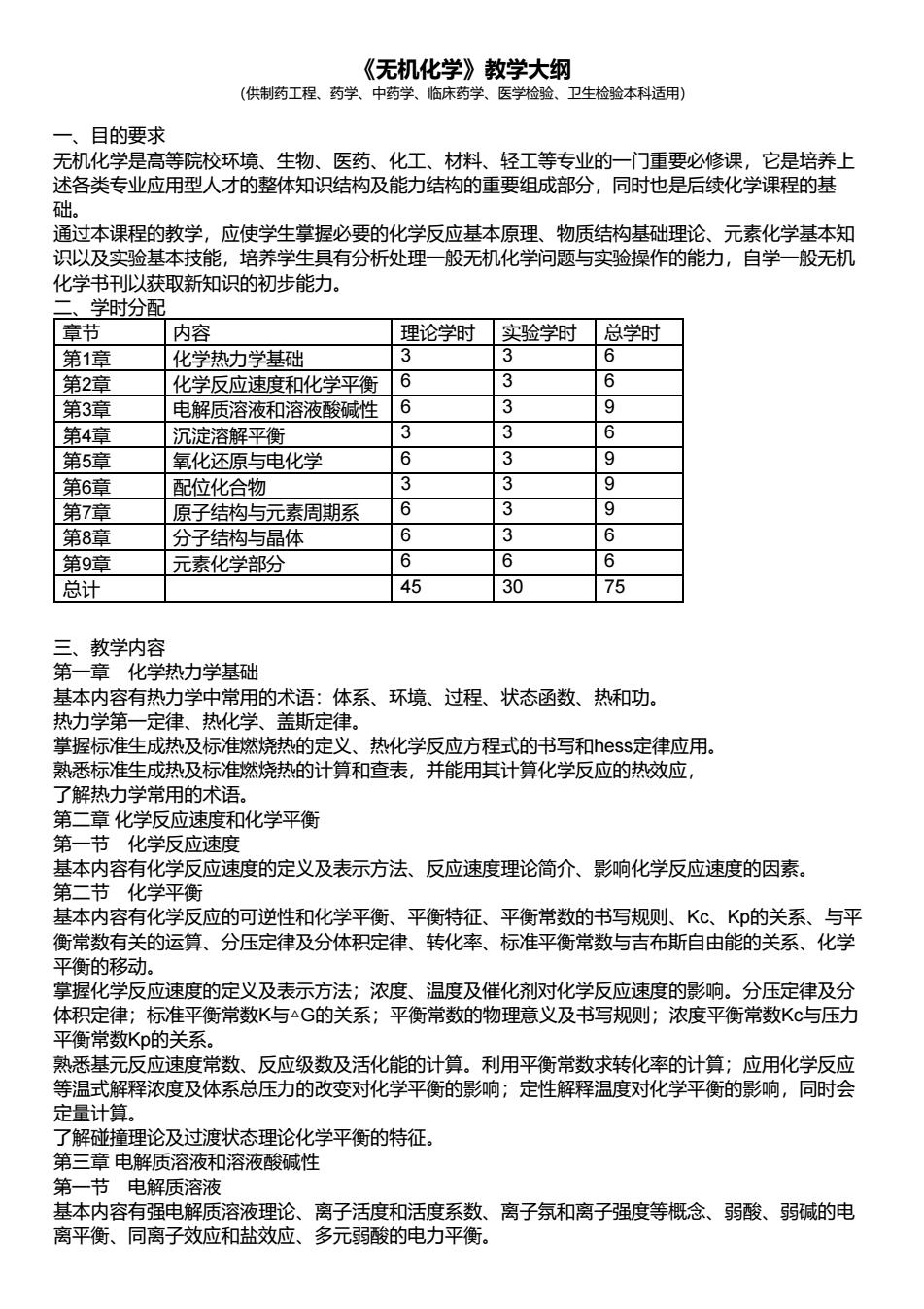
《无机化学》教学大纲 (供制药工程、药学、中药学、临床药学、医学检验、卫生检验本科适用) 一、目的要求 无机化学是高等院校环境、生物、医药、化工、材料、轻工等专业的一门重要必修课,它是培养上 述各类专业应用型人才的整体知识结构及能力结构的重要组成部分,同时也是后续化学课程的基 础。 通过本课程的教学,应使学生掌握必要的化学反应基本原理、物质结构基础理论、元素化学基本知 识以及实验基本技能,培养学生具有分析处理一般无机化学问题与实验操作的能力,自学一般无机 化学书刊以获取新知识的初步能力。 二、学时分配 章节 内容 理论学时 实验学时 总学时 第1章 化学热力学基础 3 3 6 第2章 化学反应速度和化学平衡 6 3 6 第3章 电解质溶液和溶液酸碱性 6 3 9 第4章 沉淀溶解平衡 3 3 6 第5章 氧化还原与电化学 6 3 9 第6章 配位化合物 3 3 9 第7章 原子结构与元素周期系 6 3 9 第8章 分子结构与晶体 6 3 6 第9章 元素化学部分 6 6 6 总计 45 30 75 三、教学内容 第一章 化学热力学基础 基本内容有热力学中常用的术语:体系、环境、过程、状态函数、热和功。 热力学第一定律、热化学、盖斯定律。 掌握标准生成热及标准燃烧热的定义、热化学反应方程式的书写和hess定律应用。 熟悉标准生成热及标准燃烧热的计算和查表,并能用其计算化学反应的热效应, 了解热力学常用的术语。 第二章 化学反应速度和化学平衡 第一节 化学反应速度 基本内容有化学反应速度的定义及表示方法、反应速度理论简介、影响化学反应速度的因素。 第二节 化学平衡 基本内容有化学反应的可逆性和化学平衡、平衡特征、平衡常数的书写规则、Kc、Kp的关系、与平 衡常数有关的运算、分压定律及分体积定律、转化率、标准平衡常数与吉布斯自由能的关系、化学 平衡的移动。 掌握化学反应速度的定义及表示方法;浓度、温度及催化剂对化学反应速度的影响。分压定律及分 体积定律;标准平衡常数K与△G的关系;平衡常数的物理意义及书写规则;浓度平衡常数Kc与压力 平衡常数Kp的关系。 熟悉基元反应速度常数、反应级数及活化能的计算。利用平衡常数求转化率的计算;应用化学反应 等温式解释浓度及体系总压力的改变对化学平衡的影响;定性解释温度对化学平衡的影响,同时会 定量计算。 了解碰撞理论及过渡状态理论化学平衡的特征。 第三章 电解质溶液和溶液酸碱性 第一节 电解质溶液 基本内容有强电解质溶液理论、离子活度和活度系数、离子氛和离子强度等概念、弱酸、弱碱的电 离平衡、同离子效应和盐效应、多元弱酸的电力平衡

第二节溶液的酸碱性 基本内容有水的电离及水的离子积、PH、Pka、PKb的定义;酸碱指示剂、指示剂的变色范围、酸 碱质子 共轭酸碱对Ka Kb的关系;缓冲溶液的概念 缓冲溶液的配制、缓冲溶液的缓冲机 理;各类盐的水解及溶液PH值得计算、影响水解平衡移动的因素。 掌握弱酸、弱碱溶液中有关离子浓度的计算;多元弱酸电离机理及相关离子浓度的计算;离子强度 的计算。缓冲溶液的配制、作用机理及有关运算;酸碱质子理论并会运用该理论说明酸碱反应和比 较酸减强弱:各类盐溶液PH制的计算 熟悉利用化学 平衡原理分析弱电解质的电离平衡;解释同离子效应和盐效应对电离平衡的影响及有 关计算。利用化学平衡原理分析弱电解质的电离平衡。 了解活度及活度系数的概念,酸碱指示剂的变色范围及变色机理。 第四章沉淀溶解平衡 基本内容有溶解度和溶度积之间的相互换算;溶度积规则:同离子效应积盐效应:沉淀的生成、转 化、溶解的条件: 掌握难溶电解质的溶度积与溶解度之间互相换算;同离子效应的盐效应对难溶强电解质溶解度的影 响:沉淀先后顺序;沉淀转化及控制溶液PH制方面的有关计算。 熟悉利用溶度积规则判断沉淀的生成和溶解。 化学基础 一节 氧化还原反应 基本内容有氧化还原反应的特性和本质、氧化数的概念;氧化还原反应的配平方法。 第二节电化学基础 原电池、电池符号、电极反应、电极电势的产生;标准氢电极和标准电极电势:能斯特方程式和影 响电极电势的因素标准电极电势 吉布斯自由能的关系、 与平衡常数的关系;标 电极电势表的 应用;电势图及其应用、参比电极类 掌握氧化数的概念,会用离子-电子法配平方程式:氧化还原的基本概念。电化学有关基本概念;浓 度和沉淀的生成对电极电势的影响,并能熟练计算;标准电极电势和反应自由能变化之间的关系: 标准电动势和热力学平衡常数之间的关系,并能熟练计算;元素标准电极电势图的应用。 熟悉配平步联 标准电极电势表的查法、用法;运用电极电势判断氧化剂、还原剂的相对强弱,判 断氧化还原反应的方向。 了解氧化数与化合价的区别。电极的类型和电势的测定。 第六章配位化合物 基本内容有配合物的定义、组成和命名;配合物的价键理论:配合物的晶体场理论:配合物的离解 平衡;配合物的 化还原稳定性;螯合物及配合 的掩流 般配合物组成的命名;配合物结构中价键理论的基本内容并能解释配离子或配合物的空间构 型;配位平衡移动及其他平衡的关系。 熟悉配位平衡常数的意义,并能用平衡常数计算配合物溶液中处于平衡状态是个物质浓度。 了解整合物。 七章原子结构与元素周期系 节 原子结构基本知识 波粒二象性;氢原子光谱、玻尔理论;波函数与原子轨道;电子云、波函数的空间图像;四个量子 数、核外电子排布规律, 第二节周期性与元素基本性质 原子的子 构和元素周期性 元素基本性质的周期性 掌握四个量子数的取值及其与原子核外电子运动状态的关系;多电子原子的轨道能级,记住近似能 级图;核外电子排布所遵循的规律,会写出一些常见元素的原子核外电子排布。元素在周期表中的 位置一原子外层电子构型物质性质三者之间的相互关系。元素的原子半径、电离能、电子亲合能 及电负性的意义, 以及它们在周期表中的变化规律。 熟悉元素周期系与原子核外电子排布之间的关系根据原子的电子层结构,能熟练地确定元素在周期 系中的位置。 了解原子轨道级电子云的概念。周期表的结构
第二节 溶液的酸碱性 基本内容有水的电离及水的离子积、PH、Pka、PKb的定义;酸碱指示剂、指示剂的变色范围、酸 碱质子理论、共轭酸碱对Ka、Kb的关系;缓冲溶液的概念、缓冲溶液的配制、缓冲溶液的缓冲机 理;各类盐的水解及溶液PH值得计算、影响水解平衡移动的因素。 掌握弱酸、弱碱溶液中有关离子浓度的计算;多元弱酸电离机理及相关离子浓度的计算;离子强度 的计算。缓冲溶液的配制、作用机理及有关运算;酸碱质子理论并会运用该理论说明酸碱反应和比 较酸碱强弱;各类盐溶液PH制的计算。 熟悉利用化学平衡原理分析弱电解质的电离平衡;解释同离子效应和盐效应对电离平衡的影响及有 关计算。利用化学平衡原理分析弱电解质的电离平衡。 了解活度及活度系数的概念,酸碱指示剂的变色范围及变色机理。 第四章 沉淀溶解平衡 基本内容有溶解度和溶度积之间的相互换算;溶度积规则;同离子效应积盐效应;沉淀的生成、转 化、溶解的条件。 掌握难溶电解质的溶度积与溶解度之间互相换算;同离子效应的盐效应对难溶强电解质溶解度的影 响;沉淀先后顺序;沉淀转化及控制溶液PH制方面的有关计算。 熟悉利用溶度积规则判断沉淀的生成和溶解。 第五章 氧化还原与电化学基础 第一节 氧化还原反应 基本内容有氧化还原反应的特性和本质、氧化数的概念;氧化还原反应的配平方法。 第二节 电化学基础 原电池、电池符号、电极反应、电极电势的产生;标准氢电极和标准电极电势;能斯特方程式和影 响电极电势的因素;标准电极电势与吉布斯自由能的关系、与平衡常数的关系;标准电极电势表的 应用;电势图及其应用、参比电极类型。 掌握氧化数的概念,会用离子-电子法配平方程式;氧化还原的基本概念。电化学有关基本概念;浓 度和沉淀的生成对电极电势的影响,并能熟练计算;标准电极电势和反应自由能变化之间的关系; 标准电动势和热力学平衡常数之间的关系,并能熟练计算;元素标准电极电势图的应用。 熟悉配平步骤。标准电极电势表的查法、用法;运用电极电势判断氧化剂、还原剂的相对强弱,判 断氧化还原反应的方向。 了解氧化数与化合价的区别。电极的类型和电势的测定。 第六章 配位化合物 基本内容有配合物的定义、组成和命名;配合物的价键理论;配合物的晶体场理论;配合物的离解 平衡;配合物的氧化还原稳定性;螯合物及配合物的掩蔽与解蔽。 掌握一般配合物组成的命名;配合物结构中价键理论的基本内容并能解释配离子或配合物的空间构 型;配位平衡移动及其他平衡的关系。 熟悉配位平衡常数的意义,并能用平衡常数计算配合物溶液中处于平衡状态是个物质浓度。 了解螯合物。 第七章 原子结构与元素周期系 第一节 原子结构基本知识 波粒二象性;氢原子光谱、玻尔理论;波函数与原子轨道;电子云、波函数的空间图象;四个量子 数、核外电子排布规律。 第二节 周期性与元素基本性质 原子的电子层结构和元素周期性;元素基本性质的周期性。 掌握四个量子数的取值及其与原子核外电子运动状态的关系;多电子原子的轨道能级,记住近似能 级图;核外电子排布所遵循的规律,会写出一些常见元素的原子核外电子排布。元素在周期表中的 位置-原子外层电子构型-物质性质三者之间的相互关系。元素的原子半径、电离能、电子亲合能 及电负性的意义,以及它们在周期表中的变化规律。 熟悉元素周期系与原子核外电子排布之间的关系根据原子的电子层结构,能熟练地确定元素在周期 系中的位置。 了解原子轨道级电子云的概念。周期表的结构

第八章分子结构与晶体 第一节分子结构基本知识 基本内容有离子键理论、共价键理论、金属键理论、分子间作用力、氢键理论。 第二节晶体结构基本知识 晶体特征、离子晶体理论、原子晶体理论、分子晶体理论、金属晶体理论、离子极化理论: 掌握离子键、共价键的形成和性质,学会判断一些典型的化学键;0键和π键的形成和性质,学会确 定单质分子中的σ键和π键;根据价键理论理解共价键的形成、特性;根据分子轨道理论的基本要点 理解分子磁性。晶体合非晶体的区别及晶体的类型;不同类型晶体的组成和特征。 熟悉氢键的概念,形成条件、特征及其对物质性质的影响。常见物质分子间作用力及对应晶体的形 成和性质。 了解杂化轨道理论要点;离子极化的概念及影响因素。氯化钠晶体的结构特征。 第九章元素化学部分 第一节主族元素基本知识 基本内容有主族元素中常见元素及化合物的性质和用途。 第二节过渡元素基本知识 基本内容有过渡元素常见元素及化合物的性质及用途。 掌握碱金属、碱土金属、氮族、氧族、卤族元素的单质极重要化合物的性质。过渡元素金属单质及 重要化合物的性质。 熟悉某些单质及化合物的典型制备方法、常见单质及化合物对应反应方程式的书写;某些单质及化 合物的用途。 了解单质及化合物酸碱性、氧化还原性的变化规律、有毒有害物质对环境的污染和对人体健康的危 害
第八章 分子结构与晶体 第一节 分子结构基本知识 基本内容有离子键理论、共价键理论、金属键理论、分子间作用力、氢键理论。 第二节 晶体结构基本知识 晶体特征、离子晶体理论、原子晶体理论、分子晶体理论、金属晶体理论、离子极化理论。 掌握离子键、共价键的形成和性质,学会判断一些典型的化学键;σ键和π键的形成和性质,学会确 定单质分子中的σ键和π键;根据价键理论理解共价键的形成、特性;根据分子轨道理论的基本要点 理解分子磁性。晶体合非晶体的区别及晶体的类型;不同类型晶体的组成和特征。 熟悉氢键的概念,形成条件、特征及其对物质性质的影响。常见物质分子间作用力及对应晶体的形 成和性质。 了解杂化轨道理论要点;离子极化的概念及影响因素。氯化钠晶体的结构特征。 第九章 元素化学部分 第一节 主族元素基本知识 基本内容有主族元素中常见元素及化合物的性质和用途。 第二节 过渡元素基本知识 基本内容有过渡元素常见元素及化合物的性质及用途。 掌握碱金属、碱土金属、氮族、氧族、卤族元素的单质极重要化合物的性质。过渡元素金属单质及 重要化合物的性质。 熟悉某些单质及化合物的典型制备方法、常见单质及化合物对应反应方程式的书写;某些单质及化 合物的用途。 了解单质及化合物酸碱性、氧化还原性的变化规律、有毒有害物质对环境的污染和对人体健康的危 害