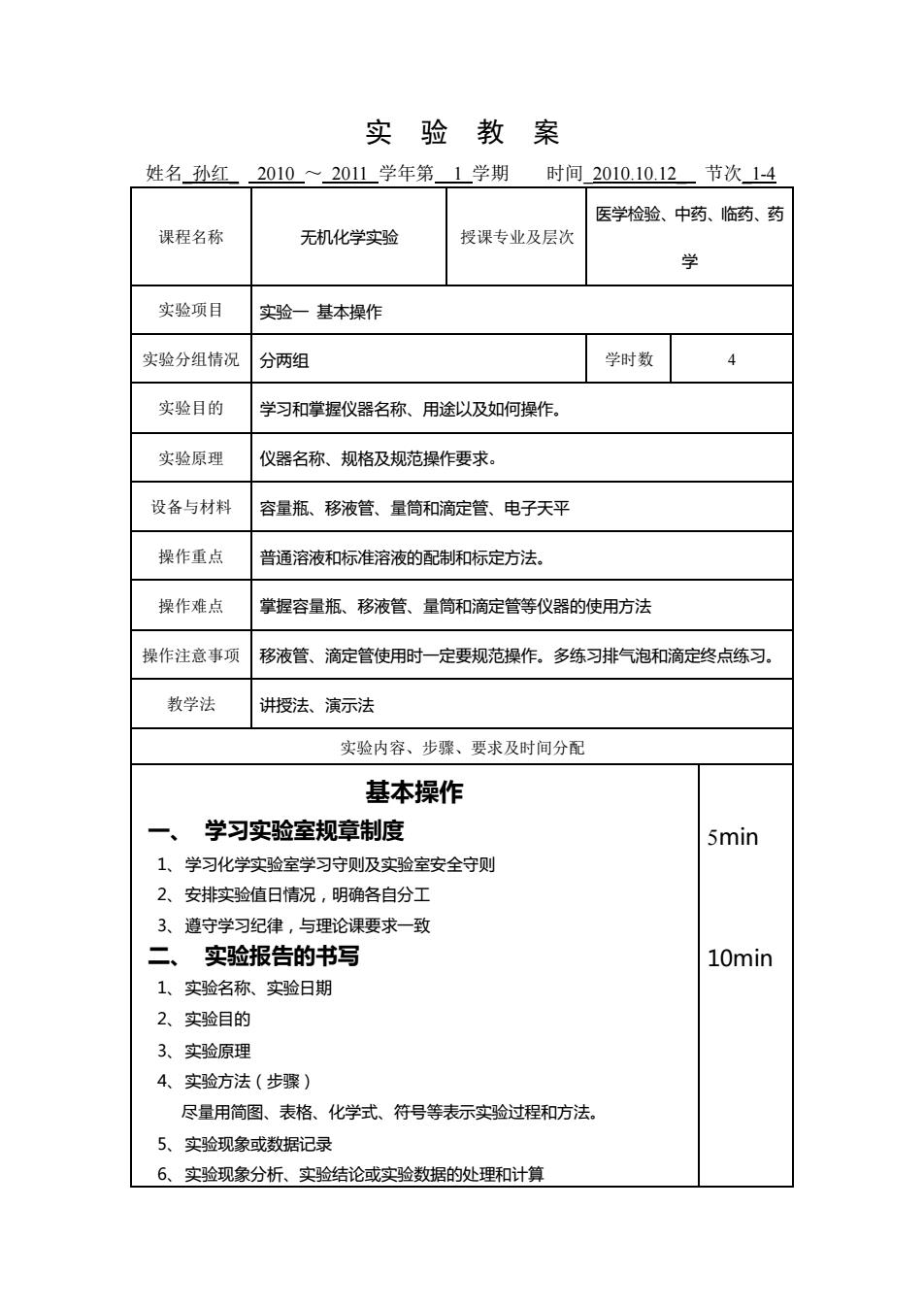
实验教案 姓名孙红 2010~2011学年第1学期时间2010.10.12节次14 医学检验、中药、临药、药 课程名称 无机化学实验 授课专业及层次 学 实验项目 实验一基本操作 实验分组情况 分两组 学时数 4 实验目的 学习和掌握仪器名称、用途以及如何操作。 实验原理 仪器名称、规格及规范操作要求。 设备与材料 容量瓶、移液管、量筒和滴定管、电子天平 操作重点 普通溶液和标准溶液的配制和标定方法。 操作难点 掌握容量瓶、移液管、量筒和滴定管等仪器的使用方法 操作注意事项 移液管、滴定管使用时一定要规范操作。多练习排气泡和滴定终点练习, 教学法 讲授法、演示法 实验内容、步骤、要求及时间分配 基本操作 学习实验室规章制度 5min 1、学习化学实验室学习守则及实验室安全守则 2、安排实验值日情况,明确各自分工 遵守学习纪律,与理论课要求一致 实验报告的书写 10min 1、实验名称、实验日期 2、实验目的 3、实验原理 4、实验方法(步骤) 尽量用简图、表格、化学式、符号等表示实验过程和方法, 5、实验现象或数据记录 6、实验现象分析、实验结论或实验数据的处理和计算
实 验 教 案 姓名_孙红_ 2010 ~ 2011 学年第 1 学期 时间_2010.10.12_ 节次_1-4 课程名称 无机化学实验 授课专业及层次 医学检验、中药、临药、药 学 实验项目 实验一 基本操作 实验分组情况 分两组 学时数 4 实验目的 学习和掌握仪器名称、用途以及如何操作。 实验原理 仪器名称、规格及规范操作要求。 设备与材料 容量瓶、移液管、量筒和滴定管、电子天平 操作重点 普通溶液和标准溶液的配制和标定方法。 操作难点 掌握容量瓶、移液管、量筒和滴定管等仪器的使用方法 操作注意事项 移液管、滴定管使用时一定要规范操作。多练习排气泡和滴定终点练习。 教学法 讲授法、演示法 实验内容、步骤、要求及时间分配 基本操作 一、 学习实验室规章制度 1、学习化学实验室学习守则及实验室安全守则 2、安排实验值日情况,明确各自分工 3、遵守学习纪律,与理论课要求一致 二、 实验报告的书写 1、实验名称、实验日期 2、实验目的 3、实验原理 4、实验方法(步骤) 尽量用简图、表格、化学式、符号等表示实验过程和方法。 5、实验现象或数据记录 6、实验现象分析、实验结论或实验数据的处理和计算 5min 10min

根据对实验现象的分析、解释,得出正确的结论,或根据记录的数据进 行计算,将实验值与理论值进行比较,客观的分析产生实验误差的原因。 7、实验讨论 对实验中出现的问题进行认真的讨论分析,从中得出有益的经验,以知 道自己今后更好的完成实验。 三、实验基本操作练习 1、仪器的洗涤 165 min 2、仪器的使用方法 3、溶液的配制 (1)配制0.9%NaC1溶液50ml (2)配制1mol/naOH溶液24ml (3)配制滴定分析用0.1000mol/NaC03溶液100ml 附:详细讲解容量瓶、滴定管、移液管的使用 容量瓶的使用: 20min 溶解一转移(借助玻璃棒)一洗涤2-3次一定容一摇匀 移液管(吸量管)的使用 1、洗涤:用自来水、蒸馏水、待装液各洗2-3次 2、吸液:左手拿吸耳秋,右手控制移液管: 3、调零:右手食指、中指、拇指控制移液管,至视线与零刻度线平齐: 4、放液:接收器与移液管成450角,放完液后停留305。 滴定管的使用: 1、检漏:酸式滴定管漏水涂凡士林,碱式滴定管漏水换玻璃珠 2、洗涤:用自来水、蒸馏水、待装液各洗2-3次; 3.装液:上口装于零刻度线以上; 4、排气泡: 酸式滴定管排气泡时迅速打开旋塞让气泡冲出: 碱式滴定管排气泡时直立,将橡皮管向上弯曲与滴定管呈30°,挤压玻 璃离珠让气泡冲出,直至直立状慢慢松牙; 5、滴定:管尖与锥形瓶口1cm高,左手控制滴定管,右手控制锥形瓶做圆 周运动,直至指示剂变色; 6、读数:拿下滴定管,使其自然下垂,视线与凹液面平齐; 7、实验完毕,弃去液体,洗涤滴定管,酸管放纸条,倒置于管架
根据对实验现象的分析、解释,得出正确的结论,或根据记录的数据进 行计算,将实验值与理论值进行比较,客观的分析产生实验误差的原因。 7、实验讨论 对实验中出现的问题进行认真的讨论分析,从中得出有益的经验,以知 道自己今后更好的完成实验。 三、实验基本操作练习 1、仪器的洗涤 2、仪器的使用方法 3、溶液的配制 (1) 配制 0.9%NaC1 溶液 50ml (2) 配制 1mol/LnaOH 溶液 24ml (3) 配制滴定分析用 0.1000mol/LNa2CO3溶液 100ml 附:详细讲解容量瓶、滴定管、移液管的使用: 容量瓶的使用: 溶解→转移(借助玻璃棒)→洗涤 2-3 次→定容→摇匀 移液管(吸量管)的使用 1、洗涤:用自来水、蒸馏水、待装液各洗 2-3 次; 2、吸液:左手拿吸耳秋,右手控制移液管; 3、调零:右手食指、中指、拇指控制移液管,至视线与零刻度线平齐; 4、放液:接收器与移液管成 450角,放完液后停留 30s。 滴定管的使用: 1、检漏:酸式滴定管漏水涂凡士林,碱式滴定管漏水换玻璃珠; 2、洗涤:用自来水、蒸馏水、待装液各洗 2-3 次; 3、装液:上口装于零刻度线以上; 4、排气泡: 酸式滴定管排气泡时迅速打开旋塞让气泡冲出; 碱式滴定管排气泡时直立,将橡皮管向上弯曲与滴定管呈 300,挤压玻 璃珠让气泡冲出,直至直立状慢慢松开; 5、滴定:管尖与锥形瓶口 1cm 高,左手控制滴定管,右手控制锥形瓶做圆 周运动,直至指示剂变色; 6、读数:拿下滴定管,使其自然下垂,视线与凹液面平齐; 7、实验完毕,弃去液体,洗涤滴定管,酸管放纸条,倒置于管架。 165 min 20min

注意事项: 1、移液管(吸量管)吸液或放液时手指要灵活控制流速,多练至熟练操作 2、练习滴定管半滴的加入方法; 3、酸管涂凡士林时不要堵塞管口。 实验教案 姓名孙红 2010~2011学年第1学期时间2010.10.19节次1-4 医学检验、中药、临药、药 课程名称 无机化学实验 授课专业及层次 实验项目 实验二 粗食盐的提纯 实验分组情况 分两组 学时数 4 实验目的 掌握化学方法提纯氯化钠的过程和原理, 实验原理 用沉淀过滤或酸碱中和法去除粗食盐中的泥沙和一些可溶的杂质离子。 设备与材料 真空抽滤装置、酒精灯、蒸发皿、漏斗等。粗食盐和去除杂质的药品。 操作重点 练习称量、沉淀、过滤、结晶的基本操作 操作难点 结晶操作 操作注意事项 1、除杂过程中药品不要过量太多。2、不能忘记检验产品纯度。 教学法 讲授法、演示法 实验内容、步骤、要求及时间分面 粗食盐的提纯 1.目的要求 5min (1)学习提纯氯化钠的原理和基本方法 (2)练习称量、沉淀、过滤、结晶的基本操作。 (3)掌握Ca2+、Mg2+和S042·的鉴定方法. 5min
注意事项: 1、移液管(吸量管)吸液或放液时手指要灵活控制流速,多练至熟练操作; 2、练习滴定管半滴的加入方法; 3、 酸管涂凡士林时不要堵塞管口。 实 验 教 案 姓名_孙红_ 2010~2011 学年第 1 学期 时间_2010.10.19 节次 1-4_ 课程名称 无机化学实验 授课专业及层次 医学检验、中药、临药、药 学 实验项目 实验二 粗食盐的提纯 实验分组情况 分两组 学时数 4 实验目的 掌握化学方法提纯氯化钠的过程和原理。 实验原理 用沉淀过滤或酸碱中和法去除粗食盐中的泥沙和一些可溶的杂质离子。 设备与材料 真空抽滤装置、酒精灯、蒸发皿、漏斗等。粗食盐和去除杂质的药品。 操作重点 练习称量、沉淀、过滤、结晶的基本操作。 操作难点 结晶操作 操作注意事项 1、除杂过程中药品不要过量太多。2、不能忘记检验产品纯度。 教学法 讲授法、演示法 实验内容、步骤、要求及时间分配 粗食盐的提纯 1.目的要求 (1)学习提纯氯化钠的原理和基本方法。 (2)练习称量、沉淀、过滤、结晶的基本操作。 (3)掌握 Ca2+、Mg2+和 SO4 2- 的鉴定方法。 5min 5min

2.基本原理 粗盐中主要含有K+、Br·、I、Ca2+、Mg2+和S042等杂质离 子,此外,还有泥沙等不溶性物质。 (1去除方法 不溶性物质一氯化钠溶于水后过滤 ②杂质离子一选择适当沉淀剂生成难溶化合物除去 S042.+Ba2+→ BaSO4l Ca2++C02·CaC03l 4Mg2++4CO32-+H2O=Mg(OH)2-3MgCO3l+CO2t Ba2++C032· BaCO3l C02-+2H一 CO21+H20 少量可溶性K+、Br~、I~等利用重结晶除去。 3、纯度检验 ()纯品氯化钠 应是无色、透明的立方形结晶或白色结晶性粉末;无臭,味咸。 (2)在水溶液中显钠盐与氯化钠的各种特殊反应 15min 3)药物中杂质的检查 ①酸碱度检查 ②硫酸盐检查 S042+Ba2+ BaSO4l ④钡盐的检查 ⑤镁离子检查
2.基本原理 粗盐中主要含有 K+、Br-、I-、Ca2+、Mg2+和 SO4 2-等杂质离 子,此外,还有泥沙等不溶性物质。 ⑴去除方法 ○1不溶性物质—氯化钠溶于水后过滤 ②杂质离子—选择适当沉淀剂生成难溶化合物除去 SO4 2-+Ba2+ BaSO4↓ Ca2++CO3 2- CaCO3↓ 4Mg2++4CO3 2-+H2O=Mg(OH)2·3MgCO3↓+CO2↑ Ba2++CO3 2- BaCO3↓ CO3 2-+2H+ CO2↑+H2O 少量可溶性 K+、Br-、I-等利用重结晶除去。 3、纯度检验 ⑴纯品氯化钠 应是无色、透明的立方形结晶或白色结晶性粉末;无臭,味咸。 ⑵在水溶液中显钠盐与氯化钠的各种特殊反应 ⑶药物中杂质的检查 ①酸碱度检查 ②硫酸盐检查 SO4 2-+Ba2+ BaSO4↓ ④钡盐的检查 ⑤镁离子检查 15min

3.讲解基本操作 四、注意事项 1、常压过滤的操作规范“三低两靠 2、减压抽虑的基本操作规范 布氏漏斗长缘远离吸虑嘴; 先拔胶皮管再关真空泵;: 3、反应中PH的控制 4、注意减少用水量以减少过滤和浓缩所用时间;掌握小火烘干的 技巧 实验教案 姓名孙红 2010一201山学年第1学期时间2010.1026节次14 医学检验、中药、临药、药 课程名称 无机化学实验 授课专业及层次 学 实验项目 实验三 沉淀溶解平衡 实验分组情况 分两组 学时数 4
3.讲解基本操作 四、注意事项: 1、常压过滤的操作规范“三低两靠” 2、减压抽虑的基本操作规范 布氏漏斗长缘远离吸虑嘴; 先拔胶皮管再关真空泵;; 3、反应中 PH 的控制 4、注意减少用水量以减少过滤和浓缩所用时间;掌握小火烘干的 技巧; 实 验 教 案 姓名_孙红_ 2010 ~ 2011 学年第 1 学期 时间_2010.10.26_ 节次 1-4 课程名称 无机化学实验 授课专业及层次 医学检验、中药、临药、药 学 实验项目 实验三 沉淀溶解平衡 实验分组情况 分两组 学时数 4

实验目的 掌握沉淀的溶解和转化的条件。 实验原理 沉淀溶解平衡、溶度积规则侧、沉淀的溶解和转化。 设备与材料 离心装置、吸量管、试管、量筒、滴管等。Pb(NOz、KM、NaC等. 操作重点 掌握沉淀溶解平衡及溶度积原理的应用。 操作难点 沉淀的啭化。 操作注意事项 1、药品用量一定要合适。2、仔细观察现象随时记录 教学法 讲授法、演示法 实验内容、步骤、要求及时间分配 沉淀溶解平衡 一、实验目的 5min 1、掌握沉淀溶解平衡及溶度积原理的应用 2、掌握沉淀的溶解和转化的条件; 10min 二、实验原理 溶度积规则: Qc=Sp饱和溶液处于平衡状态。 QcSp过饱和溶液,溶液中有沉淀析出。 同离子效应:在难溶电解质水溶液中,加入与该难溶电解质具有 相同离子的可溶性强电解质时,使弱电解质的电离度减小的现象,称 为同离子效应。 分步沉淀:当溶液中含有几种离子,加入某中试剂可与几种离子 都产生沉淀时,则溶液中的几种沉淀反应按一定顺序先后发生,这种
实验目的 掌握沉淀的溶解和转化的条件。 实验原理 沉淀溶解平衡、溶度积规则、沉淀的溶解和转化。 设备与材料 离心装置、吸量管、试管、量筒、滴管等。Pb(NO3)2、KI、NaCl 等。 操作重点 掌握沉淀溶解平衡及溶度积原理的应用。 操作难点 沉淀的转化。 操作注意事项 1、 药品用量一定要合适。2、仔细观察现象随时记录。 教学法 讲授法、演示法 实验内容、步骤、要求及时间分配 沉淀溶解平衡 一、实验目的 1、掌握沉淀溶解平衡及溶度积原理的应用 2、掌握沉淀的溶解和转化的条件; 二、实验原理 溶度积规则: Qc = Ksp 饱和溶液,处于平衡状态。 Qc < Ksp 不饱和溶液,固体可以继续溶解。 Qc > Ksp 过饱和溶液, 溶液中有沉淀析出。 同离子效应:在难溶电解质水溶液中,加入与该难溶电解质具有 相同离子的可溶性强电解质时,使弱电解质的电离度减小的现象,称 为同离子效应。 分步沉淀:当溶液中含有几种离子,加入某中试剂可与几种离子 都产生沉淀时,则溶液中的几种沉淀反应按一定顺序先后发生,这种 5min 10min

现象称为分步沉淀。 三、实验步骤 1、溶度积规侧则的应用 2、同离子效应 3、分布沉淀 4、沉淀的溶解 5、沉淀的转化 相关化学反应方程式: Pb2++2I-=PbI2 Ag*+C1-=AgC1 5min 2Ag*CrO42-=Agz CrO4 Pb2++S2-=PbS NH3 H20 NH4++OH- Mg2++OH-=Mg (OH)2 四、注意事项: 1、分布沉淀过程中滴加试剂一定要逐滴加入,不能振荡,并注 意观察现象。 2、书写实验报告时要有计算过程,利于解释实验现象
现象称为分步沉淀。 三、实验步骤 1、溶度积规则的应用 2、同离子效应 3、分布沉淀 4、沉淀的溶解 5、沉淀的转化 相关化学反应方程式: Pb2+ + 2I- = PbI2 Ag+ + C1- = AgC1 2Ag+ + CrO4 2-= Ag2 CrO4 Pb2+ + S2- = PbS NH3 + H20 = NH4 + + OH- Mg2+ + OH- = Mg(OH)2 四、注意事项: 1、分布沉淀过程中滴加试剂一定要逐滴加入,不能振荡,并注 意观察现象。 2、书写实验报告时要有计算过程,利于解释实验现象 5min

实验教案 姓名孙红 2010一201山学年第1学期时间2010.1116节次14 医学检验、中药、临药、药 课程名称 无机化学实验 授课专业及层次 实验项目 实验四配位化合物 实验分组情况 分两组 学时数 实验目的 了解配离子与简单离子的差别。比较配离子相对稳定性,了解螫合物形成。 实验原理 配离子在水溶液中的配位一解离平衡、影响配位平衡移动的因素 设备与材料 试管、试管架、试管刷。CuSO4、NH、NiSO4、BaC2、NaOH等。 操作重点 配位平衡与氧化还原、沉淀反应和溶液酸度的关系。 操作难点 比较配离子相对稳定性 操作注意事项 1、注意实验要求。2、观察药品浓度对实验现象的影响。 教学法 讲授法、演示法 实验内容、步骤、要求及时间分配 配位化合物 一、实验目的 5min 1、了解配离子与简单离子的区别; 2、比较配离子的相对稳定性;了解配位平衡与沉淀反应、氧化还
实 验 教 案 姓名_孙红_ 2010 ~ 2011 学年第 1 学期 时间_2010.11.16_ 节次 1-4 课程名称 无机化学实验 授课专业及层次 医学检验、中药、临药、药 学 实验项目 实验四 配位化合物 实验分组情况 分两组 学时数 4 实验目的 了解配离子与简单离子的差别。比较配离子相对稳定性,了解螯合物形成。 实验原理 配离子在水溶液中的配位—解离平衡、影响配位平衡移动的因素 设备与材料 试管、试管架、试管刷。CuSO4 、NH3、NiSO4 、BaCl2、NaOH 等。 操作重点 配位平衡与氧化还原、沉淀反应和溶液酸度的关系。 操作难点 比较配离子相对稳定性 操作注意事项 1、注意实验要求 。2、观察药品浓度对实验现象的影响 。 教学法 讲授法、演示法 实验内容、步骤、要求及时间分配 配位化合物 一、实验目的 1、了解配离子与简单离子的区别; 2、比较配离子的相对稳定性;了解配位平衡与沉淀反应、氧化还 5min

原反应和溶液酸度的关系】 3.、了解螯合物的形成。 10min 二、实验原理 配离子在水溶液中存在配位-解离平衡。如[Ag(NH)2+在溶液中 存在下述平衡: Ag*+2NH3==[Ag(NHa)2]+ Ks=LAg(NH)] 【AgI[NH,2 K为[AgNH2+的稳定常数.不同的配离子有不同的稳定常数 对于配位个数相同的配离子,稳定常数越大,配离子越稳定 5min 根据平衡移动原理改变中心原子或配体的浓度,会使配位平衡发 生移动,加入某些沉淀剂、改变溶液的浓度或溶液的酸度等,配位平 衡都会发生移动。 三、实验步骤 1、配离子的生成和配合物的组成 (1)Cu2++20H-=Cu(OH)2 Cu(OH)2+4NH3H2O =[Cu(NH3)4)2++20H-+4H2O (2)Ba2++S042-==BaS04 Ni2++20H-==Ni(OH)2 Ni(OH)2 6NH3 =[Ni(NH3)6]2++OH- (3)Fe3++nSCN==[Fe(NHn3-n(恤红色) 2、配离子稳定性的比较
原反应和溶液酸度的关系; 3、了解螯合物的形成。 二、实验原理 配离子在水溶液中存在配位-解离平衡。如[Ag(NH3)2] +在溶液中 存在下述平衡: Ag+ + 2NH3 == [Ag(NH3)2] + KS 为[Ag(NH3)2] +的稳定常数.不同的配离子有不同的稳定常数, 对于配位个数相同的配离子, 稳定常数越大, 配离子越稳定. 根据平衡移动原理改变中心原子或配体的浓度,会使配位平衡发 生移动,加入某些沉淀剂、改变溶液的浓度或溶液的酸度等,配位平 衡都会发生移动。 三、实验步骤 1、配离子的生成和配合物的组成 (1) Cu2+ + 2OH- = Cu(OH)2 Cu(OH)2 + 4NH3H2O == [Cu(NH3)4] 2+ + 2OH- +4H2O (2) Ba2+ + SO4 2- == BaSO4 Ni2+ + 2OH- == Ni(OH)2 Ni(OH)2 + 6NH3 == [Ni(NH3)6] 2+ + OH- (3) Fe3+ + nSCN- == [Fe(NH3)n]3-n(血红色) 2、配离子稳定性的比较 10min 5min 3 2 2 3 [ ( ) ] [ ][ ] Ag NH Ks Ag NH + + =

Agt +Br==AgBr AgBr +2S2032-=[Ag(S2O3)2]3 Ag*+2NH3 =[Ag(NHa)2]+ 3、配位平衡的移动 5min (1)Fe3++nSCN==[Fe(NH)n]3-n(血红色) (2)Co2++4SCN==[Co(NH)4]2-(蓝紫色) (3)Cu(OH)2+4NHH20==[CuNH)4]2++2OH+4H2O (4)[Cu(NH)4]2+==Cu2++4NH3 NH3 H+==NH4* [Cu(NH4]2++4H+==Cu2++NH4 4、螯合物的生成 四、注意事项: 1、实验过程中滴加试剂一定要逐滴加入,并注意观察现象。 2、书写实验报告时要有计算过程,利于解释实验现象 实验教案 姓名孙红 2010_~2011学年第1学期时间20101116节次5-7 课程名称 无机化学实验 授课专业及层次 药学、中药、制药工程本科 实验项目 实验五 缓冲溶液的配制与性质
Ag+ + Br- == AgBr AgBr + 2S2O3 2- = [Ag(S2O3)2] 3- Ag+ + 2NH3 == [Ag(NH3)2] + 3、配位平衡的移动 (1) Fe3+ + nSCN- == [Fe(NH3)n]3-n(血红色) (2) Co2+ + 4SCN- == [Co(NH3)4] 2- (蓝紫色) (3) Cu(OH)2 + 4NH3H2O == [Cu(NH3)4] 2+ + 2OH- +4H2O (4) [Cu(NH3)4] 2+ == Cu2+ + 4NH3 NH3 + H+ == NH4 + [Cu(NH3)4] 2+ + 4H+ == Cu2+ + NH4 + 4、螯合物的生成 四、注意事项: 1、实验过程中滴加试剂一定要逐滴加入,并注意观察现象。 2、书写实验报告时要有计算过程,利于解释实验现象 5min 实 验 教 案 姓名_孙红_ 2010 ~ 2011 学年第 1 学期 时间_2010.11.16_ 节次 5-7 课程名称 无机化学实验 授课专业及层次 药学、中药、制药工程本科 实验项目 实验五 缓冲溶液的配制与性质