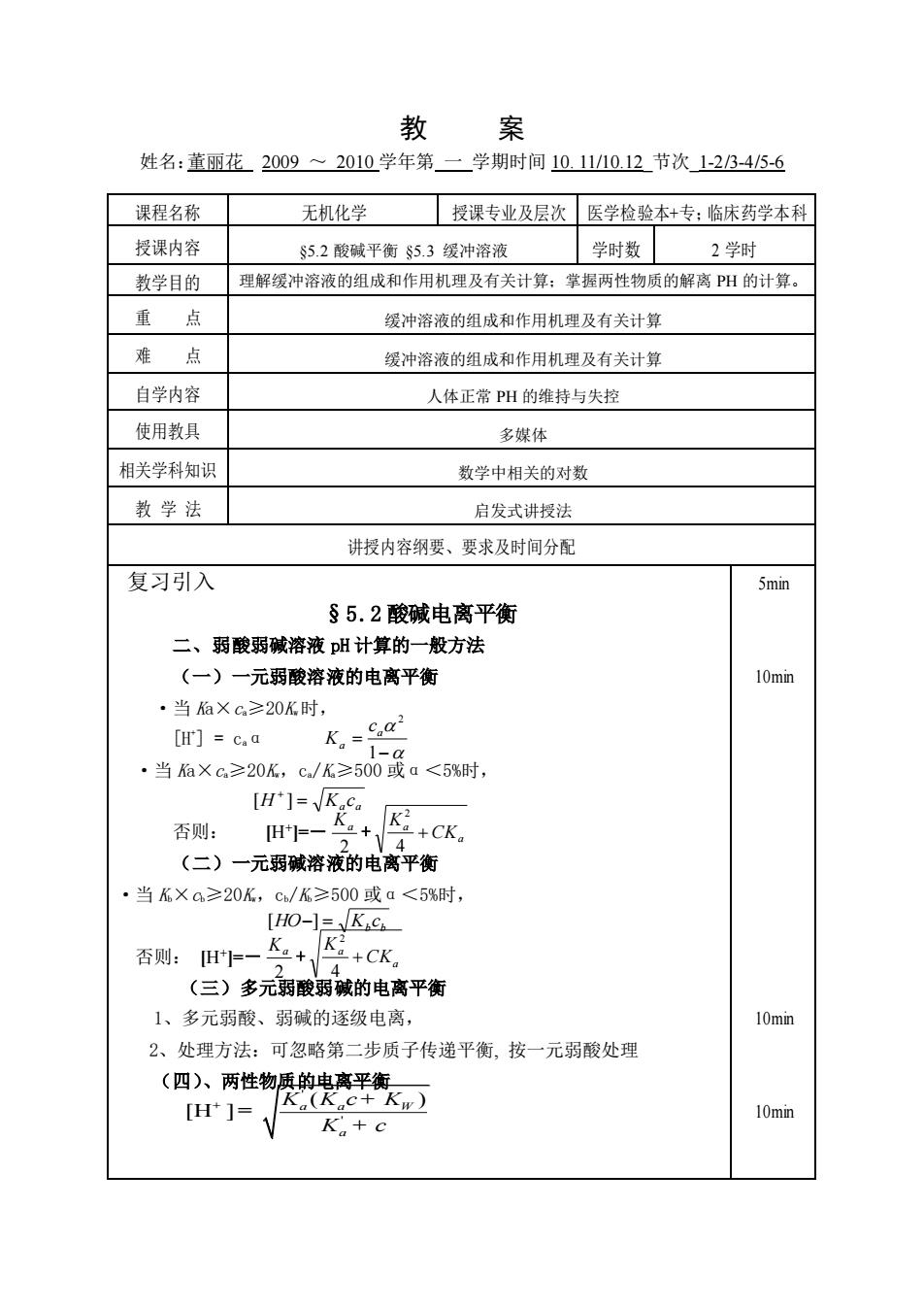
教 案 姓名:黄丽花2009~2010学年第一学期时间10.11/10.12节次123-45-6 课程名称 无机化学 授课专业及层次医学检验本+专:临床药学本科 授课内容 $5.2酸碱平衡$5.3缓冲溶液 学时数2学时 教学目的 理解缓冲溶液的组成和作用机理及有关计算:掌握两性物质的解离H的计算。 重点 缓冲溶液的组成和作用机理及有关计算 难点 缓冲溶液的组成和作用机理及有关计算 自学内容 人体正常PH的维持与失控 使用教具 多媒体 相关学科知识 数学中相关的对数 教学法 启发式讲授法 讲授内容纲要、要求及时间分配 复习引入 5min §5.2酸碱电离平衡 二、弱酸弱碱溶液pH计算的一般方法 (一)一元弱酸溶液的电离平衡 10min ·当后×c≥20K时, [H']=c.a k.=a ·当后×6≥20k,c/优≥500最。<5%时, H-K K 否则:H一a+ +CK。 V4 (二)一元弱碱溶液的电离平衡 当K×a≥20K,c/K≥500或a<5%时, [HO-1=K.C 否则:旧=一 Ka+CK。 (三)多元弱酸弱碱的电离平衡 1、多元弱酸、弱碱的逐级电离, 10min 2、处理方法:可忽略第二步质子传递平衡,按一元弱酸处理 (四,两性物质的使惠手森 H]= 10min K+c
教 案 姓名:董丽花 2009 ~ 2010 学年第 一 学期时间 10. 11/10.12_节次_1-2/3-4/5-6 课程名称 无机化学 授课专业及层次 医学检验本+专;临床药学本科 授课内容 §5.2 酸碱平衡 §5.3 缓冲溶液 学时数 2 学时 教学目的 理解缓冲溶液的组成和作用机理及有关计算;掌握两性物质的解离 PH 的计算。 重 点 缓冲溶液的组成和作用机理及有关计算 难 点 缓冲溶液的组成和作用机理及有关计算 自学内容 人体正常 PH 的维持与失控 使用教具 多媒体 相关学科知识 数学中相关的对数 教 学 法 启发式讲授法 讲授内容纲要、要求及时间分配 复习引入 §5.2 酸碱电离平衡 二、弱酸弱碱溶液 pH 计算的一般方法 (一)一元弱酸溶液的电离平衡 ·当 Ka×ca≥20Kw时, [H+ ] = caα ·当 Ka×ca≥20Kw,ca/Ka≥500 或α<5%时, 否则: [H+ ]=― 2 Ka + a a CK K + 4 2 (二)一元弱碱溶液的电离平衡 ·当 Kb×cb≥20Kw,cb/Kb≥500 或α<5%时, 否则: [H+ ]=― 2 Ka + a a CK K + 4 2 (三)多元弱酸弱碱的电离平衡 1、多元弱酸、弱碱的逐级电离, 2、处理方法:可忽略第二步质子传递平衡, 按一元弱酸处理 (四)、两性物质的电离平衡 ' ' ( ) [H ] a a W a K K c K K c + + = + 5min 10min 10min 10min − = 1 2 a a c K a a H = K c + [ ] b b [HO−] = K c

讲授内容纲要、要求及时间分配(附页】 三、拉平效应和区分效应 1、强度不同的酸或碱,在某种溶剂的作用下,其酸度和碱度被定位在同一水平上 5min 这种现象称为拉平效应:具有拉平效应的溶剂称为拉平溶剂。 2、在某种溶剂中,强度十分接近的酸和碱,在另一种溶剂中,酸碱的强弱却会表 现出明显的差别,这种现象称为区分效应:具有区分效应的溶剂称为区分溶剂。 四、同高子效应和盐效应 1、在弱电解质水溶液中,加入与该弱电解质具有相同离子的可溶性强电解质时,使 10min 弱电解质的电离度减小的现象,称为同离子效应。 2、在弱电解质水溶液中,加入与该霸电解质没有相同离子的可溶性强电解质时, 弱电解质的解离度增大的现象,称为盐效应。 同离子效应和盐效应的相关计算例题讲解 §5.3缓冲溶液 一、缓冲溶液的组成和作用机理 1、缓冲溶液的组成:一对缓冲对:弱酸及其共轭碱 15min 或弱碱及其共轭酸 2、缓冲作用的机理:弱酸或弱碱电离平衡的移动 二、缓冲溶液的计算 (重点讲解) 1、PH值计算的最简式 m-o高 [弱酸 20min 2、缓冲容量和缓冲范围 缓冲溶液的总浓度和缓冲比是影响缓冲容量的两个重要因素。 缓冲范围:PH=Pka±1 三、缓冲溶液的选择和配制(略讲,有相关实验) 1、选择合适的缓冲对 15min 2、计算弱酸弱碱的浓度比或所需的量控制弱酸弱碱的浓度在 0.05-0.5mo1/L之间,保证较大的缓冲能力 4、考虑是否与主要发生配伍禁忌等因素用阳计校准缓冲溶液 作业:复习本次课内容 P103:14,16
讲授内容纲要、要求及时间分配(附页) 三 、 拉 平 效 应 和区 分效应 1、强度不同的酸或碱,在某种溶剂的作用下,其酸度和碱度被定位在同一水平上, 这种现象称为拉平效应;具有拉平效应的溶剂称为拉平溶剂。 2、在某种溶剂中,强度十分接近的酸和碱,在另一种溶剂中,酸碱的强弱却会表 现出明显的差别,这种现象称为区分效应;具有区分效应的溶剂称为区分溶剂。 四 、 同 离 子 效应和 盐效 应 1、在弱电解质水溶液中,加入与该弱电解质具有相同离子的可溶性强电解质时,使 弱电解质的电离度减小的现象,称为同离子效应。 2、在弱电解质水溶液中,加入与该弱电解质没有相同离子的可溶性强电解质时,使 弱电解质的解离度增大的现象,称为盐效应。 同 离 子 效 应 和 盐效 应 的相 关 计算 例 题讲 解 §5.3 缓冲溶液 一、缓冲溶液的组成和作用机理 1、 缓冲溶液的组成:一对缓冲对:弱酸及其共轭碱 或弱碱及其共轭酸 2、 缓冲作用的机理:弱酸或弱碱电离平衡的移动 二、缓冲溶液的计算 (重点讲解) 1、PH 值计算的最简式 2、缓冲容量和缓冲范围 缓冲溶液的总浓度和缓冲比是影响缓冲容量的两个重要因素。 缓冲范围:PH=Pka+1 三、缓冲溶液的选择和配制 (略讲,有相关实验) 1、 选择合适的缓冲对 2、 计算弱酸弱碱的浓度比或所需的量控制弱酸弱碱的浓度在 0.05-0.5mol/L 之间,保证较大的缓冲能力 4、 考虑是否与主要发生配伍禁忌等因素用 PH 计校准缓冲溶液 作业:复习本次课内容 P103:14,16 5min 10min 15min 20min 15min [ ] [ ] lg [ ] [ ] lg 弱酸 共轭碱 = + = + − pKa HB B pH pKa
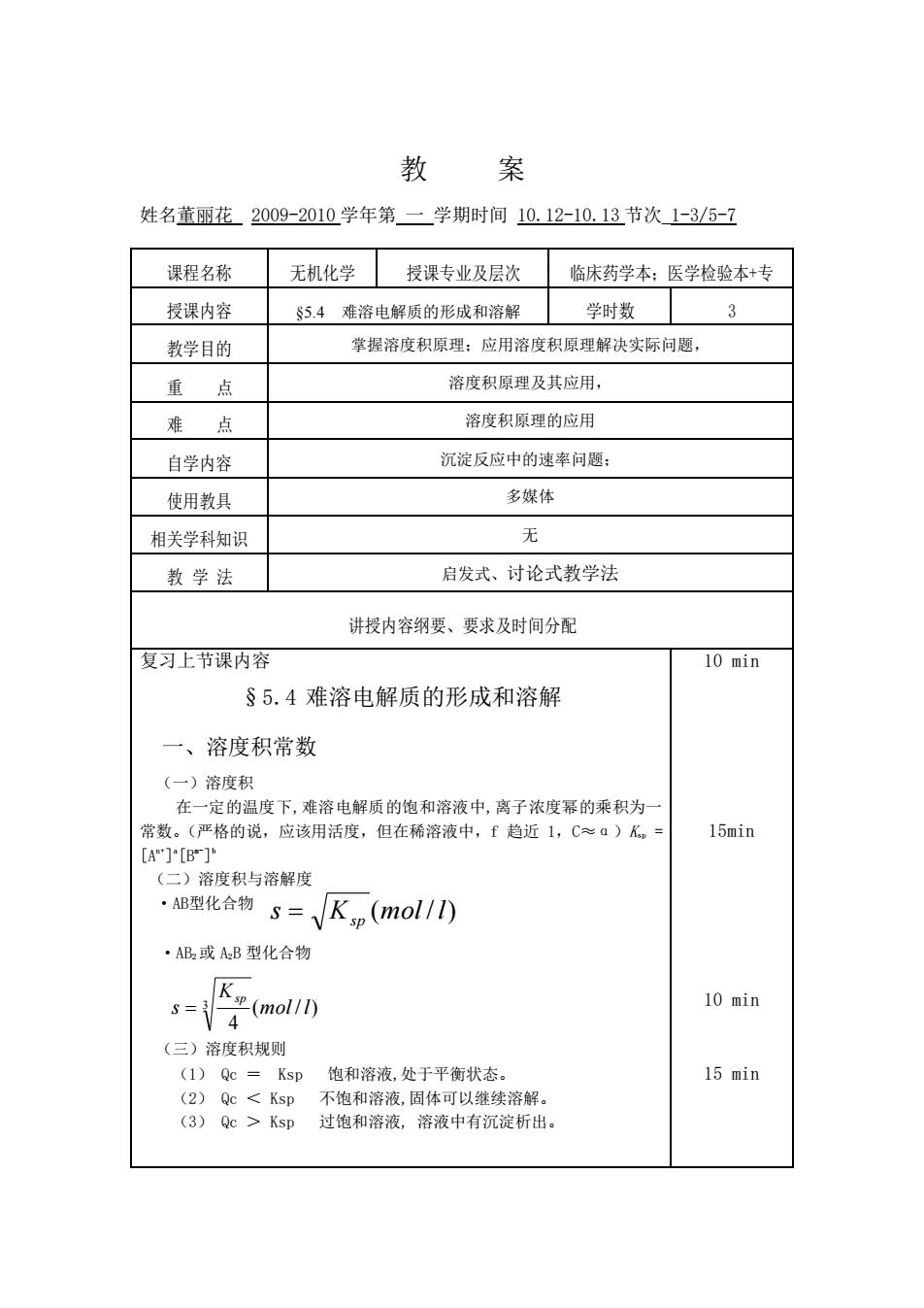
举 案 姓名黄丽花2009-2010学年第一学期时间10.12-10.13节次1-3/5-7 课程名称 无机化学授课专业及层次 临床药学本:医学检验本+专 授课内容 S5.4难溶电解质的形成和溶解 学时数 3 教学目的 掌握溶度积原理:应用溶度积原理解决实际问题, 重点 溶度积原理及其应用, 难点 溶度积原理的应用 自学内容 沉淀反应中的速率问题: 使用教具 多媒体 相关学科知识 无 教学法 启发式、讨论式教学法 讲授内容纲要、要求及时间分配 复习上节课内容 10 min §5.4难溶电解质的形成和溶解 一、溶度积常数 (一)溶度积 在一定的温度下,难溶电解质的饱和溶液中,离子浓度幂的乘积为 常数。(严格的说,应该用活度,但在稀溶液中,f趋近1,C≈a)K。 15min []'B] (二)溶度积与溶解度 ·B型化合物s=√Kp(mol/) ·AB2或AB型化合物 oli 10 min (三)溶度积规则 (1)Qc Ksp 饱和溶液,处于平衡状态。 15 min (2)QcKs即过饱和溶液,溶液中有沉淀析出
教 案 姓名董丽花 2009-2010 学年第 一 学期时间 10.12-10.13 节次_1-3/5-7 课程名称 无机化学 授课专业及层次 临床药学本;医学检验本+专 授课内容 §5.4 难溶电解质的形成和溶解 学时数 3 教学目的 掌握溶度积原理;应用溶度积原理解决实际问题, 重 点 溶度积原理及其应用, 难 点 溶度积原理的应用 自学内容 沉淀反应中的速率问题; 使用教具 多媒体 相关学科知识 无 教 学 法 启发式、讨论式教学法 讲授内容纲要、要求及时间分配 复习上节课内容 §5.4 难溶电解质的形成和溶解 一、溶度积常数 (一)溶度积 在一定的温度下,难溶电解质的饱和溶液中,离子浓度幂的乘积为一 常数。(严格的说,应该用活度,但在稀溶液中,f 趋近 1,C≈α)Ksp = [An+] a [Bm- ] b (二)溶度积与溶解度 ·AB型化合物 ·AB2 或 A2B 型化合物 (三)溶度积规则 (1) Qc = Ksp 饱和溶液,处于平衡状态。 (2) Qc < Ksp 不饱和溶液,固体可以继续溶解。 (3) Qc > Ksp 过饱和溶液, 溶液中有沉淀析出。 10 min 15min 10 min 15 min s K (mol / l) = sp ( / ) 4 3 mol l K s sp =

讲授内容纲要、要求及时间分配(附页) (四)沉淀的生成 当加入沉淀剂后,使Qc>Ks印,就会有沉淀析出。 改变溶液中离子的浓度,使Qc>p,平衡向生成沉淀的方向移动:反之30min Qc<sp,平衡向沉淀溶解的方向移动。 应用:药品检验 1、注射用水中氯化物的限度检查 2、药品中硫酸盐的检查: 3、药品中重金属离子的检查。 沉淀平衡中的同离子效应和盐效应 因加入含有共同离子的强电解质,而使难溶电解质的溶解度降低的现象,称 为沉 平衡中的同离 效应: 因加入不含与难溶电解质相同离子的易溶强电解质, 从而使难溶电解质溶解度略微增大的效应称为盐效应 方向:同一类型的难溶电解质,Ks即大的向Ksp小的方向转化。 二、分步沉淀 当溶液中含有几种离子,加入某中试剂可与几种离子都产生沉淀时,则溶液 中的几种沉淀反应按 30 min 定顺序先后发生,这种现象称为分步沉淀。 三、沉淀的溶解和转化 沉淀的溶解 根据溶度积规则,减少沉淀平衡中某离子的浓度,使沉淀平衡向左移动,使Q© <Ksp则沉淀溶解。 1.生成弱电解质, 2.利用氧化 使沉淀溶解 3Omin 3.形成难电离的配离子 沉淀的转化 定义:往含有白色P%S04沉淀的溶液中加入淡黄色的K2Cr04溶液并振荡,可 以观察到白色PbS04沉淀变为黄色PbC04沉淀。这种由一种沉淀转化为另一种 淀的过程称沉淀的转化 复习总结本章内容 1Omir 作业 1、复习本节课内容 2、P104:19、20
讲授内容纲要、要求及时间分配(附页) (四)沉淀的生成 当加入沉淀剂后,使 Qc >Ksp,就会有沉淀析出。 改变溶液中离子的浓度, 使 Qc > Ksp ,平衡向生成沉淀的方向移动;反之 Qc < Ksp ,平衡向沉淀溶解的方向移动。 应用:药品检验 1、注射用水中氯化物的限度检查; 2、药品中硫酸盐的检查; 3、药品中重金属离子的检查。 沉淀平衡中的同离子效应和盐效应 因加入含有共同离子的强电解质,而使难溶电解质的溶解度降低的现象,称 为沉淀平衡中的同离子效应;因加入不含与难溶电解质相同离子的易溶强电解质, 从而使难溶电解质溶解度略微增大的效应称为盐效应 方向:同一类型的难溶电解质,Ksp 大的向 Ksp 小的方向转化。 二、分步沉淀 当溶液中含有几种离子,加入某中试剂可与几种离子都产生沉淀时,则溶液 中的几种沉淀反应按一定顺序先后发生,这种现象称为分步沉淀。 三、沉淀的溶解和转化 沉淀的溶解 根据溶度积规则,减少沉淀平衡中某离子的浓度,使沉淀平衡向左移动,使 Qc <Ksp 则沉淀溶解。 1.生成弱电解质,使沉淀溶解 2. 利用氧化还原反应使沉淀溶解 3.形成难电离的配离子 沉淀的转化 定义:往含有白色 PbSO4 沉淀的溶液中加入淡黄色的 K2CrO4 溶液并振荡,可 以观察到白色 PbSO4 沉淀变为黄色 PbCrO4 沉淀。这种由一种沉淀转化为另一种沉 淀的过程称沉淀的转化。 复习总结本章内容 作业: 1、复习本节课内容 2、P104:19、20 30 min 30 min 30min 10min