
第二章化学反应的方向 §2.1 热力学第一定律 §2.2 化学反应的热效应 §2.3 吉布斯能和化学反应的方向
第二章 化学反应的方向 § 2.1 热力学第一定律 § 2.2 化学反应的热效应 § 2.3 吉布斯能和化学反应的方向

物质A与物质B能吞发生化学反应生成新的物质? 如果反应能发生,它是放热还是吸热反应?吸收(或放 出)多少热量? 这些反应进行到什么程度为止? 这些问题都属于化学热力学的研究范畴。 热力学(thermodynamics)是研究各种形式的能量 (如:热能、电能、化学能等)转换规律的科学。它的基 础就是热力学第一定律和热力学第二定律。 化学热力学是热力学原理在化学中的应用
物质 A 与物质 B 能否发生化学反应生成新的物质 C? 如果反应能发生,它是放热还是吸热反应?吸收(或放 出)多少热量? 这些反应进行到什么程度为止? 这些问题都属于化学热力学的研究范畴。 热力学(thermodynamics)是研究各种形式的能量 (如:热能、电能、化学能等)转换规律的科学。它的基 础就是热力学第一定律和热力学第二定律。 化学热力学是热力学原理在化学中的应用
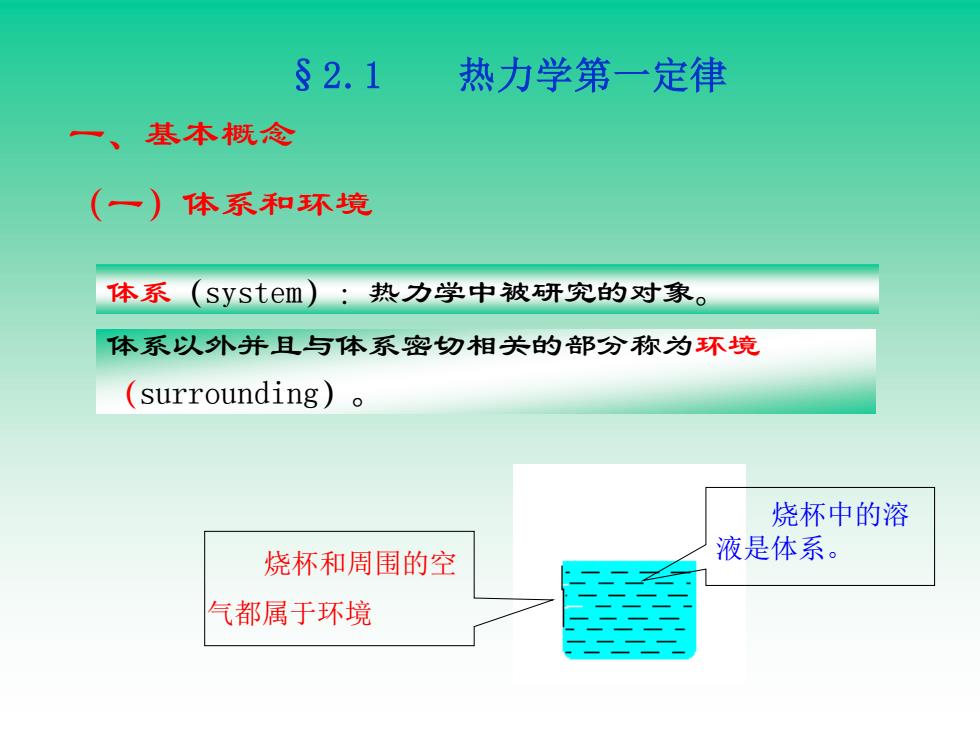
§2.1 热力学第一定律 一、 基本概念 (一)体系和环境 体系(system):热力学中被研究的对象。 体系以外并且与体系密切相关的部分称为环境 (surrounding)o 烧杯中的溶 烧杯和周围的空 液是体系。 气都属于环境
一、基本概念 体系(system):热力学中被研究的对象。 体系以外并且与体系密切相关的部分称为环境 (surrounding)。 烧杯中的溶 液是体系。 烧杯和周围的空 气都属于环境 §2.1 热力学第一定律 (一)体系和环境
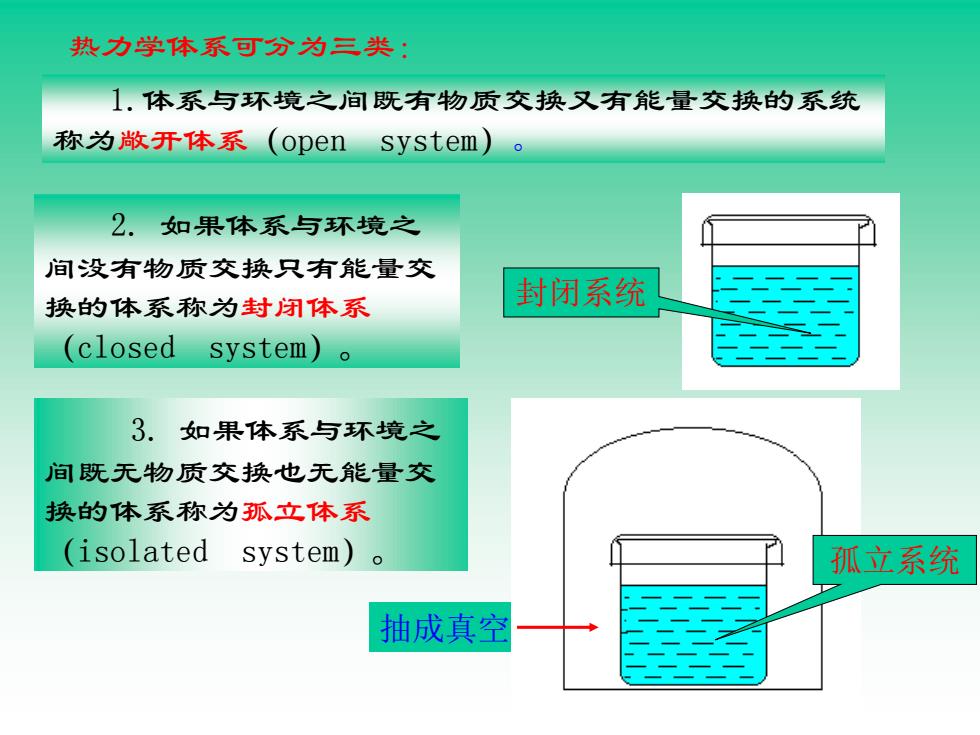
热力学体系可分为三类: 1.体系与环境之间既有物质交换又有能量交换的系统 称为敞开体系(open system) 2.如果体系与环境之 间没有物质交换只有能量交 换的体系称为封闭体系 封闭系统 (closed system)o 3.如果体系与环境之 间既无物质交换也无能量交 换的体系称为孤立体系 (isolated system)o 孤立系统 抽成真空
2. 如果体系与环境之 间没有物质交换只有能量交 换的体系称为封闭体系 (closed system)。 封闭系统 3. 如果体系与环境之 间既无物质交换也无能量交 换的体系称为孤立体系 (isolated system)。 抽成真空 孤立系统 热力学体系可分为三类: 1.体系与环境之间既有物质交换又有能量交换的系统 称为敞开体系(open system)

(三) 状态和状态函数 状态由一系列表征体系性质的物理量所确定 下来的体系的一种存在形式,称为体系的状态。 状态函数确定体系状态的物理量,称为状态国数。 例如某理想气体体系 n=2mol,p=1.013×105Pa,V=44.8dm3,T=273K 这就是一种状态。是由、p、V、T所确定下来的体 系的一种存在形式。 因而n、p、V、T都是体系的状态函数。 状态一定,则体系的状态函数一定。体系的一个或几 个状态函数发生了变化,则体系的状态发生变化
状态 由一系列表征体系性质的物理量所确定 下来的体系的一种存在形式,称为体系的状态。 状态函数 确定体系状态的物理量,称为状态函数。 例如某理想气体体系 n = 2 mol, p = 1.013 10 5 Pa, V = 44.8 dm 3 ,T = 273 K 这就是一种状态。是由 n、p、V、T 所确定下来的体 系的一种存在形式。 因而 n、p、V、T 都是体系的状态函数。 状态一定,则体系的状态函数一定。体系的一个或几 个状态函数发生了变化,则体系的状态发生变化。 (二) 状态和状态函数

根据描述体系性质的物理量与体系中物质的量的关系。 一类具有广度性质的状态函数,如:V、n、m、 u、H、S、G等。这类性质具有加合性。 状态 函数 另一类具有强度性质的状态函数,如:T、P、P、 等。这类性质没有加合性。 研究状态和状态函数时应注意两点: 1.描述一个系统所处的状态时,不必将所有的状态函 数全部列出,通常只选择几个易于测定的相互独立的状态 函数来描述系统的状态。如;PV=nRT 2.状态函数的变化值只取决于状态变化的始态和终 态,而与变化的途径天关。如:50g50C的水(始态)加 热变为50g80C的水(终态)。 △T=T(终态)-T(始态)=30℃
根据描述体系性质的物理量与体系中物质的量的关系。 一类具有广度性质的状态函数,如:V、n、m、 u、H、S、G 等。这类性质具有加合性。 另一类具有强度性质的状态函数,如:T、P、ρ、 等。这类性质没有加合性。 研究状态和状态函数时应注意两点: 1.描述一个系统所处的状态时,不必将所有的状态函 数全部列出,通常只选择几个易于测定的相互独立的状态 函数来描述系统的状态。如;PV=nRT 2.状态函数的变化值只取决于状态变化的始态和终 态,而与变化的途径无关。如:50g 50ºC的水(始态)加 热变为50g 80ºC的水(终态)。 ΔT = T (终态)-T (始态)= 30ºC。 状态 函数

(三)过程和途径 体系从一种状态变到另一种状态称为经历了一个过程。 等温过程(isothermal process)△T=0 等压过程(isobar process)△P=0 过程 等容过程(isovolumic process)△V=0 绝热过程(adiabatic process)△Q=0 途径完成一个热力学过程,可以采取多种不同的方式。 我们把每种具体的方式,称为一种途径。 过程着重于始态和终态;而途径着重于具体方式
(三)过程和途径 体系从一种状态变到另一种状态称为经历了一个过程。 过程 等温过程(isothermal process) ΔT = 0 等压过程(isobar process) ΔP = 0 等容过程(isovolumic process) ΔV = 0 绝热过程(adiabatic process) ΔQ = 0 途径 完成一个热力学过程,可以采取多种不同的方式。 我们把每种具体的方式,称为一种途径。 过程着重于始态和终态;而途径着重于具体方式
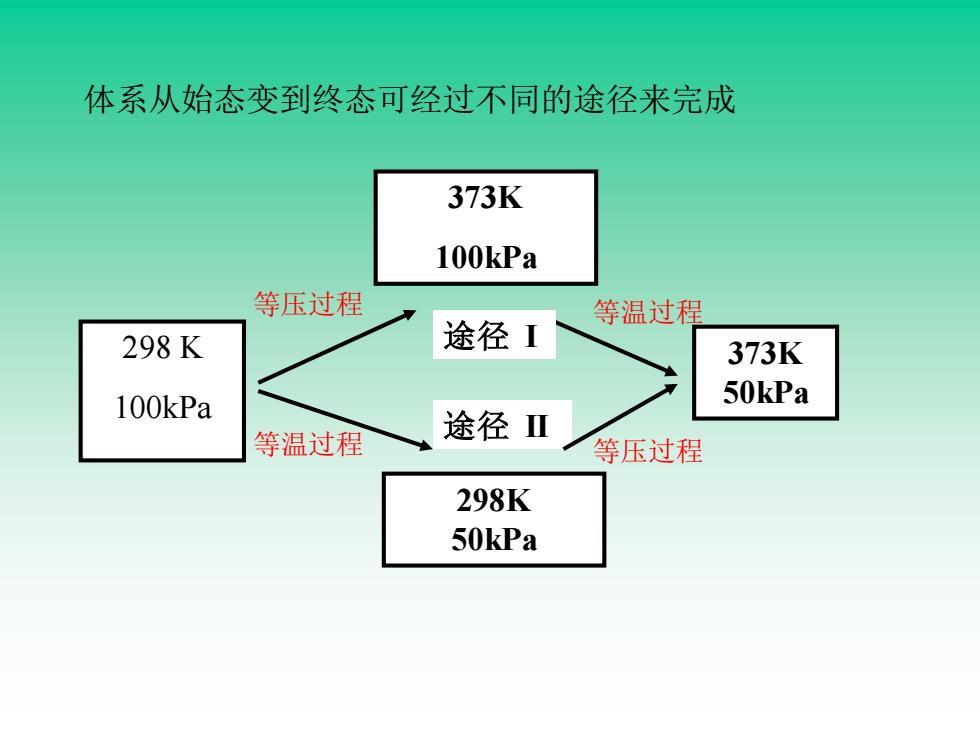
体系从始态变到终态可经过不同的途径来完成 373K 100kPa 等压过程 等温过程 298K 途径I 373K 100kPa 50kPa 等温过程 途径Ⅱ 等压过程 298K 50kPa
体系从始态变到终态可经过不同的途径来完成 途径 I 373K 100kPa 373K 50kPa 298 K 100kPa 途径 II 298K 50kPa 等压过程 等温过程 等压过程 等温过程

二、热力学第一定律 (一)热和功 在热力学中,热(heat)是系统和环境之间由于温度差 而交换的能量形式,常用符号“Q”表示。体系和环境之间 除了热以外的一切能量交换形式统称为功(wOk),常用 符号“W”表示。 系统向环境放热,Q为负值,即Q0。 热力学规定: 系统对环境作功,W为负值,即WO。 热和功不是状态函数,热和功的变化数值与系统的变化 途径密切相关
二、热力学第一定律 (一)热和功 在热力学中,热(heat)是系统和环境之间由于温度差 而交换的能量形式,常用符号“Q”表示。体系和环境之间 除了热以外的一切能量交换形式统称为功(work),常用 符号“W”表示。 热力学规定: 系统向环境放热,Q为负值,即Q 0。 系统对环境作功,W为负值,即W 0。 热和功不是状态函数,热和功的变化数值与系统的变化 途径密切相关
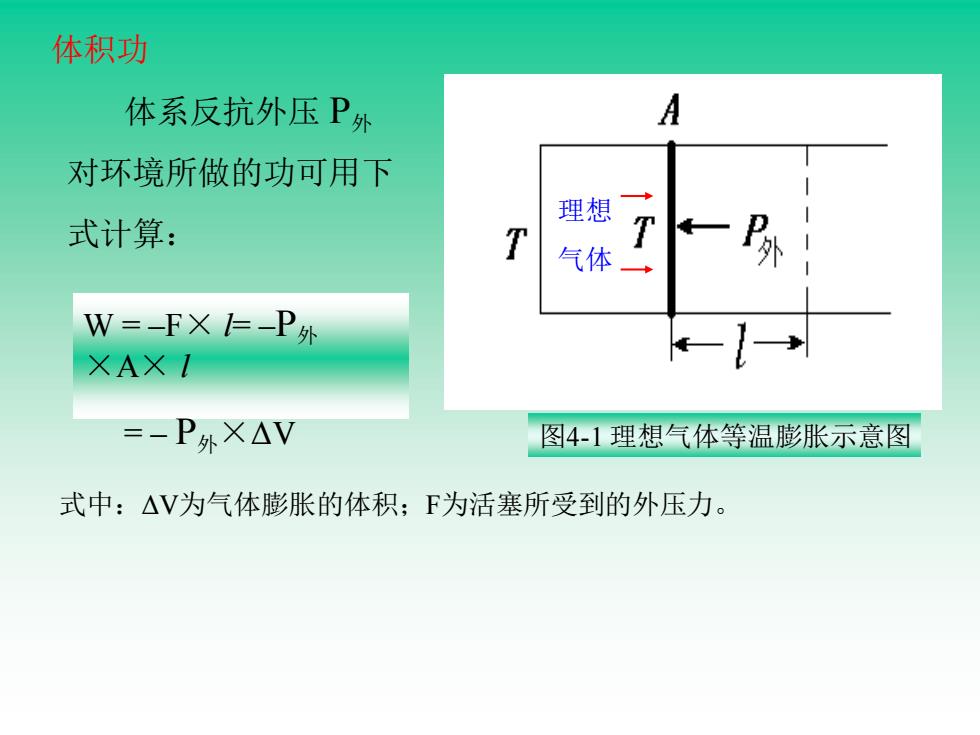
体积功 体系反抗外压P外 A 对环境所做的功可用下 理想 式计算: T 气体 W=-FX=-P外 XAXI =-P外X△V 图4-1理想气体等温膨胀示意图 式中:△V为气体膨胀的体积;F为活塞所受到的外压力
体积功 图4-1 理想气体等温膨胀示意图 理想 气体 体系反抗外压 P外 对环境所做的功可用下 式计算: W = –F× l= –P外 ×A× l = – P外×ΔV 式中:ΔV为气体膨胀的体积;F为活塞所受到的外压力