
第十二章 非金属元素 内容提要: 卤素、氧族元素、氮族元素、碳族元素单质及其重要化合物的 制备、用途和性质的递变规律,单质的氧化还原性和元素离子的 分离与鉴定。 本章要求: 1.熟悉卤素等元素及其重要化合物的基本化学性质、结构、制备 和用途,除了掌握共性外,还要抓住它们之间的差异性。 2熟悉无机含氧酸的性质与结构的关系。 3.熟练运用元素电势图来判断元素及其化合物各氧化态间的转化 关系。 2024/7/25 1
2024/7/25 1 内容提要: 卤素、氧族元素、氮族元素、碳族元素单质及其重要化合物的 制备、用途和性质的递变规律,单质的氧化还原性和元素离子的 分离与鉴定。 本章要求: 1.熟悉卤素等元素及其重要化合物的基本化学性质、结构、制备 和用途,除了掌握共性外,还要抓住它们之间的差异性。 2.熟悉无机含氧酸的性质与结构的关系。 3.熟练运用元素电势图来判断元素及其化合物各氧化态间的转化 关系。 第十二章 非金属元素

第一节 卤素 卤素的通性 二、卤素单质及其化合物 三、卤素的氢化物和氢卤酸 四。卤化物 五卤素的含氧酸及其盐 六拟卤素 七卤素离子的分离与鉴定 八卤素的生物学效应及其药物 九无机含氧酸的性质与结构 2024/7/25 2
2024/7/25 2 一、 卤素的通性 二、 卤素单质及其化合物 三、 卤素的氢化物和氢卤酸 四、 卤化物 五 卤素的含氧酸及其盐 六 拟卤素 七 卤素离子的分离与鉴定 八 卤素的生物学效应及其药物 九 无机含氧酸的性质与结构 第一节 卤素
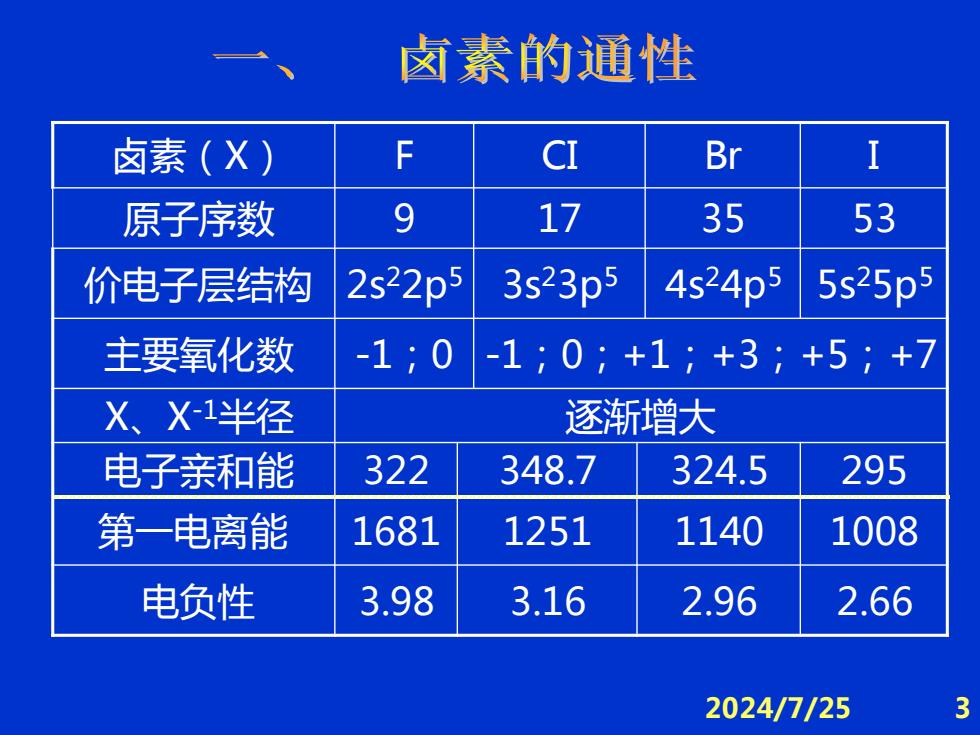
卤素的通性 卤素() F CI Br I 原子序数 9 17 35 53 价电子层结构 2s22p5 3s23p5 4s24p5 5s25p5 主要氧化数 -1;0 -1;0;+1;+3;+5;+7 X、X-1半径 逐渐增大 电子亲和能 322 348.7 324.5 295 第一电离能 1681 1251 1140 1008 电负性 3.98 3.16 2.96 2.66 2024/7/25 3
2024/7/25 3 卤素(X) F CI Br I 原子序数 9 17 35 53 价电子层结构 2s 22p5 3s 23p5 4s 24p5 5s 25p5 主要氧化数 -1;0 -1;0;+1;+3;+5;+7 X、X-1半径 逐渐增大 电子亲和能 322 348.7 324.5 295 第一电离能 1681 1251 1140 1008 电负性 3.98 3.16 2.96 2.66

2卤泰的城熊延 1、X-XCI2非极性共价键(共用电子对) 2、X(-1)NaX离子键 HX 极性共价键 [CuX4]2.配位键 3、F(0,-1);CI、Br、I(-1,0,+1,+3,+5,+7) 卤素含氧化合物HCIO,HCIO3,HCIO, 卤素互化物ICI,F5,IF) }卤素的奥势图 2024/7/25 4
2024/7/25 4 1、X-X CI2 非极性共价键(共用电子对) 2、X(-1) NaX 离子键 HX 极性共价键 [CuX4 ] 2- 配位键 3、F(0,-1);CI、Br、I(-1,0,+1,+3,+5,+7) 卤素含氧化合物 HCIO,HCIO3 ,HCIO4 卤素互化物 ICI ,IF5 ,IF7

自然界的分布 X活泼,自然界无游离单质,主要是稳定的 卤化物。 F:多以难溶物存在.CaF2,Na3AIF6CasF(PO4)3 另外骨骼、牙齿、毛发、鳞、羽毛等中均有F。 主以溶解状态存在于海水中,多为、 Br Na、Mg盐,另也存于一些盐湖、盐井 中。 I:海水中含量少,海带、海藻等水藻类能选择 性吸收和聚集碘。含碘盐:KIO3 2024/7/25 5
2024/7/25 5 X2活泼,自然界无游离单质,主要是稳定的 卤化物。 F:多以难溶物存在.CaF2 ,Na3AIF6 ,Ca5F(PO4 )3 , 另外骨骼、牙齿、毛发、鳞、羽毛等中均有F。 CI: Br: 主以溶解状态存在于海水中,多为Li、 Na、Mg盐,另也存于一些盐湖、盐井 中。 I:海水中含量少,海带、海藻等水藻类能选择 性吸收和聚集碘。含碘盐:KIO3

补:Na+、K+、Mg+是产生咸味的主要阳离 子,阴离子则影响咸味强弱,C为主。 NaCI纯咸味,KCI、MgCI2、MgSO4苦味 依次增强。 二、卤秦单质 1.X2的物理性质 2.X2的化学性质 2024/7/25 6
2024/7/25 6 补:Na+ 、K+ 、Mg2+是产生咸味的主要阳离 子,阴离子则影响咸味强弱,CI为主。 NaCI纯咸味,KCI、MgCI2、MgSO4苦味 依次增强。 1.X2的物理性质 2.X2的化学性质
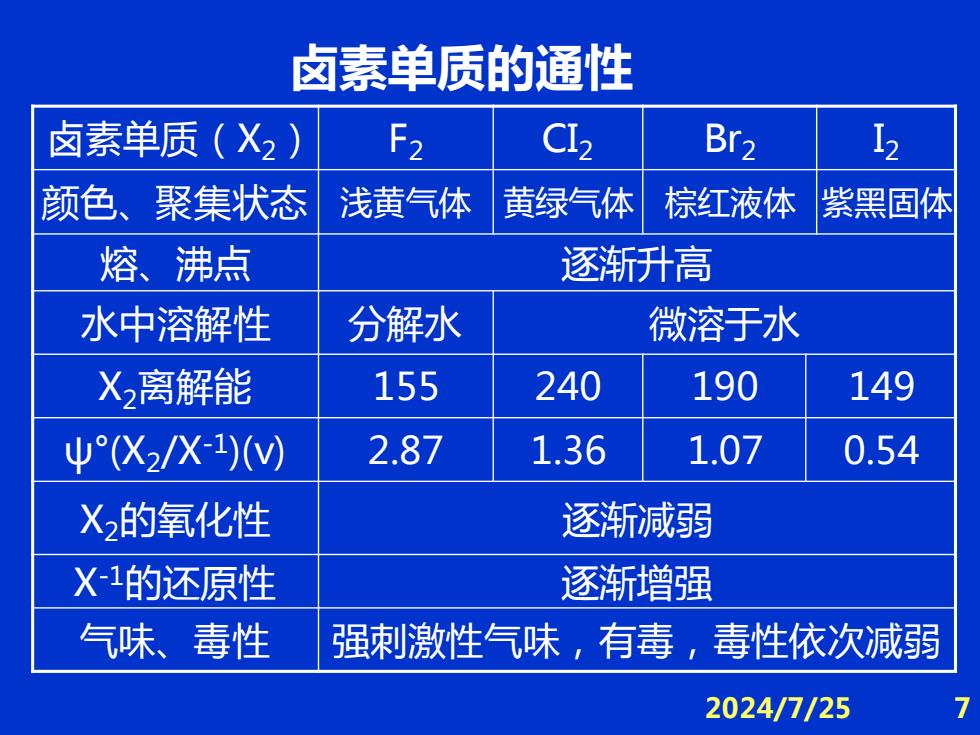
卤素单质的通性 卤素单质(X2) F2 C12 Br2 12 颜色、聚集状态 浅黄气体 黄绿气体 棕红液体 紫黑固体 熔、沸点 逐渐升高 水中溶解性 分解水 微溶于水 X2离解能 155 240 190 149 ψ°(X2/X1)V) 2.87 1.36 1.07 0.54 X2的氧化性 逐渐减弱 X1的还原性 逐渐增强 气味、毒性 强刺激性气味,有毒,毒性依次减弱 2024/7/25
2024/7/25 7 卤素单质(X2) F2 CI2 Br2 I2 颜色、聚集状态 浅黄气体 黄绿气体 棕红液体 紫黑固体 熔、沸点 逐渐升高 水中溶解性 分解水 微溶于水 X2离解能 155 240 190 149 ψ°(X2 /X-1 )(v) 2.87 1.36 1.07 0.54 X2的氧化性 逐渐减弱 X-1的还原性 逐渐增强 气味、毒性 强刺激性气味,有毒,毒性依次减弱 卤素单质的通性
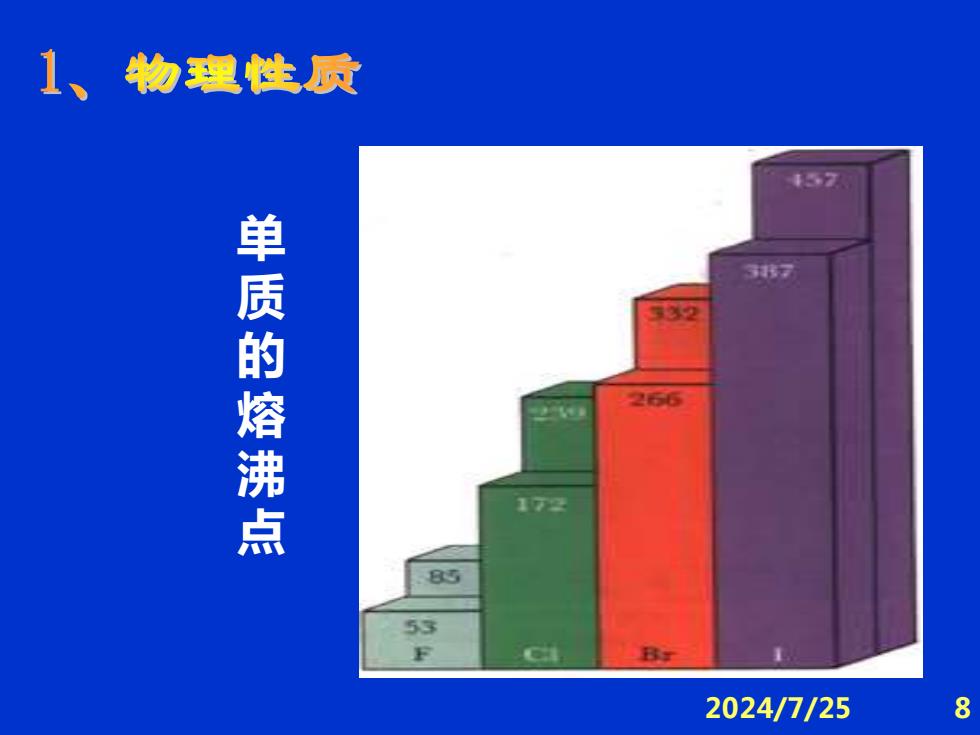
1、物理性质 457 伟万 单质的熔沸点 2 172 B 2024/7/25 8
2024/7/25 8 单质的熔沸点

①物理性质变化规律解释 X,为非极性分子,分子间作用力 熔沸点F2→12依次升高。 聚集态F2(g)→CI(g)→Br2)→I2(s) Br2:非金属中的唯一液体 12:固体易升华,紫黑→粉红 2024/7/25 9
2024/7/25 9 ①物理性质变化规律解释 X2为非极性分子,分子间作用力 ∴熔沸点F2→I2 依次升高。 聚集态F2 (g) →CI(g)→Br2 (l)→I2 (s) Br2:非金属中的唯一液体 I2:固体易升华,紫黑→粉红

当可见光照射到物体上时,物体所显颜色 就是未被吸收光的复合色。 卤素分子轨道能级图 ()2()2()(p)()mp) 卷发→(cs)2(Gs)2(0p)P(p)4(元p)3(G^p) 随卤素原子序数的增加,核对外层电子的 引力依次减弱,激发电子所需能量依次降低。 2024/7/25 10
2024/7/25 10 随卤素原子序数的增加,核对外层电子的 引力依次减弱,激发电子所需能量依次降低。 1 np 3 * np 4 * np 2 np 2 ns 2 * ns np 4 * np 4 * np 2 np 2 ns 2 * ns ) ) ) ( ) ( ) ( ) ) ) ) ( ) ( ) ( ) ( ( ( ( ( ( ⎯激 发 ⎯→ 当可见光照射到物体上时,物体所显颜色 就是未被吸收光的复合色。 卤素分子轨道能级图