
分析化学实验 指导书 (供全日制本科中药学、药学类专业用) 甘肃中医学院《分析化学实验》课程组编 (2004年10月)
分析化学实验 指导书 (供全日制本科中药学、药学类专业用) 甘肃中医学院《分析化学实验》课程组编 (2004 年 10 月)
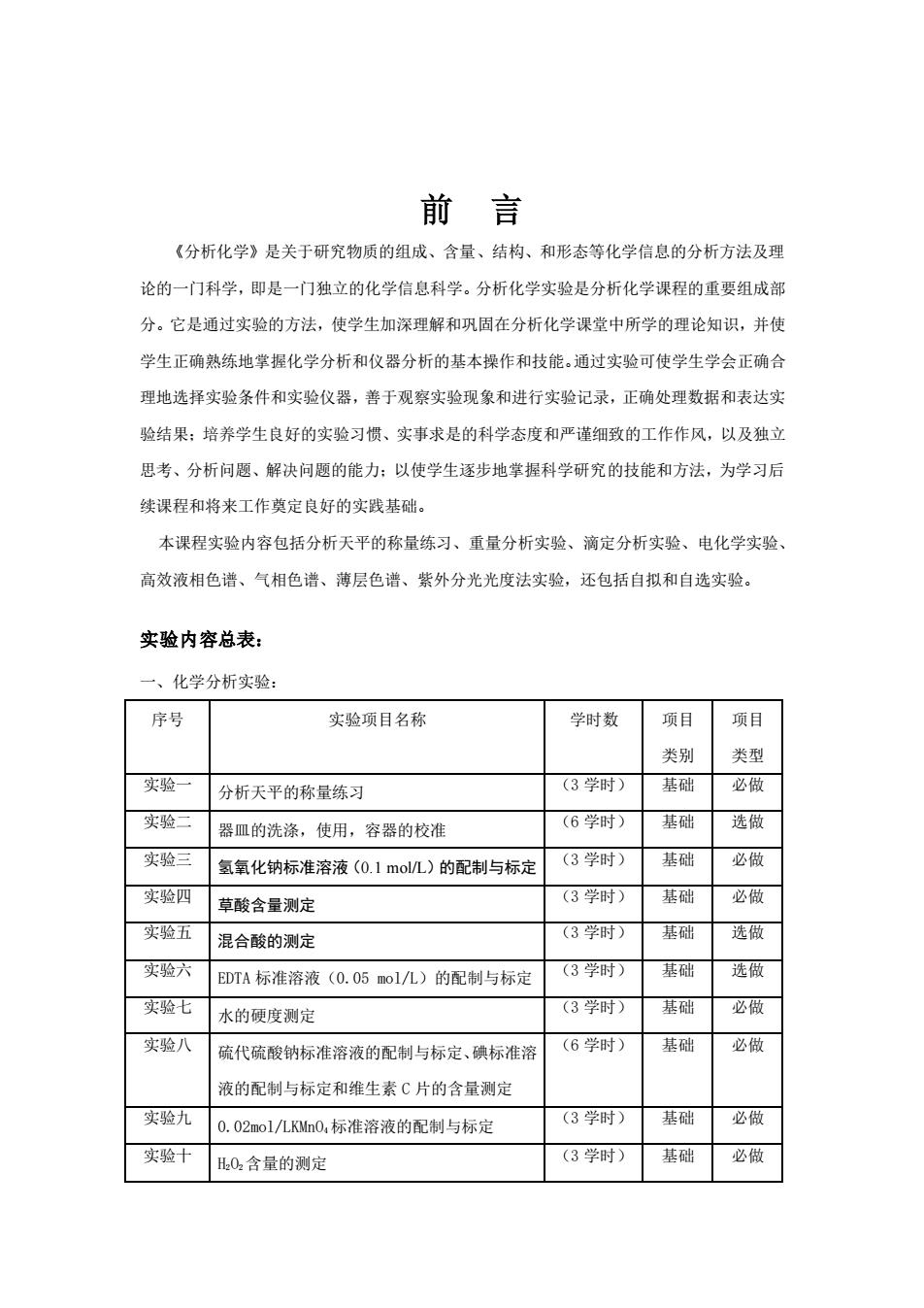
前言 《分析化学》是关于研究物质的组成、含量、结构、和形态等化学信息的分析方法及理 论的一门科学,即是一门独立的化学信息科学。分析化学实验是分析化学课程的重要组成部 分。它是通过实验的方法,使学生加深理解和巩固在分析化学课堂中所学的理论知识,并使 学生正确熟练地掌握化学分析和仪器分析的基本操作和技能。通过实验可使学生学会正确合 理地选择实验条件和实验仪器,善于观察实验现象和进行实验记录,正确处理数据和表达实 验结果:培养学生良好的实验习惯、实事求是的科学态度和严谨细致的工作作风,以及独立 思考、分析问题、解决问题的能力:以使学生逐步地掌握科学研究的技能和方法,为学习后 续课程和将来工作奠定良好的实践基础。 本课程实验内容包括分析天平的称量练习、重量分析实验、滴定分析实验、电化学实验、 高效液相色谱、气相色谱、薄层色谱、紫外分光光度法实验,还包括自拟和自选实验。 实验内容总表: 一、化学分析实验 序号 实验项目名称 学时数 项目 项目 类别 类型 实验一 分析天平的称量练习 (3学时) 基础 必做 实验二 器皿的洗涤,使用,容器的校准 (6学时) 基础 选做 实验三 氢氧化钠标准溶液(0.1moL)的配制与标定 (3学时) 基础 必做 实验四 草酸含量测定 (3学时) 基础 必做 实验五 混合酸的测定 (3学时) 基础 选做 实验六 EDTA标准溶液(0.05mol/L)的配制与标定 (3学时) 基础 选做 实验七 水的硬度测定 (3学时) 基础 必做 实验八 硫代硫酸钠标准溶液的配制与标定、碘标准溶 (6学时) 基础 必做 液的配制与标定和维生素C片的含量测定 实验九 0.02mol/Ln0,标准溶液的配制与标定 (3学时) 基础 必做 实验十 0,含量的测定 (3学时) 基础 必做
前 言 《分析化学》是关于研究物质的组成、含量、结构、和形态等化学信息的分析方法及理 论的一门科学,即是一门独立的化学信息科学。分析化学实验是分析化学课程的重要组成部 分。它是通过实验的方法,使学生加深理解和巩固在分析化学课堂中所学的理论知识,并使 学生正确熟练地掌握化学分析和仪器分析的基本操作和技能。通过实验可使学生学会正确合 理地选择实验条件和实验仪器,善于观察实验现象和进行实验记录,正确处理数据和表达实 验结果;培养学生良好的实验习惯、实事求是的科学态度和严谨细致的工作作风,以及独立 思考、分析问题、解决问题的能力;以使学生逐步地掌握科学研究的技能和方法,为学习后 续课程和将来工作奠定良好的实践基础。 本课程实验内容包括分析天平的称量练习、重量分析实验、滴定分析实验、电化学实验、 高效液相色谱、气相色谱、薄层色谱、紫外分光光度法实验,还包括自拟和自选实验。 实验内容总表: 一、化学分析实验: 序号 实验项目名称 学时数 项目 类别 项目 类型 实验一 分析天平的称量练习 (3 学时) 基础 必做 实验二 器皿的洗涤,使用,容器的校准 (6 学时) 基础 选做 实验三 氢氧化钠标准溶液(0.1 mol/L)的配制与标定 (3 学时) 基础 必做 实验四 草酸含量测定 (3 学时) 基础 必做 实验五 混合酸的测定 (3 学时) 基础 选做 实验六 EDTA 标准溶液(0.05 mol/L)的配制与标定 (3 学时) 基础 选做 实验七 水的硬度测定 (3 学时) 基础 必做 实验八 硫代硫酸钠标准溶液的配制与标定、碘标准溶 液的配制与标定和维生素 C 片的含量测定 (6 学时) 基础 必做 实验九 0.02mol/LKMnO4 标准溶液的配制与标定 (3 学时) 基础 必做 实验十 H2O2 含量的测定 (3 学时) 基础 必做
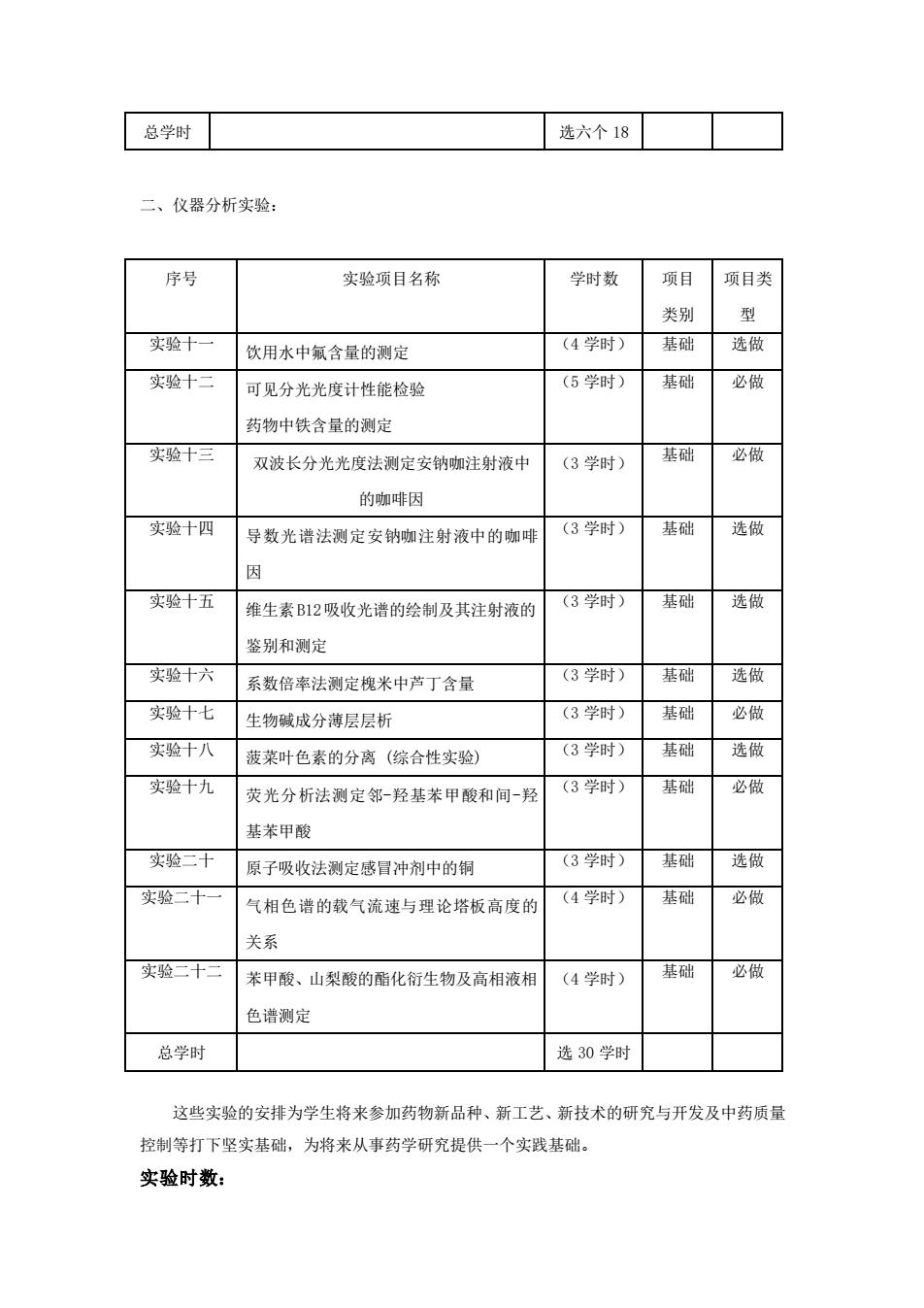
总学时 选六个18 二、仪器分析实验: 序号 实验项目名称 学时数 项目 项目类 类别 型 实验十 饮用水中氟含量的测定 (4学时) 基础 选做 实验十三 可见分光光度计性能检验 (5学时) 基础 必做 药物中铁含量的测定 实验十三 双波长分光光度法测定安钠咖注射液中 (3学时) 基础 必做 的咖啡因 实验十四 导数光谱法测定安钠咖注射液中的咖啡 (3学时) 基础 选做 因 实验十五 维生素B12吸收光谱的绘制及其注射液的 (3学时) 基础 选做 鉴别和测定 实验十六 系数倍率法测定槐米中芦丁含量 (3学时)基础 选做 实验十七 生物碱成分薄层层析 (3学时) 基础 必做 实验十八 菠莱叶色素的分离(综合性实验) (3学时) 基础 选做 实验十九 荧光分析法测定邻-羟基苯甲酸和间-羟 (3学时) 基础 必做 基苯甲酸 实验二十 原子吸收法测定感冒冲剂中的铜 (3学时) 基础 选做 实验二十 气相色谱的载气流速与理论塔板高度的 (4学时) 基础 必做 关系 实验二十 苯甲酸、山梨酸的酯化衍生物及高相液相 (4学时) 基础 必做 色谱测定 总学时 选30学时 这些实验的安排为学生将来参加药物新品种、新工艺、新技术的研究与开发及中药质量 控制等打下坚实基础,为将来从事药学研究提供一个实践基础。 实验时数:
总学时 选六个 18 二、仪器分析实验: 序号 实验项目名称 学时数 项目 类别 项目类 型 实验十一 饮用水中氟含量的测定 (4 学时) 基础 选做 实验十二 可见分光光度计性能检验 药物中铁含量的测定 (5 学时) 基础 必做 实验十三 双波长分光光度法测定安钠咖注射液中 的咖啡因 (3 学时) 基础 必做 实验十四 导数光谱法测定安钠咖注射液中的咖啡 因 (3 学时) 基础 选做 实验十五 维生素B12吸收光谱的绘制及其注射液的 鉴别和测定 (3 学时) 基础 选做 实验十六 系数倍率法测定槐米中芦丁含量 (3 学时) 基础 选做 实验十七 生物碱成分薄层层析 (3 学时) 基础 必做 实验十八 菠菜叶色素的分离 (综合性实验) (3 学时) 基础 选做 实验十九 荧光分析法测定邻-羟基苯甲酸和间-羟 基苯甲酸 (3 学时) 基础 必做 实验二十 原子吸收法测定感冒冲剂中的铜 (3 学时) 基础 选做 实验二十一 气相色谱的载气流速与理论塔板高度的 关系 (4 学时) 基础 必做 实验二十二 苯甲酸、山梨酸的酯化衍生物及高相液相 色谱测定 (4 学时) 基础 必做 总学时 选 30 学时 这些实验的安排为学生将来参加药物新品种、新工艺、新技术的研究与开发及中药质量 控制等打下坚实基础,为将来从事药学研究提供一个实践基础。 实验时数:

按2004年制订的本科专业学分制教学计划要求,规定中药学本科“分析分析实验”的 计划学时数为48学时,可选做实验目录中的16个实验:药物制剂与中草药栽培与鉴定本科 “分析化学实验”的计划学时数为66学时,可选做实验目录中的22个实验。 实验要求: 分析化学实验是一门实践性很强的学科,实验教学最重要的任务是发展学生查阅、动手、 思维、想象和表达能力,重点是培养学生观察问题、分析问题和解决问题的能力,加强学生 对“量”的概念的认识。是在老师指导下所进行的一种特殊形式的科学实践活动,是学生走 向社会独立进行科学实践的预演。通过分析化学实验课的学习,学生应对具体的实验过程首 先应该有一个直观、感性的认识,在此基础上再通过认真、严格、细致的操作练习,在获取 实验数据的过程中培养良好的科学作风和独立从事科学实践的能力。具体要求如下: 1,开设实验课前,由指导老师制定实验教学进度,每个实验提前一周备课,明确实验的 目的、要求和有关注意事项,做好记录。 2.每次实验,指导老师提前10一15分钟进入实验室,检查实验设施,熟悉药品摆放情 祝准备试剂、试样。 3。实验过程中,教师不得擅自离开实验室。注意巡视观察,认真辅导,随时纠正个别 学生不规范的操作。实验结束后,检查学生的数据记录和实验台卫生情况,提醒学生检查水、 电、气、门窗、钥匙柜是否关好。然后告知实验室值班人员,经检查合格后方可允许学生离 开。 4.要求学生课前必须认真预习。理解实验原理,了解实验步骤,探寻影响实验结果的 关键环节,做好必要的预习笔记。未预习者不得进行实验。 5.教师在实验前先检查学生的预习报告,结合当次实验内容中涉及的操作要点进行简 要讲解,然后指导学生做好实验准备工作。 6.学生实验开始后,要求学生仔细观察和详细、忠实记录实验中发生的各种实验现象, 记录的原始数据不能删改(不能用铅笔记)。数据记录在专用的、预先编好页码的实验记录 本上。如有疑问可与同组学生进行现场讨论,也可与指导老师探讨,必要时可重做实验,最 后经指导老师认可,方能结束实验。 7.认真、及时写好实验报告。撰写实验报告是仪器分析实验的重要环节,实验数据的 处理与分析都要在报告中体现出来。报告的内容除了实验名称、实验日期、实验仪器型号、 实验操作条件等常规内容外,还要包括对该实验的总结与讨论,对少数实验异常现象进行解 释分析,老师将批改实验报告并给出报告成绩。 8。所有实验结束后,要以口试、操作技能考核等多种方式进行期末考核,考核结果计 入总成绩。 9.要求学生遵守实验室的各项规章制度。了解“消防设施”和“安全通道”的位置。树 立环境保护意识,尽量降低化学物质(特别是有毒有害试剂以及洗液、洗衣粉等)的消耗
按 2004 年制订的本科专业学分制教学计划要求,规定中药学本科“分析分析实验”的 计划学时数为 48 学时,可选做实验目录中的 16 个实验;药物制剂与中草药栽培与鉴定本科 “分析化学实验”的计划学时数为 66 学时,可选做实验目录中的 22 个实验。 实验要求: 分析化学实验是一门实践性很强的学科,实验教学最重要的任务是发展学生查阅、动手、 思维、想象和表达能力,重点是培养学生观察问题、分析问题和解决问题的能力,加强学生 对“量”的概念的认识。是在老师指导下所进行的一种特殊形式的科学实践活动,是学生走 向社会独立进行科学实践的预演。通过分析化学实验课的学习,学生应对具体的实验过程首 先应该有一个直观、感性的认识,在此基础上再通过认真、严格、细致的操作练习,在获取 实验数据的过程中培养良好的科学作风和独立从事科学实践的能力。具体要求如下: 1.开设实验课前,由指导老师制定实验教学进度,每个实验提前一周备课,明确实验的 目的、要求和有关注意事项,做好记录。 2.每次实验,指导老师提前 10—15 分钟进入实验室,检查实验设施,熟悉药品摆放情 况准备试剂、试样。 3.实验过程中,教师不得擅自离开实验室。注意巡视观察,认真辅导,随时纠正个别 学生不规范的操作。实验结束后,检查学生的数据记录和实验台卫生情况,提醒学生检查水、 电、气、门窗、钥匙柜是否关好。然后告知实验室值班人员,经检查合格后方可允许学生离 开。 4.要求学生 课前必须认真预习。理解实验原理,了解实验步骤,探寻影响实验结果的 关键环节,做好必要的预习笔记。未预习者不得进行实验。 5.教师在实验前先检查学生的预习报告,结合当次实验内容中涉及的操作要点进行简 要讲解,然后指导学生做好实验准备工作。 6.学生实验开始后,要求学生仔细观察和详细、忠实记录实验中发生的各种实验现象, 记录的原始数据不能删改(不能用铅笔记)。数据记录在专用的、预先编好页码的实验记录 本上。如有疑问可与同组学生进行现场讨论,也可与指导老师探讨,必要时可重做实验,最 后经指导老师认可,方能结束实验。 7.认真、及时写好实验报告。撰写实验报告是仪器分析实验的重要环节,实验数据的 处理与分析都要在报告中体现出来。报告的内容除了实验名称、实验日期、实验仪器型号、 实验操作条件等常规内容外,还要包括对该实验的总结与讨论,对少数实验异常现象进行解 释分析,老师将批改实验报告并给出报告成绩。 8.所有实验结束后,要以口试、操作技能考核等多种方式进行期末考核,考核结果计 入总成绩。 9.要求学生遵守实验室的各项规章制度。了解“消防设施”和“安全通道”的位置。树 立环境保护意识,尽量降低化学物质(特别是有毒有害试剂以及洗液、洗衣粉等)的消耗

10.要求学生保持室内安静,保持实验台面清洁整齐。爱护仪器和公共设施,树立良好 的公共道德。 目录 化学分析部分 实验1分析天平与称量 实验2滴定分析器皿及其使用 实验3容量器皿的校准 实验40.10l/八氢氧化钠标准溶液的配制与标定 实验5草酸含量测定 实验6混合酸(碱)测定方法的设计(设计性实验) 实验70.05mol/1DTA标准溶液的配制与标定 实验8水硬度测定 实验9硫代硫酸钠标准溶液的配制与标定、 碘标准溶液的配制与标定和维生素C片的含量测定 实验100.02mol/LKn0,标准溶液的配制与标定 实验11H0,含量的测定 实验12饮用水中氟含量的测定 实验13分光光度计的性能检验 实验14药物中微量铁的测定 实验15吸收曲线的测绘及吸收系数的测定 实验16标准曲线法测定芦丁含量 实验17维生素B12注射液的定性鉴别、定量分析 实验18双波长分光光度法测定安钠咖注射液中咖啡因的含量 实验19导数光谱法测定安钠咖注射液中咖啡因的含量 实验20银黄口服液中黄芩苷和绿原酸的含量测定 实验21原子吸收法测定感冒冲剂中的铜 实验22气相色谱的载气流速与理论塔板高度的关系 实验23气相色谱法测定醇的同系物 实验24苯甲酸、山梨酸的酯化衍生物及高相液相色谱测定 实验25荧光分析法测定邻-羟基苯甲酸和间-羟基苯甲酸
10.要求学生保持室内安静,保持实验台面清洁整齐。爱护仪器和公共设施,树立良好 的公共道德。 目录 化学分析部分 实验 1 分析天平与称量 实验 2 滴定分析器皿及其使用 实验 3 容量器皿的校准 实验 4 0.1mol/L 氢氧化钠标准溶液的配制与标定 实验 5 草酸含量测定 实验 6 混合酸(碱)测定方法的设计 (设计性实验) 实验 7 0.05mol/LEDTA 标准溶液的配制与标定 实验 8 水硬度测定 实验 9 硫代硫酸钠标准溶液的配制与标定、 碘标准溶液的配制与标定和维生素 C 片的含量测定 实验 10 0.02mol/LKMnO4 标准溶液的配制与标定 实验 11 H2O2 含量的测定 实验 12 饮用水中氟含量的测定 实验 13 分光光度计的性能检验 实验 14 药物中微量铁的测定 实验 15 吸收曲线的测绘及吸收系数的测定 实验 16 标准曲线法测定芦丁含量 实验 17 维生素 B12 注射液的定性鉴别、定量分析 实验 18 双波长分光光度法测定安钠咖注射液中咖啡因的含量 实验 19 导数光谱法测定安钠咖注射液中咖啡因的含量 实验 20 银黄口服液中黄芩苷和绿原酸的含量测定 实验 21 原子吸收法测定感冒冲剂中的铜 实验 22 气相色谱的载气流速与理论塔板高度的关系 实验 23 气相色谱法测定醇的同系物 实验 24 苯甲酸、山梨酸的酯化衍生物及高相液相色谱测定 实验 25 荧光分析法测定邻-羟基苯甲酸和间-羟基苯甲酸

实验26柱色谱法测定氧化铝活度 实验27纸色谱法分离氨基酸 实验28薄层色谱法测定甜叶菊苷含量 实验29双波长薄层色谱扫描法测定甲基红含量 实验30菠菜叶色素的分离(综合性实验) 实验31槐花米中芦丁的色谱分离和鉴定(综合性实验) 实验32金银花中绿原酸的TLC鉴别(设计性实验) 附录 实验1 分析天平与称量 一、实验目的 1.了解分析天平的结构,熟悉砝码的组合: 2.学会正确使用天平: 3.掌握直接称量和递减称量法。 二、基本原理 分析天平是定量分析中最重要的仪器之一,每一项定量分析工作都直接或间接地需要 使用天平,常用的分析天平有阻尼天平、半自动电光天平、全自动电光天平、单盘电光天平 和电子天平等。这些天平的构造和使用方法虽有些不同,但基本原理是相同的。 (一)分析天平的原理 各类分析天平都是根据杠杆原理设计制造的。 下图为半自动电光分析天平的结构示意图。 1.天平梁:是天平的主要部件。多用质轻坚固、膨胀系数小的铝铜合金制成,起平衡和 承载物体的作用。梁上装有三个棱形的玛璃刀,其中一个装在正中的称为支点刀,刀口向下: 另外两个与支点刀等距离的分别安装在梁的两端,称为承重刀,刀口向下。三个刀口必须完 全平行且位于同一水平面上。 2.支柱与水平泡:支柱是金属做的中空金属圆柱,下端固定在天平底座中央,支撑着天 平梁。在支柱上装有水平泡,借螺旋垫脚调节天平放置水平。 3.。指针和感量螺丝:指针固定在梁的正中,下端的后面有一块刻有分度的标牌,借以观 察天平梁的倾斜程度。指针上装有感量螺丝,用来调节梁的重心,以改变天平的灵敏度
实验 26 柱色谱法测定氧化铝活度 实验 27 纸色谱法分离氨基酸 实验 28 薄层色谱法测定甜叶菊苷含量 实验 29 双波长薄层色谱扫描法测定甲基红含量 实验 30 菠菜叶色素的分离 (综合性实验) 实验 31 槐花米中芦丁的色谱分离和鉴定(综合性实验) 实验 32 金银花中绿原酸的 TLC 鉴别(设计性实验) 附录 实验 1 分析天平与称量 一、实验目的 1.了解分析天平的结构,熟悉砝码的组合; 2.学会正确使用天平; 3.掌握直接称量和递减称量法。 二、基本原理 分析天平是定量分析中最重要的仪器之一,每一项定量分析工作都直接或间接地需要 使用天平,常用的分析天平有阻尼天平、半自动电光天平、全自动电光天平、单盘电光天平 和电子天平等。这些天平的构造和使用方法虽有些不同,但基本原理是相同的。 (一) 分析天平的原理 各类分析天平都是根据杠杆原理设计制造的。 下图为半自动电光分析天平的结构示意图。 1.天平梁:是天平的主要部件。多用质轻坚固、膨胀系数小的铝铜合金制成,起平衡和 承载物体的作用。梁上装有三个棱形的玛瑙刀,其中一个装在正中的称为支点刀,刀口向下; 另外两个与支点刀等距离的分别安装在梁的两端,称为承重刀,刀口向下。三个刀口必须完 全平行且位于同一水平面上。 2.支柱与水平泡:支柱是金属做的中空金属圆柱,下端固定在天平底座中央,支撑着天 平梁。在支柱上装有水平泡,借螺旋垫脚调节天平放置水平。 3.指针和感量螺丝:指针固定在梁的正中,下端的后面有一块刻有分度的标牌,借以观 察天平梁的倾斜程度。指针上装有感量螺丝,用来调节梁的重心,以改变天平的灵敏度

4.吊耳和称量盘:吊耳挂在两个边刀上,下面挂有称量盘。通常左盘放称量物,右盘放 砝码。 5.空气阻尼器:由两个特制的金属圆筒构成,外筒固定在支柱上,内筒比外筒略小,悬 于吊耳钩下,两筒间隙均匀,没有摩擦。当柔摆动时,左右阻尼器的内筒也随之上下移动, 使筒内外的空气压力一致,使产生抵制膨胀和压缩的力。这样利用筒内空气的阻力使之很快 停摆达到平衡,以加快称量速度。 1一升降旋钮:2一称量盘:3一投影屏:4一空气阻尼器:5一玛聪刀: 6一天平梁:7一平衡螺丝:8一机械加码器:9一指针:10一立柱: 11一金属拉杆 6。平衡螺丝:在梁的上部左右两端各装有一个螺丝,用来调节天平的零点。 7.升降枢: 8.天平箱:起保护天平的作用,在称量时,减少外界温度、空气流动、人的呼吸等的影 响。 9.砝码:每台天平均附有一套砝码。1g以上的砝码用铜合金或不锈钢制成:1g以下的称 为圈码。 (二)天平的灵敏度 天平的灵敏度是指天平盘上增加1照所引起的指针在读数标牌上偏移的格数,灵敏度 (①)的单位为分度/g,在实际工作中,常用灵敏度的倒数来表示天平的灵敏程度,即 5=2g1分虞 $称为天平的分度值,也称为感量。分度值越小的天平,其灵敏度越高。 (三)称量的一般程序和方法 1.取下天平罩,叠好后放在天平箱后面或天平箱顶上。检查天平是否处于水平状态,盘 上有无污垢,用软毛刷拭去灰尘。 2。检查、调整天平的零点:接通电源,慢慢开启天平,在不载重的情况下,检查投影屏
4.吊耳和称量盘:吊耳挂在两个边刀上,下面挂有称量盘。通常左盘放称量物,右盘放 砝码。 5.空气阻尼器:由两个特制的金属圆筒构成,外筒固定在支柱上,内筒比外筒略小,悬 于吊耳钩下,两筒间隙均匀,没有摩擦。当梁摆动时,左右阻尼器的内筒也随之上下移动, 使筒内外的空气压力一致,便产生抵制膨胀和压缩的力。这样利用筒内空气的阻力使之很快 停摆达到平衡,以加快称量速度。 1—升降旋钮; 2—称量盘; 3—投影屏; 4—空气阻尼器; 5—玛瑙刀; 6—天平梁 ;7—平衡螺丝; 8—机械加码器; 9—指针; 10—立柱; 11—金属拉杆; 6.平衡螺丝:在梁的上部左右两端各装有一个螺丝,用来调节天平的零点。 7.升降枢: 8.天平箱:起保护天平的作用,在称量时,减少外界温度、空气流动、人的呼吸等的影 响。 9.砝码:每台天平均附有一套砝码。1g 以上的砝码用铜合金或不锈钢制成;1g 以下的称 为圈码。 (二) 天平的灵敏度 天平的灵敏度是指天平盘上增加 1mg 所引起的指针在读数标牌上偏移的格数,灵敏度 (E)的单位为分度/mg,在实际工作中,常用灵敏度的倒数来表示天平的灵敏程度,即 (mg /分度) E S 1 = S 称为天平的分度值,也称为感量。分度值越小的天平,其灵敏度越高。 (三) 称量的一般程序和方法 1.取下天平罩,叠好后放在天平箱后面或天平箱顶上。检查天平是否处于水平状态,盘 上有无污垢,用软毛刷拭去灰尘。 2.检查、调整天平的零点:接通电源,慢慢开启天平,在不载重的情况下,检查投影屏

上的标尺的位置,若零点与投影屏上的标线不重合,可拨动升降旋钮下的扳手,排动投影屏 的位置,使其重合;若相差较大,可借平衡螺丝调整使其重合,即为天平的零点。 3.在台秤上粗称被称量物的质量。 4。将被称量物放入称量盘并关好侧门,在砝码盘上放置粗称得到的相应质量的砝码,开 启天平,试称。根据砝码与称量物的质量关系,按照“由大到小,减半加入”的原则增减砝 码,直至天平平衡。 (四)称量方法 1.周定质量称量法 要求试样本身不吸水并在空气中性质稳定。 先称量容器(如表面皿)的质量,并记录平衡点。再称试样,如指定称取0.3000g时,在 砝码盘上增加0.3000g砝码,在称量盘上加入略少于0.3g的试样,然后用药匙轻轻振动, 使试样慢慢落入容器中,直至平衡点与称量容器时的平衡点刚好一致。 这种方法的优点是称量计算简便,结果计算方便。 2。递减称量法这种方法称出的样品的质量不要求周定的数值,只需在一定范围内即 可。适应于易吸水、易氧化或易与C反应的物质。将此类物质盛在带盖的称量瓶中进行称 量,既可以防止吸潮,又便于称量操作。 先在称量瓶中装入适量的试样(如果试样曾经烘干,应放在干燥器内冷却到室温),用洁 净的小纸条套在称量瓶上,先在台秤上粗称其质量,再将称量瓶放在分析天平上精确称出其 质量,设为m,8。将称量瓶取出,用称量瓶盖轻轻敲瓶的上部,使试样慢慢落在容器内, 然后慢慢将瓶竖起,用瓶盖敲瓶口上部,使粘在瓶口的试样落回瓶中,盖好瓶盖。再将称量 瓶放回天平盘上称量,如此重复操作,直到倾出的试样质量达到要求为止。设倒出第一份试 样后称量瓶与试样的质量为m28,则第一份试样的质量为(m,一m)8。 同上操作,逐次称量,即可称出多份样品。例如:
上的标尺的位置,若零点与投影屏上的标线不重合,可拨动升降旋钮下的扳手,挪动投影屏 的位置,使其重合;若相差较大,可借平衡螺丝调整使其重合,即为天平的零点。 3.在台秤上粗称被称量物的质量。 4.将被称量物放入称量盘并关好侧门,在砝码盘上放置粗称得到的相应质量的砝码,开 启天平,试称。根据砝码与称量物的质量关系,按照“由大到小,减半加入”的原则增减砝 码,直至天平平衡。 (四) 称量方法 1.固定质量称量法 要求试样本身不吸水并在空气中性质稳定。 先称量容器(如表面皿)的质量,并记录平衡点。再称试样,如指定称取 0.3000g 时,在 砝码盘上增加 0.3000g 砝码,在称量盘上加入略少于 0.3g 的试样,然后用药匙轻轻振动, 使试样慢慢落入容器中,直至平衡点与称量容器时的平衡点刚好一致。 这种方法的优点是称量计算简便,结果计算方便。 2.递减称量法 这种方法称出的样品的质量不要求固定的数值,只需在一定范围内即 可。适应于易吸水、易氧化或易与 CO2 反应的物质。将此类物质盛在带盖的称量瓶中进行称 量,既可以防止吸潮,又便于称量操作。 先在称量瓶中装入适量的试样(如果试样曾经烘干,应放在干燥器内冷却到室温),用洁 净的小纸条套在称量瓶上,先在台秤上粗称其质量,再将称量瓶放在分析天平上精确称出其 质量,设为 m1 g 。将称量瓶取出,用称量瓶盖轻轻敲瓶的上部,使试样慢慢落在容器内, 然后慢慢将瓶竖起,用瓶盖敲瓶口上部,使粘在瓶口的试样落回瓶中,盖好瓶盖。再将称量 瓶放回天平盘上称量,如此重复操作,直到倾出的试样质量达到要求为止。设倒出第一份试 样后称量瓶与试样的质量为 m2 g ,则第一份试样的质量为 (m1 −m2 )g 。 同上操作,逐次称量,即可称出多份样品。例如:

称量瓶十样品(① 21.2350g 0.2222g 称量瓶+样品(2) 21.0128g 02212g 称量瓶十样品(3) 20.7916g 称量瓶+样品(4) )0.2215g 20.5701g T 三、仪器、试剂及其他 (一)仪器 分析天平 称量瓶 小烧杯(50mL) ()试剂 氯化钠 四、实验内容 采用递减称量法称取两份氯化钠试样。每份0.20.3g。 五、注意事项 1.旋转升降柄时必须缓慢,轻开轻关。取放物体、增减砝码时,必须关闭天平,以免损 坏,玛瑙刀口。 2.称量时,应关好两个侧门。化学试剂和试样不能直接放在天平盘上称量,而应放在干 净的称量瓶或坩锅内:具有腐蚀性的气体或吸湿性物质,必须放在称量瓶内或其它适当的密 闭的容器内称量:称量的物体必须与天平箱内温度一致,不得把热的或冷的物体放进天平箱 内称量。 3.绝不能使天平载重超过最大负载。为了减小称量误差,在作同一实验时,应使用同 台天平和配套的砝码,并注意相同面值的两个砝码的区别,确定其中一个是优先使用的。 4.天平的各部件尽可能不要用手接触,如必须接触时(调节调平螺丝),必须将手指擦干 净,最好是带手套或手指套。 5.称量的数据应及时写在笔记本上,不得记录在纸片上。 6.称量完毕,取出物体,检查天平内外清洁,关好天平门,将指数盘拨回零位,切断电 源,最后,罩上天平罩
称量瓶+样品(1) 21.2350g 称量瓶+样品(3) 称量瓶+样品(2) 称量瓶+样品(4) 21.0128g 20.7916g 20.5701g 0.2222g 0.2212g 0.2215g 三、仪器、试剂及其他 (一) 仪 器 分析天平 称量瓶 小烧杯(50mL) (二) 试 剂 氯化钠 四、实验内容 采用递减称量法称取两份氯化钠试样。每份 0.2~0.3g。 五、注意事项 1.旋转升降柄时必须缓慢,轻开轻关。取放物体、增减砝码时,必须关闭天平,以免损 坏,玛瑙刀口。 2.称量时,应关好两个侧门。化学试剂和试样不能直接放在天平盘上称量,而应放在干 净的称量瓶或坩锅内;具有腐蚀性的气体或吸湿性物质,必须放在称量瓶内或其它适当的密 闭的容器内称量;称量的物体必须与天平箱内温度一致,不得把热的或冷的物体放进天平箱 内称量。 3.绝不能使天平载重超过最大负载。为了减小称量误差,在作同一实验时,应使用同一 台天平和配套的砝码,并注意相同面值的两个砝码的区别,确定其中一个是优先使用的。 4.天平的各部件尽可能不要用手接触,如必须接触时(调节调平螺丝),必须将手指擦干 净,最好是带手套或手指套。 5.称量的数据应及时写在笔记本上,不得记录在纸片上。 6.称量完毕,取出物体,检查天平内外清洁,关好天平门,将指数盘拨回零位,切断电 源,最后,罩上天平罩

大、思考题 1,为什么不允许在开启天平的状态下增减砝码或取放称量物? 2.什么是天平的零点和停点? 实验2滴定分析器皿及其使用 一.预习。学习如何为酸式滴定管的旋塞涂抹凡士林和试漏:学习如何为碱式滴定管排 气泡和试漏。学习如何用所配的溶液润洗滴定管和移液管,如何调零和读数。 二.实验目的要求 1.滴定操作是容量分析的重要基本功之一。要求掌握临近终点时,加入半滴滴定剂即 可使指示剂改变颜色,到达终点。 2.逐个检查学生的预习报告和迟到情况。 三。本次实验的内容: 1.总结上一次实验的情况(包括纪律、卫生等)。再次强调天平的操作规程和操作中出 现的问题。 2.介绍化学试剂级别和中英文缩写名。 3。提问式演示讲解滴定分析操作的下列环节: (1)配制0.1nol/LNa0H和0.1mol/LHC1溶液。 告诚:永远是将相对较浓的NaO阳和HCI溶液倒入水中,尤其不能将水倒入酸中!NaOI和HC1 溶液稀释后一定要摇匀:试剂瓶磨口处不能沾有浓溶液! (2)演示如何用所配的溶液倒入、润洗滴定管和移液管的方法(不允许学生通过烧杯二 次转移倒入):如何调零和读数(要读淮0.01l的方法)。每次润洗滴定管的溶液体积应在 10ml左右。 (3)滴定姿势要站正。 (4)左手五个手指掌握酸式滴定管、碱式滴定管的方法, (5)摇瓶操作和边滴边摇操作。 (6)酸、碱管气泡排除的方法。 (7)滴定速度的控制和“见滴成线”的滴定方法。 (8)半滴的控制和吹洗的方法。 (9)终点颜色变化的观察,主要对甲基橙的“红一橙一黄”颜色要很清楚的能够区别。 (10)交待用移液管移取溶液的操作,润洗移液管的溶液,每次为3L左右。移液管取放 溶液时,注意尖部紧贴盛放溶液的器皿壁,且呈一定角度。溶液放完后,等候15秒方可取
六、思 考 题 1.为什么不允许在开启天平的状态下增减砝码或取放称量物? 2.什么是天平的零点和停点? 实验 2 滴定分析器皿及其使用 一.预习。学习如何为酸式滴定管的旋塞涂抹凡士林和试漏;学习如何为碱式滴定管排 气泡和试漏。学习如何用所配的溶液润洗滴定管和移液管,如何调零和读数。 二.实验目的要求 1.滴定操作是容量分析的重要基本功之一。要求掌握临近终点时,加入半滴滴定剂即 可使指示剂改变颜色,到达终点。 2.逐个检查学生的预习报告和迟到情况。 三.本次实验的内容: 1.总结上一次实验的情况(包括纪律、卫生等)。再次强调天平的操作规程和操作中出 现的问题。 2.介绍化学试剂级别和中英文缩写名。 3.提问式演示讲解滴定分析操作的下列环节: (1)配制 0.1mol/L NaOH 和 0.1mol/L HCl 溶液。 告诫:永远是将相对较浓的NaOH和 HCl溶液倒入水中,尤其不能将水倒入酸中!NaOH和 HCl 溶液稀释后一定要摇匀;试剂瓶磨口处不能沾有浓溶液! (2)演示如何用所配的溶液倒入、润洗滴定管和移液管的方法(不允许学生通过烧杯二 次转移倒入);如何调零和读数(要读准 0。01ml 的方法)。每次润洗滴定管的溶液体积应在 10mL 左右。 (3)滴定姿势要站正。 (4)左手五个手指掌握酸式滴定管、碱式滴定管的方法。 (5)摇瓶操作和边滴边摇操作。 (6)酸、碱管气泡排除的方法。 (7)滴定速度的控制和“见滴成线”的滴定方法。 (8)半滴的控制和吹洗的方法。 (9)终点颜色变化的观察,主要对甲基橙的“红—橙—黄” 颜色要很清楚的能够区别。 (10)交待用移液管移取溶液的操作,润洗移液管的溶液,每次为 3mL 左右。移液管取放 溶液时,注意尖部紧贴盛放溶液的器皿壁,且呈一定角度。溶液放完后,等候 15 秒方可取