
6化唑乙极技布士技能榜定學布科摩考秘登) 第⑦题 維他命C含量之测定 一、試題規範 (一)操作時間:三小時三十分 (二)操作說明:碘酸根離子和過量之碘離子於酸性下反應,可生成 碘,利用其與維他命C之氧化還原反應,可用以定量維他命C· (三)操作步驃 1.碘溶液之配製: ()精秤約0.1g乾燥之KIO3·放入150mL燒杯中·並加入約 2gKI· (2)以50mL去離子水及1mL濃鹽酸將其完全溶解·並定量至 250mL· 2.維他命C之定量:
302 維他命 C 含量之測定 一、試題規範 (一) 操作時間:三小時三十分 (二) 操作說明:碘酸根離子和過量之碘離子於酸性下反應,可生成 碘,利用其與維他命 C 之氧化還原反應,可用以定量維他命 C。 (三) 操作步驟: 1. 碘溶液之配製: (1) 精秤約 0.1 g 乾燥之 KIO3,放入 150 mL 燒杯中,並加入約 2 g KI。 (2) 以 50 mL 去離子水及 1 mL 濃鹽酸將其完全溶解,並定量至 250 mL。 2. 維他命 C 之定量:

第四篇街科第7题的 (1)精秤維他命C約0.3g以去離子水溶解·並定量至100mL· (2)取上述溶液25mL·加入1mL3%偏磷酸溶液,再加入1m 0.5%澱粉溶液· (3)用碘溶液滴定至終點·再重覆滴定二次·求維他命C之平 均值。 二·器具及材料 名 格 数量 蜜敏度0.01g 2天平 敏度0.0001g 1台 3桂杯 150mL 3 4.形瓶 250mL 3個 5量筒 50mL·A级 個 6滴定管 50mL·鐵氟龍活栓·A級 1支 7.滴定管架 1台 8刻度吸量管 25m1,A级 1古
303 (1) 精秤維他命 C 約 0.3 g,以去離子水溶解,並定量至 100 mL。 (2) 取上述溶液 25 mL,加入 1 mL 3%偏磷酸溶液,再加入 1mL 0.5%澱粉溶液。 (3) 用碘溶液滴定至終點,再重覆滴定二次,求維他命 C 之平 均值。 二、器具及材料 名 稱 規 格 數 量 1.天平 靈敏度 0.01g 1 台 2.天平 靈敏度 0.0001g 1 台 3.燒杯 150 mL 3 個 4.錐形瓶 250 mL 3 個 5.量筒 50 mL,A 級 1 個 6.滴定管 50 mL,鐵氟龍活栓,A 級 1 支 7.滴定管架 1 台 8.刻度吸量管 25 mL,A 級 1 支

€购化學乙极技布士技能檐定學術科座考秘整) 9球形吸量管 25mL·A級 1支 10.刻度吸量管 2mL·A极 3古 1山.吸量管架 1個 12.安全吸球 1個 13.量瓶 100mL·A级 1個 14.量瓶 250mL·A級 】支 15洗瓶 500mL 16玻棒 5 mmx15 cm 2支 17.藥匙 1支 1情杯别 19.稱量瓶 3個 20.漏斗 1支 21碘酸 GR级 0.5g 22.碘化钾 EP毅 2.0g 23鹭粉溶液 0.5% 5 mL 24.偏磷酸溶液 3.0% 5 mL 25.题酸 EP級 5 mL 26.維他命C試樣 5g 27玻璃器皿洗滌用清潔劑 20 mL 28洁潔陶 约20g 29.蒸餾水或去能子水 21 30.面紙 滴最 三、分析原理 碘酸鉀中之碘酸根離子(O3·)與碘化鉀之碘離子(I··過量) 在酸性(濃鹽酸)下反應可生成碘分子(上)(如此配製而成之溶液 稱為碘溶液)·而碘分子則會與維他命C反應後還原為碘離子,因
304 9.球形吸量管 25 mL,A 級 1 支 10.刻度吸量管 2 mL,A 級 3 支 11.吸量管架 1 個 12.安全吸球 1 個 13.量瓶 100 mL,A 級 1 個 14.量瓶 250 mL,A 級 1 支 15.洗瓶 500 mL 1 個 16.玻棒 5 mm×15 cm 2 支 17.藥匙 1 支 18.燒杯刷 1 支 19.稱量瓶 3 個 20.漏斗 1 支 21.碘酸鉀 GR 級 0.5 g 22.碘化鉀 EP 級 2.0 g 23.澱粉溶液 0.5% 5 mL 24.偏磷酸溶液 3.0% 5 mL 25.濃鹽酸 EP 級 5 mL 26.維他命 C 試樣 5 g 27.玻璃器皿洗滌用清潔劑 20 mL 28.清潔劑 約 20 g 29.蒸餾水或去離子水 2 L 30.面紙 適量 三、分析原理 碘酸鉀中之碘酸根離子(IO3 -)與碘化鉀之碘離子(I -,過量) 在酸性(濃鹽酸)下反應可生成碘分子(I2)(如此配製而成之溶液 稱為碘溶液)。而碘分子則會與維他命 C 反應後還原為碘離子,因

第四篇術科第7€0 此可以用碘溶液當做標定液·並用澱粉當做指示劑來测定維他命C 的含量·當碘溶液剛開始滴入到維他命C溶液中時·因為維他命C 將碘溶液中的碘分子還原為碘離子·所以溶液雖會有藍色出現但 很快會消失·而直到滴定終點·當維他命C已耗盡·則碘分子與澱 粉液產生藍色且維持30秒不褪色·由此滴定結果可進一步計算求出 溶液中維他命C的含量·其反應方程式如下: I03+5I+6H→32+3H0 C6HsO6+2→C6H6O6+2上+2H (維他命C) (去氫維他命C) 由以上反應方程式知一莫耳碘酸钾反應之後可產生三莫耳的碘
305 此可以用碘溶液當做標定液,並用澱粉當做指示劑來測定維他命 C 的含量。當碘溶液剛開始滴入到維他命 C 溶液中時,因為維他命 C 將碘溶液中的碘分子還原為碘離子,所以溶液雖會有藍色出現但 很快會消失,而直到滴定終點,當維他命 C 已耗盡,則碘分子與澱 粉液產生藍色且維持 30 秒不褪色。由此滴定結果可進一步計算求出 溶液中維他命 C 的含量。其反應方程式如下: IO3 - + 5 I- + 6H+ → 3 I2 + 3 H2O C6H8O6 + I2 → C6H6O6 + 2 I- + 2H+ (維他命 C) (去氫維他命 C) 由以上反應方程式知一莫耳碘酸鉀反應之後可產生三莫耳的碘

606化型乙极技士技能榜定學布科摩考秘览○ 分子,而一莫耳碘分子則恰可與一莫耳之維他命C反應·其計量方 程式如下 碘酸鉀种取量 碘酸鉀濃度(〔IO,·〕)= 碘酸钾分子量 250 1000 碘分子濃度(〔12〕)=碘酸鉀濃度×3 维他命C量阅=碘分子清度×商定升数×维他命C分子量×罗 1000 维他命C纯度=锥他命C量(克 稚他命稀取量 ×100% 四、操作指 碘酸根雕子和過量之碘雕子於酸性下反應,可生成碘,利用其 與维他命C之氧化還原反應,可用以定量维他命C· (一)碘溶液之配製 1.精秤約0.1g乾燥之KIO,·放入150mL燒杯中·並加入約2g KI. 2.以50mL去離子水及1mL濃鹽酸將其完全溶解·並定量至250
306 分子,而一莫耳碘分子則恰可與一莫耳之維他命 C 反應。其計量方 程式如下: 碘酸鉀濃度(〔IO3 -〕)= 1000 250 碘酸鉀分子量 碘酸鉀秤取量 碘分子濃度(〔I 2〕)=碘酸鉀濃度×3 維他命 C 量(克)=碘分子濃度× 1000 滴定亳升數 ×維他命 C 分子量× 25 100 維他命 C 純度= 維他命稱取量 維他命C 量(克) ×100% 四、操作指引 碘酸根離子和過量之碘離子於酸性下反應,可生成碘,利用其 與維他命 C 之氧化還原反應,可用以定量維他命 C。 (一) 碘溶液之配製 1. 精秤約 0.1 g 乾燥之 KIO3,放入 150 mL 燒杯中,並加入約 2g KI。 2. 以 50 mL 去離子水及 1mL 濃鹽酸將其完全溶解,並定量至 250

第四篇街科第60 mL 精秤約0.1g乾燥之KIO: 放入150mL烧杯内 再加入約2gK 加50mL去離子水及1mL濃鹽酸, 将溶解之溶液倒入250mL量瓶中 用水潤洗燒杯數次·並將洗液併入量 瓶中(注意水勿過量) 将量酒加水稀釋至刻度線·並倒置震盪均匀 (二)維他命C之定量 1.精秤維他命C約0.3g·以去雕子水溶解·並定量至100mL 精秤約0.3g之维他命C 放入150mL燒杯内·加水並攪拌將之溶解 將溶解之溶液倒入100mL量瓶中
307 mL。 精秤約 0.1 g 乾燥之 KIO3 放入 150 mL 燒杯內 再加入約 2 g KI 加 50 mL 去離子水及 1mL 濃鹽酸, 並攪拌將之溶解 將溶解之溶液倒入 250 mL 量瓶中 用水潤洗燒杯數次,並將洗液併入量 瓶中(注意水勿過量) 將量瓶加水稀釋至刻度線,並倒置震盪均勻 (二) 維他命 C 之定量 1. 精秤維他命 C 約 0.3g,以去離子水溶解,並定量至 100 mL。 精秤約 0.3g 之維他命 C 放入 150 mL 燒杯內,加水並攪拌將之溶解 將溶解之溶液倒入 100 mL 量瓶中
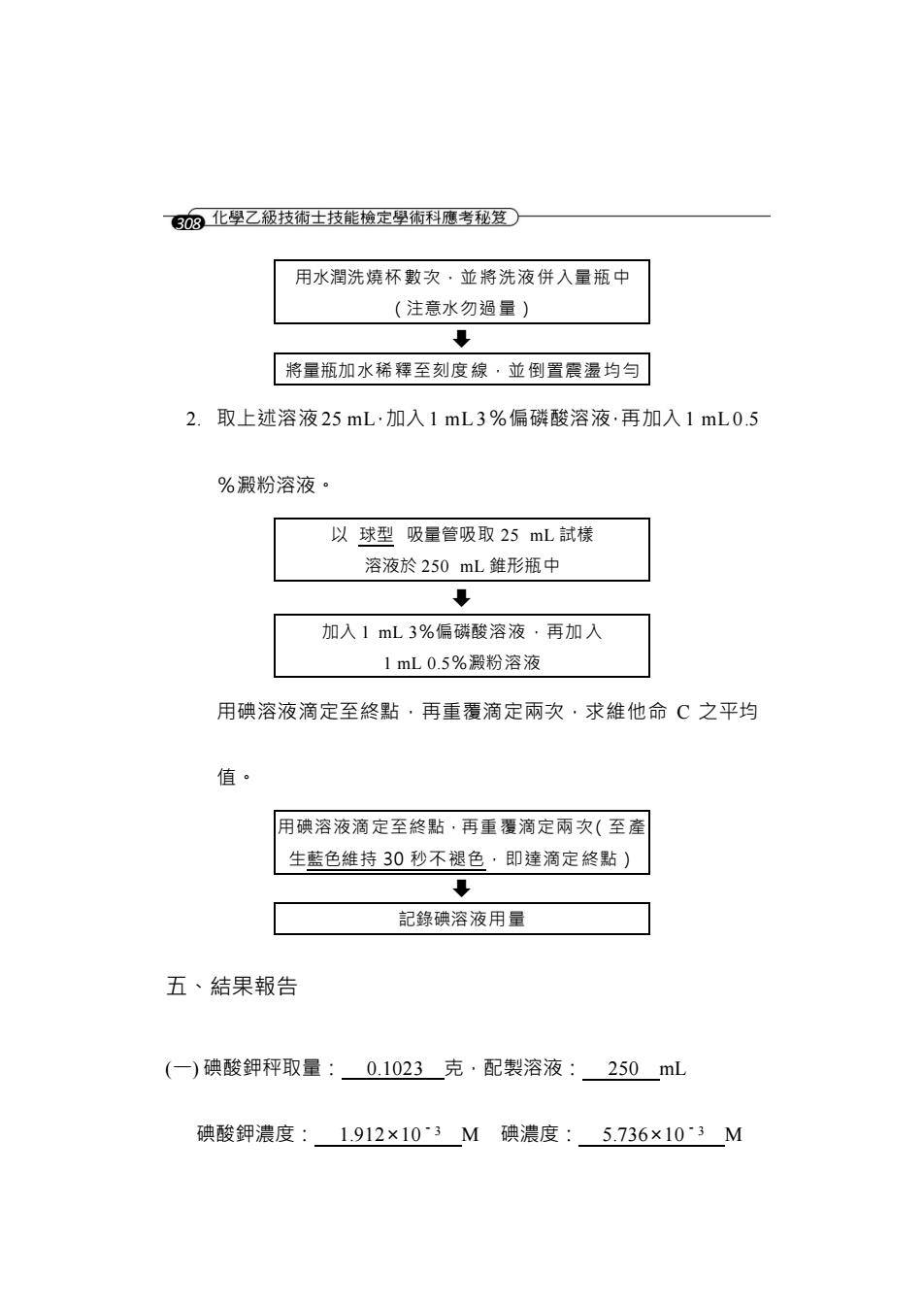
6⑧化唑乙极技布士技能榜定學布科摩考秘登○ 用水潤洗燒杯數次·並將洗液併入量瓶中 (注意水勿逅量) ↓ 将量瓶加水稀釋至刻度線·並倒置震盪均勻 2.取上述溶液25mL·加入1mL3%偏磷酸溶液·再加入1mL0.5 %澱粉溶液。 以球型吸量管吸取25mL試樣 溶液於250mL雏形瓶中 加入1mL3%偏磷酸溶液·再加入 1mL0.5%澱粉溶液 用碘溶液滴定至終點·再重覆滴定雨次·求維他命C之平均 值。 用碘溶液滴定至終粘·再重覆滴定雨次(至產 生藍色維持30秒不褪色·即達滴定终點) 。 記錄碘溶液用量 五、結果報告 (一)碘酸鉀秤取量:0.1023克·配製溶液:250mL 碘酸鉀濃度:1.912×103M碘濃度:5.736×103M
308 用水潤洗燒杯數次,並將洗液併入量瓶中 (注意水勿過量) 將量瓶加水稀釋至刻度線,並倒置震盪均勻 2. 取上述溶液 25 mL,加入 1 mL 3%偏磷酸溶液,再加入 1 mL 0.5 %澱粉溶液。 以 球型 吸量管吸取 25 mL 試樣 溶液於 250 mL 錐形瓶中 加入 1 mL 3%偏磷酸溶液,再加入 1 mL 0.5%澱粉溶液 用碘溶液滴定至終點,再重覆滴定兩次,求維他命 C 之平均 值。 用碘溶液滴定至終點,再重覆滴定兩次(至產 生藍色維持 30 秒不褪色,即達滴定終點) 記錄碘溶液用量 五、結果報告 (一) 碘酸鉀秤取量: 0.1023 克,配製溶液: 250 mL 碘酸鉀濃度: 1.912×10-3 M 碘濃度: 5.736×10-3 M

第四篇布科【第7题69 寫出計算式10+5I+6H→3h+3H0 0.1023 碘酸鉀濃度([IO,〕)= 214 -=1.912×103 250 1000 碘分子濃度([12])=碘酸鉀濃度×3=1.912×103×3 =5.736×103 (二)將滴定及計算結果填入下表:(編號: 維他命C秤取量:0.3036克 配製溶液:100mL 溶液取量 滴定用量 維他命C量 純度 平均值 mL mL g % % 35 28.85 0.11650 38.37 25 28.90 0.1167038.44 38.39 25 28.85 0.11650 38.37 依第一次滴定結果寫出計算式 CoHsO6+I2 C6H606+2I+2H* 维他合C量(克)=5736×10×288x176×19=01650g 維他命C純度=011650×100%=38.37% 0.3036
309 寫出計算式 IO3 -+5 I-+6H+ → 3 I2+3 H2O 碘酸鉀濃度(〔IO3 -〕)= 1000 250 214 0.1023 =1.912×10-3 碘分子濃度(〔I 2〕)=碘酸鉀濃度×3=1.912×10-3×3 =5.736×10-3 (二) 將滴定及計算結果填入下表:(編號: ) 維他命 C 秤取量: 0.3036 克 配製溶液: 100 mL 溶液取量 mL 滴定用量 mL 維他命 C 量 g 純度 % 平均值 % 25 28.85 0.11650 38.37 25 28.90 0.11670 38.44 38.39 25 28.85 0.11650 38.37 依第一次滴定結果寫出計算式 C6H8O6+I2 → C6H6O6+2 I-+2H+ 維他命 C 量(克)=5.736×10-3× 1000 28.85 ×176× 25 100=0.11650 g 維他命 C 純度= 0.3036 0.11650 ×100%=38.37%

610化唑乙极技佈士技能榜定學術科瘗考秘览) (三)計算三次結果之標準偏差 平均值=3837%+384%+3837%=3839% SD=1 (38.37%-38.39%)2+(38.449%-38.39%)2+(38.37%-37.399%)2 3-1 =0.04% (註:用計算機程式求取之操作程序請參考第二篇數據處理部份) 六、報告練習 維他命C含量之測定 (一)碘酸鉀秤取量: 克 配製溶液: 碘酸鉀濃度: M 碘濃度: M 寫出計算式 (二)將滴定及計算結果填入下表:(編號:
310 (三) 計算三次結果之標準偏差 平均值= 3 38.37%+38.44%+38.37% =38.39% SD= 3 1 (3 8.3 7 3 8.3 9 ) (3 8.4 4 3 8.3 9 ) (3 8.3 7 3 7.3 9%) 2 2 2 − %− % + %− % + %− =0.04% (註:用計算機程式求取之操作程序請參考第二篇數據處理部份) 六、報告練習 維他命 C 含量之測定 (一) 碘酸鉀秤取量: 克 配製溶液: mL 碘酸鉀濃度: M 碘濃度: M 寫出計算式 (二) 將滴定及計算結果填入下表:(編號: )

第四篇術科第7频6 維他命C秤取量 配製溶液 溶液取量 滴定用量 維他命C量 純度 平均值 mL mL g % % 依第一次滴定結果寫出計算式 (三)計算三次結果之標準偏差
311 維他命 C 秤取量: 配製溶液: mL 溶液取量 mL 滴定用量 mL 維他命 C 量 g 純度 % 平均值 % 依第一次滴定結果寫出計算式 (三) 計算三次結果之標準偏差