
引言 基础知识 实验学 习方法 2. 实验报告书写格式 3.实验数据处理及误差分析方法: 4实验室注意事项: 5试剂、药品、气休想格及分类 基本操作: 常用仪器的使用方法 2.混合物质分离方法: 3.物质提纯方法: 4.物质干燥方法: 董丽花 基本原理实验 1.醋酸电离度及电离平衡常数的测定: 2.化学反应速率及活化能的测定: 3.沉淀溶解平衡(原教材问题很多) 4缓冲溶液的配置及性质(原数材需要修改】 5.分光光度法测定铁含量 6.配位化合物(原教材问题很多 赵 福岐 7,分光光度法测定THO分裂能 8水溶液中氯离子含量的测定: 9.BaC2·2H,0中钡含量的测定 1O,EDTA标准溶液的配置 、标定及水的总硬度测定 11.高锰酸钾法测定过氧化氢的含量: 崔建华 基本操作实险 1,粗食盐的提纯与检验: 硝酸钾的制备与提纯 3.溶液的配置 4.酸碱标准溶液的配置与标定: 5.密度的测定: 6.摩尔气体常数的测定: 李宝庆 元素化合物性质实验 1.S区元素: 2.P区元素 肉族: 氧族 氨族 碳族: 3.d区元素 4.ds区元素 孙立平
引言 基础知识: 1. 实验学习方法; 2. 实验报告书写格式; 3. 实验数据处理及误差分析方法; 4. 实验室注意事项; 5 试剂、药品、气体规格及分类 基本操作: 1. 常用仪器的使用方法; 2. 混合物质分离方法; 3. 物质提纯方法; 4. 物质干燥方法; 董丽花 基本原理实验: 1. 醋酸电离度及电离平衡常数的测定; 2. 化学反应速率及活化能的测定; 3. 沉淀溶解平衡(原教材问题很多) 4. 缓冲溶液的配置及性质(原教材需要修改) 5. 分光光度法测定铁含量 6. 配位化合物 (原教材问题很多) 赵 福岐 7. 分光光度法测定[Ti(H2O)6] 3+分裂能 8. 水溶液中氯离子含量的测定; 9. BaCl2·2 H2O 中钡含量的测定、 10. EDTA 标准溶液的配置、标定及水的总硬度测定 11. 高锰酸钾法测定过氧化氢的含量; 崔建华 基本操作实验 1. 粗食盐的提纯与检验; 2. 硝酸钾的制备与提纯; 3. 溶液的配置 4. 酸碱标准溶液的配置与标定; 5. 密度的测定; 6. 摩尔气体常数的测定; 李宝庆 元素化合物性质实验 1. S 区元素; 2. P 区元素 卤族; 氧族; 氮族; 碳族; 3. d 区元素; 4. ds 区元素; 孙立平

综合性实验 以Fe为原料制备感光液 2.胃舒平中药片中镁和铝含量的测定 3.维生素C含量的测定(微型实验): 4.漂白粉中有效氯含量的测定: 5.混合碱含量的测定 陈红余 设计性实验 三草酸合铁酸钾的组成分析: 2.鸡蛋壳中钙镁含量的测定: 3.混合离子的分离及鉴定: 4.纳米TO的制备与表征: 5.植物体中某些元素含量的测定 孙红 实验基本格式 实验名称(小三黑体、居中) 一、实验目的(四号宋体) 1.(四号宋体)针对实验过程写目的 2.要针对实验试剂, 归纳总结实验核心知识和技能:单倍行距 二、实验原理 1方程式用公式编辑器编辑。一律配平,中间用箭头:(四号宋体) 2.尽量条理化,归纳出核心原理: 三、仪器、试剂及材料 仪器:烧杯(500mL,250mL,100mL)吸量管(10.00mL,5.00mL 试剂:浓度H2SO(1.0moL方碳酸钠(s,AR)等(四号宋体) 分类给出,要注意仪器要有规格,和实验室己有的对应。玻璃器皿的名称规格要清楚,溶液、 试剂的纯度,浓度标识要规范。浓度的有效数字(小数点后至少1位)。 四、步骤 1.注意标点符号一律用全角。表名,图名要规范,(小四宋体) 2.单位和数据之间空一格(半角)(四号宋体) 3.注意过程中量具的读数,语言的规范。 五、思考题 2.(四号宋体) 3 以Fe为原料制备感光液 一、实验目的 1.学习利用盐类在不同温度下溶解度的差别来制备物质的原理和方 法:
综合性实验 1. 以 Fe 为原料制备感光液; 2. 胃舒平中药片中镁和铝含量的测定; 3. 维生素 C 含量的测定(微型实验); 4. 漂白粉中有效氯含量的测定; 5. 混合碱含量的测定; 陈红余 设计性实验 1. 三草酸合铁酸钾的组成分析; 2. 鸡蛋壳中钙镁含量的测定; 3. 混合离子的分离及鉴定; 4. 纳米 TiO2 的制备与表征; 5. 植物体中某些元素含量的测定 孙红 实验基本格式 实验名称(小三黑体、居中) 一、实验目的 (四号宋体) 1. (四号宋体)针对实验过程写目的 2. 要针对实验试剂,归纳总结实验核心知识和技能;单倍行距; 二、实验原理 1. 方程式用公式编辑器编辑。一律配平,中间用箭头;(四号宋体) 2. 尽量条理化,归纳出核心原理; 三、仪器、试剂及材料 仪器:烧杯(500 mL, 250 mL, 100 mL) 吸量管(10.00 mL, 5.00mL) 试剂:浓度 H2SO4(1.0mol·L-1 ); 碳酸钠(s, AR)等(四号宋体) 分类给出,要注意仪器要有规格,和实验室已有的对应。玻璃器皿的名称规格要清楚,溶液、 试剂的纯度,浓度标识要规范。浓度的有效数字(小数点后至少 1 位)。 四、步骤 1. 注意标点符号一律用全角。表名,图名要规范,(小四宋体) 2. 单位和数据之间空一格(半角)(四号宋体) 3. 注意过程中量具的读数,语言的规范。 五、思考题 1. 2. (四号宋体) 3. 以Fe为原料制备感光液 一、实验目的 1. 学习利用盐类在不同温度下溶解度的差别来制备物质的原理和方 法;

2.掌握合成NH)2Fe(S0426H0、KFe(C2O4)33H2O的基本原理和 操作技术: 3.加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解: 4.巩固水浴加热、冷却、结晶、重结晶、洗涤、干燥等基本操作。 二、实验原理 1.NH4)hFe(SO426HzO的制备 以铁屑或铁粉为原料,溶于稀硫酸制得硫酸亚铁溶液,然后加入 硫酸铵制得饱和溶液,经加热浓缩、冷却至室温后可得溶解度较小的 硫酸亚铁铵复盐晶体。 Fe+H,sSO,→FeSO,+H2t FeSO+(NH)2SO.+6HO→(NH)hFe(SO,)2·6HO 2.KFe[CzO4)3]3HO的合成 以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉 淀,然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化 剂,得到铁(Ⅲ)草酸配合物。主要反应为 (NH,2Fe(SOh+H,CO,+2H,O→FeCO·2H,O↓+(NH)2SO,+H2SO, 2FeC,0,·2H,0+H,0,+3K,C,0+H,C,0→2K[FC,0,)]3H,0 改变溶剂极性并加少量盐析剂,可析出绿色单斜晶体纯的三草酸合铁 (Ⅲ)酸钾. 3.复盐硫酸亚铁铵FSO4NH)2SO46H2O]又称摩尔盐,是浅蓝绿色 的单斜晶体。它在空气中比一般亚铁盐稳定,不易被氧化,溶于水但 不溶于乙醇。硫酸铵、硫酸亚铁铵和硫酸亚铁在不同温度下的溶解度
2. 掌握合成(NH4)2Fe(SO4)2·6H2O、K3Fe[(C2O4)3]·3H2O的基本原理和 操作技术; 3. 加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解; 4. 巩固水浴加热、冷却、结晶、重结晶、洗涤、干燥等基本操作。 二、实验原理 1. (NH4)2Fe(SO4)2·6H2O的制备 以铁屑或铁粉为原料,溶于稀硫酸制得硫酸亚铁溶液,然后加入 硫酸铵制得饱和溶液,经加热浓缩、冷却至室温后可得溶解度较小的 硫酸亚铁铵复盐晶体。 Fe + H2SO4 → FeSO4 + H2 FeSO4 + (NH4 ) 2 SO4 + 6H2O →(NH4 ) 2Fe(SO4 ) 2 •6H2O 2. K3Fe[(C2O4)3]·3H2O的合成 以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉 淀,然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化 剂,得到铁(Ⅲ)草酸配合物。主要反应为 4 2 4 2 2 2 4 2 2 4 2 4 2 4 2 4 (NH ) Fe(SO ) + H C O + 2H O → FeC O • 2H O +(NH ) SO + H SO 2FeC2O4 • 2H2O + H2O2 + 3K2C2O4 + H2C2O4 → 2K3 [Fe(C2O4 ) 3 ]•3H2O 改变溶剂极性并加少量盐析剂,可析出绿色单斜晶体纯的三草酸合铁 (Ⅲ)酸钾. 3. 复盐硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]又称摩尔盐,是浅蓝绿色 的单斜晶体。它在空气中比一般亚铁盐稳定,不易被氧化,溶于水但 不溶于乙醇。硫酸铵、硫酸亚铁铵和硫酸亚铁在不同温度下的溶解度
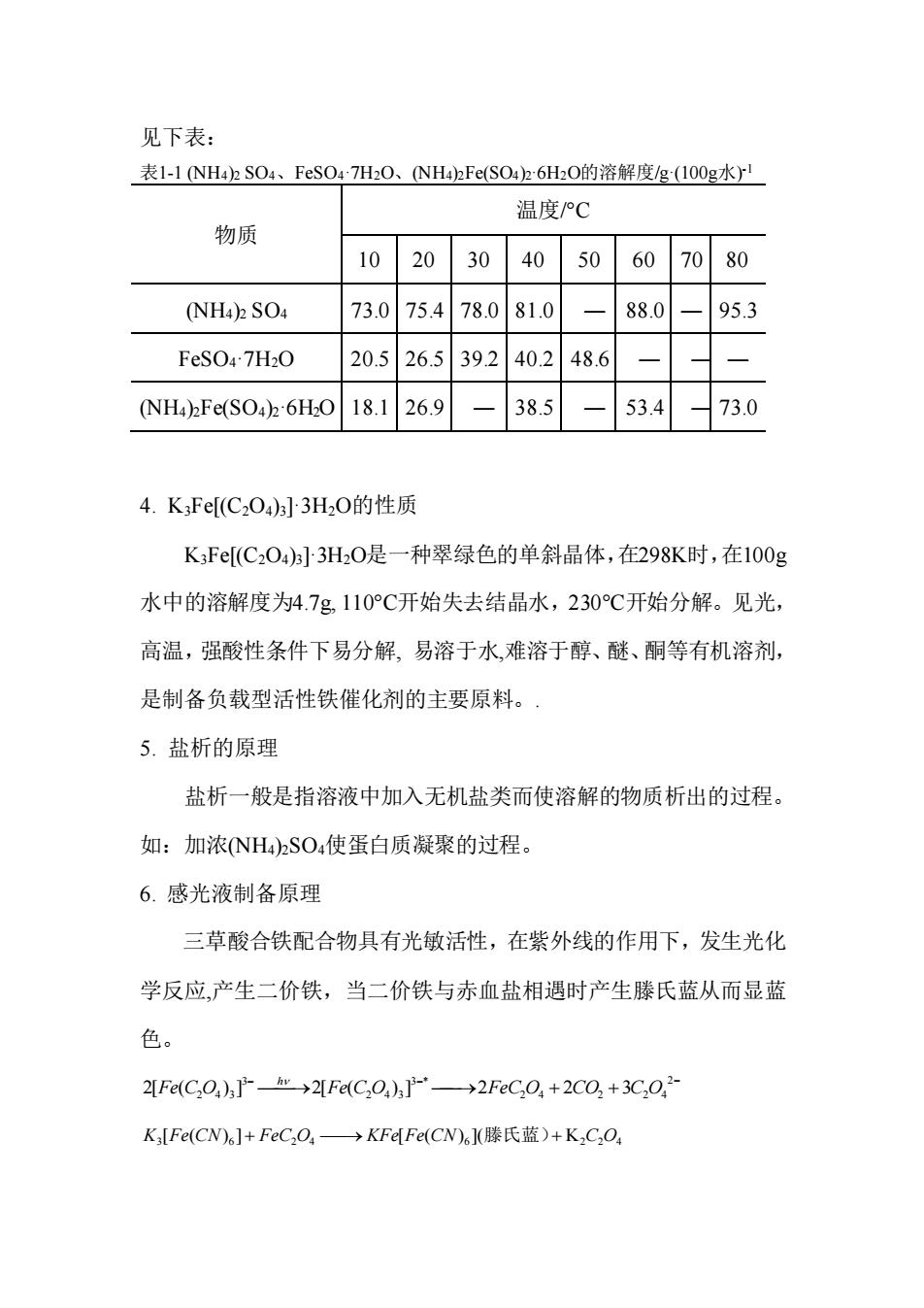
见下表: 表1-1NH42SO4、FeSO47HO、NH42Fe(SO42:6HO的溶解度g(100g水I 温度C 物质 102030 40 50 60 7080 (NH4)2 SO4 73.075.478.081.0 880 95.3 20.526.539240.248.6 NHa)Fe(S04h6H018.126.9-38.5 -53.4 73.0 4.KFe[(C2O)]3HO的性质 KF[(C2O4)3]3H2O是一种翠绿色的单斜晶体,在298K时,在100g 水中的溶解度为4.7g110°℃开始失去结晶水,230℃开始分解。见光, 高温,强酸性条件下易分解,易溶于水,难溶于醇、醚、酮等有机溶剂, 是制备负载型活性铁催化剂的主要原料。 5.盐析的原理 盐析一般是指溶液中加入无机盐类而使溶解的物质析出的过程。 如:加浓NH4)2SO4使蛋白质凝聚的过程。 6.感光液制备原理 三草酸合铁配合物具有光敏活性,在紫外线的作用下,发生光化 学反应,产生二价铁,当二价铁与赤血盐相遇时产生滕氏蓝从而显蓝 色。 2FeC,0,)]Pr→2FeC,0)h]-→2FeC,0,+2C0,+3C,0, K,Fe(CN)6]+FeC,O,→KFeFe(CN6lJ(滕氏蓝)+K,C,O
见下表: 表1-1 (NH4)2 SO4、FeSO4·7H2O、(NH4)2Fe(SO4)2·6H2O的溶解度/g·(100g水) -1 物质 温度/°C 10 20 30 40 50 60 70 80 (NH4)2 SO4 73.0 75.4 78.0 81.0 ― 88.0 ― 95.3 FeSO4·7H2O 20.5 26.5 39.2 40.2 48.6 ― ― ― (NH4)2Fe(SO4)2·6H2O 18.1 26.9 ― 38.5 ― 53.4 ― 73.0 4. K3Fe[(C2O4)3]·3H2O的性质 K3Fe[(C2O4)3]·3H2O是一种翠绿色的单斜晶体,在298K时,在100g 水中的溶解度为4.7g, 110°C开始失去结晶水,230°C开始分解。见光, 高温,强酸性条件下易分解, 易溶于水,难溶于醇、醚、酮等有机溶剂, 是制备负载型活性铁催化剂的主要原料。. 5. 盐析的原理 盐析一般是指溶液中加入无机盐类而使溶解的物质析出的过程。 如:加浓(NH4)2SO4使蛋白质凝聚的过程。 6. 感光液制备原理 三草酸合铁配合物具有光敏活性,在紫外线的作用下,发生光化 学反应,产生二价铁,当二价铁与赤血盐相遇时产生滕氏蓝从而显蓝 色。 − − − ⎯⎯→ ⎯→ + + 2 2 4 2 2 4 3 * 2 4 3 3 2[Fe(C2O4 ) 3 ] 2[Fe(C O ) ] 2FeC O 2CO 3C O h 3 6 2 4 6 K2 2 4 K [Fe(CN) ]+ FeC O ⎯→ KFe[Fe(CN) ](滕氏蓝)+ C O

三、实验仪器与试剂 仪器:托盘天平,抽滤装置(水泵,布氏漏斗,吸滤瓶),烧杯(500mL, 250mL,100mL),水浴锅,表面皿,煤油温度计(0-100℃) 试剂:NHa)2Fe(S04h6H,0,HS0(1.0molL),HCO4(饱和), K2C04(饱和),KNO(300.0gL),乙醇(95%),KFe(CN)6J(5%) 每实验室准备一瓶),HO2(3%)。 四、实验步骤 1.硫酸亚铁铵的制备 称取3.0g铁粉,放在锥形瓶中,加入20.0mL3.0 mol-L H2S04置于 水浴中加热反应,反应装置应靠近通风口(为什么会产生臭鸡蛋气 味?)。反应过程中,适当补充被蒸发掉的水分(尽可能维持原有液 面刻度水平,加热不要过猛,控制反应温度在70-80°℃),当反应基 本完全时,趁热过滤。滤液转移至小烧杯或蒸发皿中。观察滤纸上残 渣的颜色、状态。烘干称量。 根据差量法大致估算反应掉的铁粉量,量取配置好的饱和硫酸铵 溶液在蒸发皿中搅拌均匀后水浴浓缩。蒸发浓缩值液面出现晶膜为止 (浓缩开始时可适当搅拌,后期不宜搅拌)。取出蒸发皿静置,冷却 后减压抽滤。用少量的乙醇洗涤晶体两次。取出干燥称量。 2.草酸亚铁的制备 称取5.0g硫酸亚铁铵固体放在250mL烧杯中,然后加15.0mL蒸馏水 和5~6滴1.0moLH2S04,加热溶解后,再加入25.0mL饱和草酸溶 液,加热搅拌至沸,然后迅速搅拌片刻,防止飞溅。停止加热,静置
三、实验仪器与试剂 仪器: 托盘天平,抽滤装置(水泵,布氏漏斗,吸滤瓶),烧杯(500 mL, 250 mL, 100 mL),水浴锅,表面皿, 煤油温度计(0-100℃) 试剂: (NH4)2Fe(SO4)2·6H2O,H2SO4(1.0 mol·L-1 ),H2C2O4(饱和), K2C2O4(饱和),KNO3(300.0g·L-1 ),乙醇(95%),K3[Fe(CN)6] (5%) 每实验室准备一瓶),H2O2 (3%)。 四、实验步骤 1.硫酸亚铁铵的制备 称取3.0 g铁粉,放在锥形瓶中,加入20.0 mL 3.0 mol·L-1 H2SO4,置于 水浴中加热反应,反应装置应靠近通风口(为什么会产生臭鸡蛋气 味?)。反应过程中,适当补充被蒸发掉的水分(尽可能维持原有液 面刻度水平,加热不要过猛,控制反应温度在70-80°C),当反应基 本完全时,趁热过滤。滤液转移至小烧杯或蒸发皿中。观察滤纸上残 渣的颜色、状态。烘干称量。 根据差量法大致估算反应掉的铁粉量,量取配置好的饱和硫酸铵 溶液在蒸发皿中搅拌均匀后水浴浓缩。蒸发浓缩值液面出现晶膜为止 (浓缩开始时可适当搅拌,后期不宜搅拌)。取出蒸发皿静置,冷却 后减压抽滤。用少量的乙醇洗涤晶体两次。取出干燥称量。 2. 草酸亚铁的制备 称取5.0 g硫酸亚铁铵固体放在250 mL烧杯中,然后加15.0 mL蒸馏水 和5~6滴1.0 mol·L-1 H2SO4,加热溶解后,再加入25.0 mL饱和草酸溶 液,加热搅拌至沸,然后迅速搅拌片刻,防止飞溅。停止加热,静置

待黄色晶体FC2042H0沉淀后倾析,弃去上层清液,加入20mL蒸 馏水洗涤晶体,搅拌并温热,静置,弃去上层清液,即得黄色晶体草 酸亚铁。 3.三草酸合铁(Ⅲ)酸钾的制备 往草酸亚铁沉淀中,加入饱和KC2O4溶液10.0mL,水浴加热313.0K, 恒温下慢慢滴加3%的H,O2溶液20.0mL,沉淀转为深棕色。边加边搅 拌,加完后将溶液加热至沸,然后趁热逐滴加入20.0mL饱和草酸溶 液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯 中,加入95%的乙醇25.0mL,混匀后冷却,可以看到烧杯底部有晶 体析出。为了加快结晶速度,可往其中滴加几滴KNO3溶液。晶体完 全析出后,抽滤,用乙醇10.0mL分多次淋洒滤饼,抽干混合液。固 体产品置于一表面皿上,置暗处晾干。称重,计算产率。 4.感光液的制备 将0.5g三草酸合铁(Ⅲ)酸钾溶于5ml蒸馏水中,滴加5滴 K4F(CN6](5%),搅拌均匀后,玻璃棒蘸取溶液在纸面上写字,在 日光下观察。 五、实验思考 1.能否直接用三价铁制备三草酸合铁(IⅢ)酸钾,如FeC1等? 2.为什么在滴加HO2过程中需要控制温度? 3.滴加KNO3溶液起到什么作用? 4.最后能否在析晶之前适当浓缩溶液? 5.什么叫复盐?它与配合物有何区别?
待黄色晶体FeC2O4·2H2O沉淀后倾析,弃去上层清液,加入20 mL蒸 馏水洗涤晶体,搅拌并温热,静置,弃去上层清液,即得黄色晶体草 酸亚铁。 3. 三草酸合铁(Ⅲ)酸钾的制备 往草酸亚铁沉淀中,加入饱和K2C2O4溶液10.0 mL,水浴加热313.0K, 恒温下慢慢滴加3%的H2O2溶液20.0 mL,沉淀转为深棕色。边加边搅 拌,加完后将溶液加热至沸,然后趁热逐滴加入20.0 mL饱和草酸溶 液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100 mL烧杯 中,加入95%的乙醇25.0 mL,混匀后冷却,可以看到烧杯底部有晶 体析出。为了加快结晶速度,可往其中滴加几滴KNO3溶液。晶体完 全析出后,抽滤,用乙醇10.0 mL分多次淋洒滤饼,抽干混合液。固 体产品置于一表面皿上,置暗处晾干。称重,计算产率。 4. 感光液的制备 将0.5g 三草酸合铁(Ⅲ)酸钾溶于5 ml蒸馏水中,滴加5滴 K4[Fe(CN)6] (5%),搅拌均匀后,玻璃棒蘸取溶液在纸面上写字,在 日光下观察。 五、实验思考 1. 能否直接用三价铁制备三草酸合铁(Ⅲ)酸钾,如FeCl3等? 2. 为什么在滴加H2O2 过程中需要控制温度? 3. 滴加KNO3溶液起到什么作用? 4. 最后能否在析晶之前适当浓缩溶液? 5. 什么叫复盐?它与配合物有何区别?

实验中为什么保持硫酸亚铁、硫酸亚铁铵溶液呈较强的酸性?
实验中为什么保持硫酸亚铁、硫酸亚铁铵溶液呈较强的酸性?