
实验粗食盐的提纯与检验 一、实验目的 1.学习提纯氯化钠的原理和Ca、Mg”、S0产鉴定方法。 2.掌握过滤、转移、蒸发浓缩和减压过滤的基本操作。 3.掌握Ca2、Mg、S0,离子定性鉴定的简单方法。 二、实验原理 粗食盐中含有泥沙等不溶性杂质和Ca”、Mg、K、I、Br、SO,等构成的卤化 物、硫酸盐可溶性杂质。不溶性杂质可通过过滤除去:可溶性杂质可采用化学 法,即加人某些化学试剂,使之转化为沉淀后滤。可溶性杂质可采用化学法, 即加人某些化学试剂,使之转化为沉淀后滤除。具体方法如下: 1.将粗食盐溶于水,向其中加入稍过量的BaCl2溶液,使溶液中的S0,转化为 BaS0,沉淀,过滤除去BaSO,和其他不溶性的杂质。 Ba2++S0,2→BaS0,↓(白色) 2.在滤液中依次加人适量的NaOH和Na,CO,溶液,使溶液中的Ca”、Mg"以及过 量的B阳转化为沉淀,过滤,除去沉淀。 g2++20H→8(OH)2↓(伯色) Ca2+C0,2→CaC0↓(白色) Ba2++CO,2→BCO↓(白色) 3.在滤液中加人适量盐酸,中和溶液中过量的0H·和C0,使溶液呈微酸 性。 H*+OH-→H,O
实验 粗食盐的提纯与检验 一、 实验目的 1. 学习提纯氯化钠的原理和 Ca2+、Mg2+、SO4 2-鉴定方法。 2. 掌握过滤、转移、蒸发浓缩和减压过滤的基本操作. 3. 掌握 Ca2+、Mg2+、SO4 2-离子定性鉴定的简单方法。 二、实验原理 粗食盐中含有泥沙等不溶性杂质和 Ca2+、Mg2+、Κ +、I -、Br-、SO4 2-等构成的卤化 物、硫酸盐可溶性杂质。不溶性杂质可通过过滤除去;可溶性杂质可采用化学 法,即加人某些化学试剂,使之转化为沉淀后滤。可溶性杂质可采用化学法, 即加人某些化学试剂,使之转化为沉淀后滤除。具体方法如下: 1. 将粗食盐溶于水,向其中加入稍过量的 BaCl2溶液,使溶液中的 SO4 2-转化为 BaSO4沉淀,过滤除去 BaSO4和其他不溶性的杂质。 4 2 4 2 Ba + SO → BaSO + − ↓(白色) 2.在滤液中依次加人适量的 NaOH 和 Na2CO3溶液,使溶液中的 Ca2+、Mg2+以及过 量的 Ba2+转化为沉淀,过滤,除去沉淀。 2 2 Mg + 2OH → Mg(OH) + − ↓(白色) 3 2 3 2 Ca +CO →CaCO + − ↓(白色) 3 2 3 2 Ba +CO → BaCO + − ↓(白色) 3. 在滤液中加人适量盐酸,中和溶液中过量的 0Hˉ 和 CO3 2ˉ,使溶液呈微酸 性。 H + OH → H2O + −

2H+C0,→H,0+CO2↑ 4.少量KBr、KI等可溶性杂质因含量少溶解度较大,在N阳cl结晶过程申仍留在 母液中而被除掉。少量多余的盐酸,在干燥NaCI时,会以HCl的形式逸出。 三、实验仪器与试剂 仪器:托盘天平,蒸发皿(125mm),烧杯(100m)2个,量筒(15mL),普通漏斗, 水循环真空泵, 布氏漏斗,吸滤瓶,试管6支,酒精灯,试管架,漏斗架。 试剂:粗食盐,1.0mol·LBaC1,Na0H-NaC0,(2.0mol·LNa0H溶液与 饱和NaC0溶液等体积混合)溶液,2.0mol·LNaOH,6.0mol·LHC1,镁试 剂,饱和(N)C0:溶液。| 材料:广泛H试纸,火柴,称量纸,定性滤纸,石棉网,玻璃棒。 四、实验步骤 1.粗食盐的提纯 (1)粗盐的溶解:用托盘天平称取5.0g研细的粗食盐放人100mL的烧杯中,加人 20.L蒸馏水,加热,搅拌使其溶解。 (2)除Ca、Mg 继续加热溶解的粗盐溶液至近沸腾,在不断搅拌下滴加l.0mol·LBaCla溶液 约1mL,继续加热5分钟,使沉淀颗粒长大易于过滤。然后将烧杯取下,待固 液分层后,沿烧杯壁在上清液中滴加2一3滴1.0mol1·LBaC12溶液, 如果无浑浊,表明S02己沉淀完全。如果有浑浊出现,应继续加热溶液 并继续滴加BaC1z溶液,直至S0,沉淀完全为止。常压过滤,弃去沉淀。 (3)除Ca、Mg、Ba等阳离子
2 2 2 2H +CO3 → H O +CO + − ↑ 4.少量 KBr、KI 等可溶性杂质因含量少溶解度较大,在 Nacl 结晶过程申仍留在 母液中而被除掉。少量多余的盐酸,在干燥 NaCl 时,会以 HCl 的形式逸出。 三、实验仪器与试剂 仪器:托盘天平,蒸发皿(125mm),烧杯(100mL)2 个,量筒(15mL),普通漏斗, 水循环真空泵, 布氏漏斗,吸滤瓶,试管 6 支,酒精灯,试管架,漏斗架。 试剂: 粗食盐,1.0 mol·L-1 BaC12, Na0H-Na2C03(2.0 mol·L-1 NaOH 溶液与 饱和 Na2C03溶液等体积混合)溶液,2.0 mol·L-1 NaOH,6.0mol·L-1 HC1,镁试 剂,饱和(NH4)2C204溶液。 | 材料: 广泛 pH 试纸,火柴,称量纸,定性滤纸,石棉网,玻璃棒。 四、 实验步骤 1. 粗食盐的提纯 ⑴粗盐的溶解:用托盘天平称取 5.0g 研细的粗食盐放人 1OOmL 的烧杯中,加人 ⒛mL 蒸馏水,加热,搅拌使其溶解。 ⑵ 除 Ca2+、Mg2+ 继续加热溶解的粗盐溶液至近沸腾,在不断搅拌下滴加 1.0 mol·L-1 BaC12溶液 约 1mL,继续加热 5 分钟,使沉淀颗粒长大易于过滤。然后将烧杯取下,待固 液分层后,沿烧杯壁在上清液中滴加 2—3 滴 1.0 mol·L-1 BaC12溶液, 如果无浑浊,表明 SO4 2-已沉淀完全。如果有浑浊出现,应继续加热溶液 并继续滴加 BaC12溶液,直至 SO4 2-沉淀完全为止。常压过滤,弃去沉淀。 ⑶ 除 Ca2+、Mg2+、Ba2+等阳离子

将所得滤液加热近沸,边搅拌边滴加NaOH-Na,CO,混合溶液至溶液的pH值约为 11。常压过滤,弃去沉淀。 (4④)用HC1溶液调整酸度除去剩余的C0,向滤液中逐滴加人6.0mol·LHC1 溶液,直至溶液的pH值为5一6(用pH试纸检验)。 (⑤)浓缩、结晶 将溶液倒人蒸发皿中,用小火加热蒸发,浓缩溶液至原体积的1/4,冷却结 品,减压抽滤,用少量蒸馏水洗涤品体,抽干。将NaCl晶体移入蒸发皿中,放 在石棉网上,在玻棒不断搅拌下,用小火烘干。冷却后称量,计算产率。 将溶液倒人蒸发皿中,用小火加热蒸发,浓缩溶液至原体积的1/4,冷却结 晶,减压抽滤,用少量蒸馏水洗涤晶体,抽干。将NaC1晶体移人蒸发皿中,放 在石棉网上,在玻棒不断搅拌下,用小火烘干。冷却后称量,计算产率。 2.产品纯度检验 称取研细的粗食盐和产品各0.5g,分别溶于5mL蒸馏水中,再各分为三等份盛 在6支试管中,用下面的方法进行定性检验。 (1)S0,2离子的检验:向分别盛有粗食盐和产品溶液的2支试管中各滴加2滴 1.0mol·LBaC12溶液,观察现象。 (2)Ca离子的检验:向分别盛有粗食盐和产品溶液的2支试管中各滴加2滴饱和 (NH)C,0,溶液,观察现象。 (3)Mg离子的检验:向分别盛有粗食盐和产品溶液的2支试管中各滴加5滴 2.0mol·L NaoH溶液和2滴镁试剂,观察有无天蓝色沉淀生成。 五、实验思考 1.在除去Ca、Mg、S0,时,为什么要先加入BaC1z溶液,然后再加入NaCO 溶液和NaOH溶液? 2.为什么要向溶液中滴加盐酸并使之呈微酸性?
将所得滤液加热近沸,边搅拌边滴加 Na0H-Na2C03混合溶液至溶液的 pH 值约为 11。常压过滤,弃去沉淀。 ⑷ 用 HCl 溶液调整酸度除去剩余的 CO3 2ˉ向滤液中逐滴加人 6.0 mol·L-1 HCl 溶液,直至溶液的 pH 值为 5—6(用 pH 试纸检验)。 ⑸ 浓缩、结晶 将溶液倒人蒸发皿中,用小火加热蒸发,浓缩溶液至原体积的 1/4,冷却结 晶,减压抽滤,用少量蒸馏水洗涤晶体,抽干。将 NaCl 晶体移入蒸发皿中,放 在石棉网上,在玻棒不断搅拌下,用小火烘干。冷却后称量,计算产率。 将溶液倒人蒸发皿中,用小火加热蒸发,浓缩溶液至原体积的 1/4,冷却结 晶,减压抽滤,用少量蒸馏水洗涤晶体,抽干。将 NaCl 晶体移人蒸发皿中,放 在石棉网上,在玻棒不断搅拌下,用小火烘干。冷却后称量,计算产率。 2. 产品纯度检验 称取研细的粗食盐和产品各 0.5g,分别溶于 5mL 蒸馏水中,再各分为三等份盛 在 6 支试管中,用下面的方法进行定性检验。 (1) SO4 2-离子的检验:向分别盛有粗食盐和产品溶液的 2 支试管中各滴加 2 滴 1.0mol·L-1 BaC12 溶液,观察现象。 (2)Ca2+离子的检验:向分别盛有粗食盐和产品溶液的 2 支试管中各滴加 2 滴饱和 (NH4)2C204 溶液,观察现象。 (3) Mg2+离子的检验:向分别盛有粗食盐和产品溶液的 2 支试管中各滴加 5 滴 2.0 mol·L-1 NaoH 溶液和 2 滴镁试剂,观察有无天蓝色沉淀生成。 五、 实验思考 1. 在除去 Ca2+、Mg2+、SO4 2-时,为什么要先加入 BaC12溶液,然后再加入 Na2CO3 溶液和 NaOH 溶液? 2. 为什么要向溶液中滴加盐酸并使之呈微酸性?
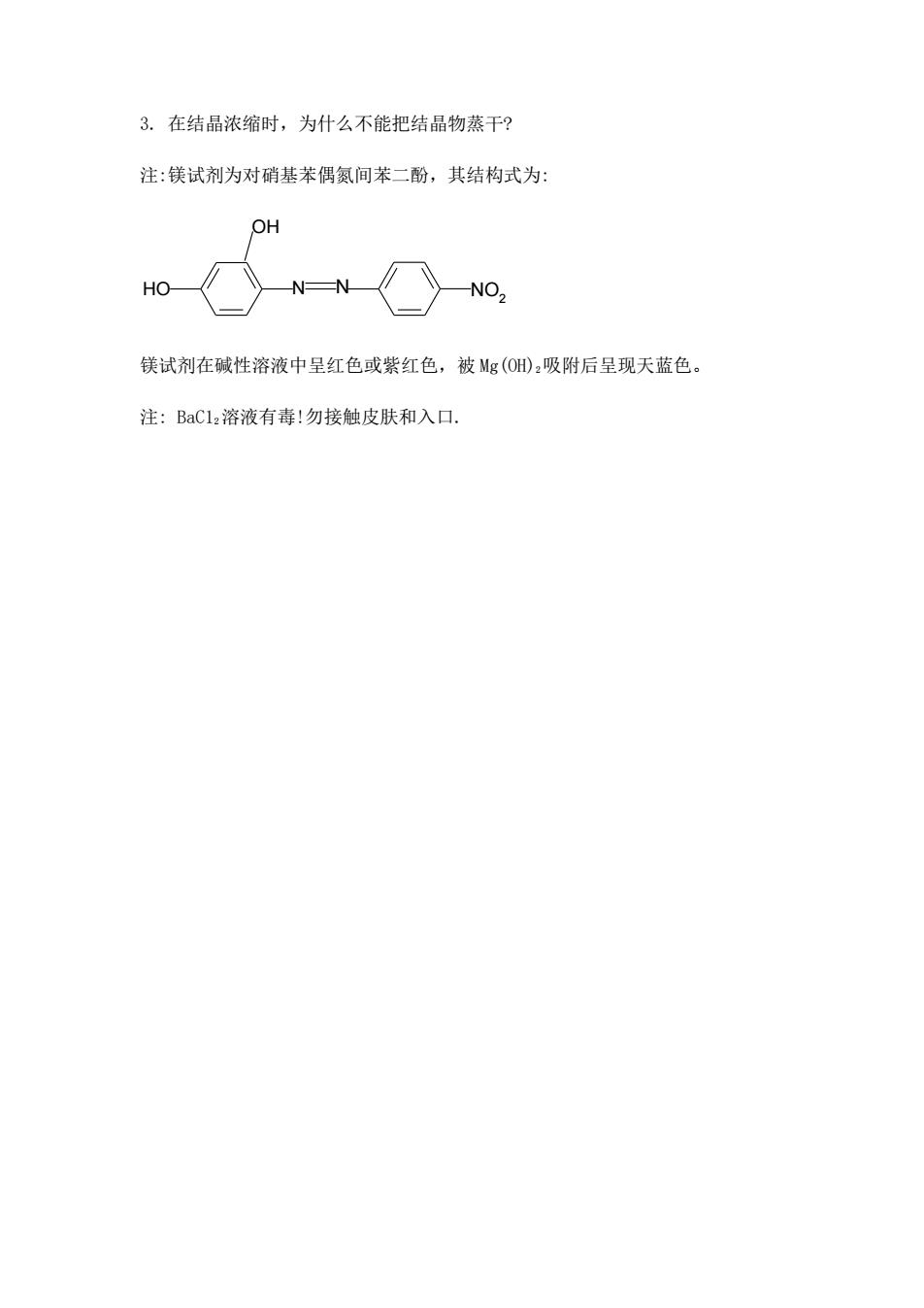
3.在结晶浓缩时,为什么不能把结晶物蒸干? 注:镁试剂为对硝基苯偶氮间苯二酚,其结构式为: OH HO N-N NO, 镁试剂在碱性溶液中呈红色或紫红色,被Mg(O:吸附后呈现天蓝色。 注:BaCl,溶液有毒!勿接触皮肤和入口
3. 在结晶浓缩时,为什么不能把结晶物蒸干? 注:镁试剂为对硝基苯偶氮间苯二酚,其结构式为: HO OH N N NO2 镁试剂在碱性溶液中呈红色或紫红色,被 Mg(OH)2吸附后呈现天蓝色。 注: BaC12溶液有毒!勿接触皮肤和入口