
实验四混合碱的分析(双指示剂法) 、实验目的 1。一步熟练滴定操作和滴定终点的判断: 2.掌握混合碱分析的测定原理、方法和计算。 二、实验原理 混合碱是NaOH与NaCO,或NaCO,与NaHCO,的混合物,采用双指示剂法,可 以测定各组分的含量 首先,在碱液中加入酚酞指示剂,用H©标准溶液滴定至溶液略带粉红色,即为第 化学计量点,反应如下: NaOH+HCI=NaCl+H2O Na-CO:+HC=NaHCO:+hO 此时反应产物为Nal 第二化学计量点,反应如下: NaHCO;+HCI NaCl +H2O+CO2 t 此时溶液pH为3.7。设所消耗HC溶液的体积为2(m)。 根据V、V可计算烧碱中NaOH和NaCO的含量。 三、实验试剂 1.混合碱试样 2.甲基橙指示剂(1gL水溶液) 3.酚酞指示剂(2gL乙醇溶液) 4.HCI标准溶液 四、实验仪器 仪器 备注 分析天平 公用 称量瓶 公用 烧杯 容量瓶 1 移液管 玻璃挂 锥形瓶 3 酸式滴定管 五、实验步蜜 用递减 瓶中定容。 2.第一终点的滴定 用移液管吸取试液一份,置于锥形瓶中,加适量蒸馏水,再加2~3滴酚酞指示剂,用 HC标准溶液滴定至溶液由红色转变为微红色,记下读数 3.第二终点的滴定 在上述溶液中再加1-2滴甲基橙指示剂,继续用H©1标准溶液滴定至溶液由黄色转变 为橙色,记下读数
实验四 混合碱的分析(双指示剂法) 一、实验目的 1.一步熟练滴定操作和滴定终点的判断; 2.掌握混合碱分析的测定原理、方法和计算。 二、实验原理 混合碱是 NaOH 与 Na2CO3,或 Na2CO3 与 NaHCO3 的混合物,采用双指示剂法,可 以测定各组分的含量。 首先,在碱液中加入酚酞指示剂,用 HCl 标准溶液滴定至溶液略带粉红色,即为第一 化学计量点,反应如下: NaOH + HCl = NaCl+ H2O Na2CO3+ HCl = NaHCO3 +H2O 此时反应产物为 NaHCO3 和 NaCl,溶液 pH 为 8.3,设所消耗 HCl 溶液的体积为 V1(ml)。 然后,继续加入甲基橙指示剂,用 HCl 标准溶液滴定至溶液由黄色转变为橙色,即为 第二化学计量点,反应如下: NaHCO3 + HCl = NaCl + H2O + CO2↑ 此时溶液 pH 为 3.7。设所消耗 HCl 溶液的体积为 V2(ml)。 根据 V1、V2 可计算烧碱中 NaOH 和 Na2CO3 的含量。 三、实验试剂 1.混合碱试样 2.甲基橙指示剂(1g/L 水溶液) 3.酚酞指示剂(2g/L 乙醇溶液) 4.HCl 标准溶液 四、实验仪器 仪器 备注 分析天平 公用 称量瓶 公用 烧杯 1 容量瓶 1 移液管 1 玻璃棒 1 锥形瓶 3 酸式滴定管 1 五、实验步骤 1.混合碱试液的配制 用递减称量法准确称取 0.83-0.85g 试样置于烧杯中,用适量去离子水溶解后转移到容量 瓶中定容。 2.第一终点的滴定 用移液管吸取试液一份,置于锥形瓶中,加适量蒸馏水,再加 2~3 滴酚酞指示剂,用 HCl 标准溶液滴定至溶液由红色转变为微红色,记下读数。 3.第二终点的滴定 在上述溶液中再加 1 ~2 滴甲基橙指示剂,继续用 HCl 标准溶液滴定至溶液由黄色转变 为橙色,记下读数
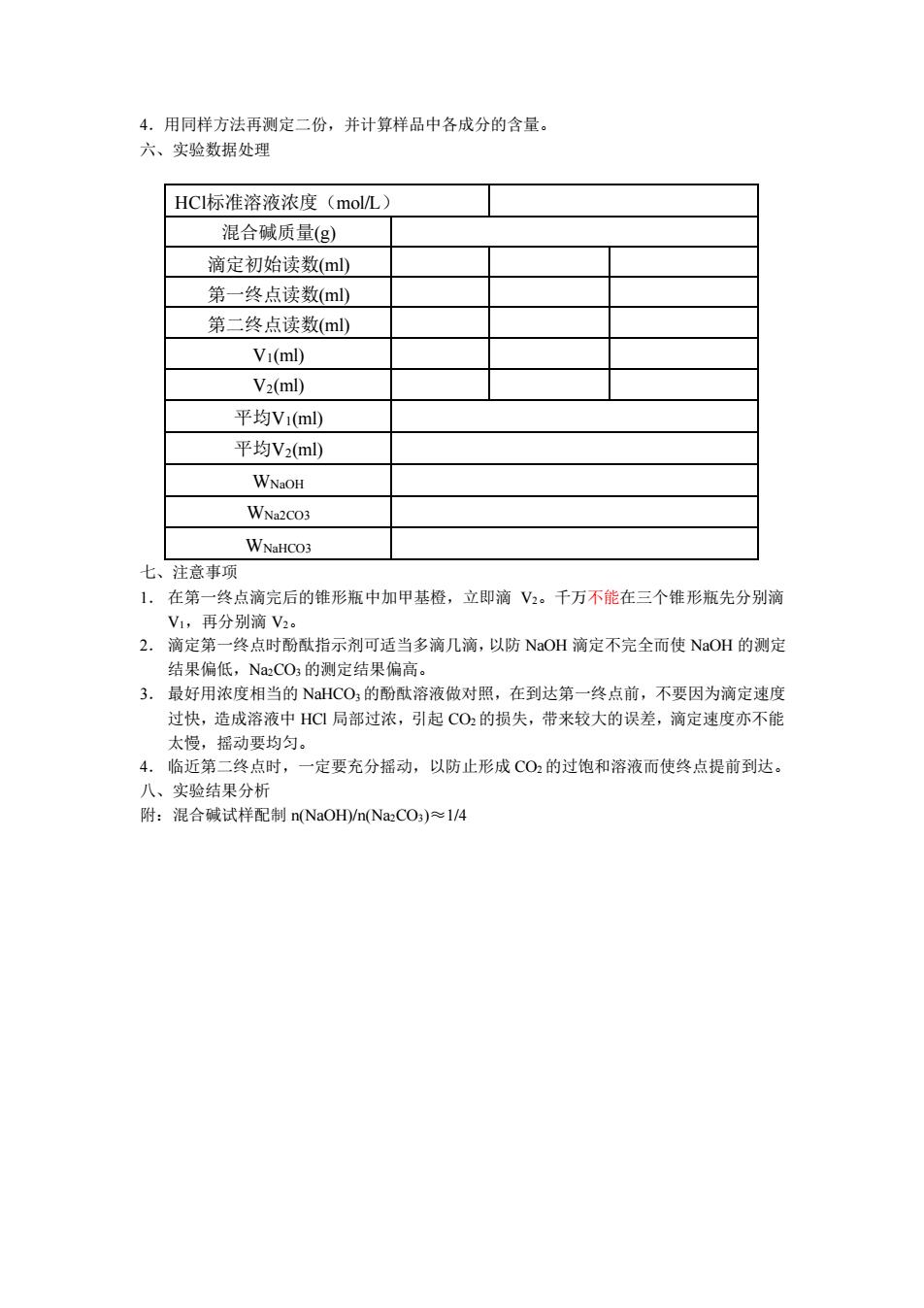
4.用同样方法再测定二份,并计算样品中各成分的含量。 六、实验数据处理 HCI标淮溶液浓度(molL) 混合碱质量(g) 滴定初始读数(ml) 第一终点读数(ml 第二终点读数(ml Vi(ml) Vz(ml) 平均V1(ml 平均V2(ml WNaOH WNa2CO3 WNaHCO3 注意事项 1.在第一终点滴完后的锥形瓶中加甲基橙,立即滴V2。千万不能在三个锥形瓶先分别滴 V1,再分别滴V2。 2.滴定第一终点时酚酞指示剂可适当多滴几滴,以防NaOH滴定不完全而使NaOH的测定 结果偏低,NaCO的测定结果偏高。 3.最好用浓度相当的NHCO,的酚酞溶液做对照,在到达第一终点前,不要因为滴定速度 过快,造成溶液中HG局部过浓,引起C0:的损失,带来较大的误差,滴定速度亦不能 太慢,摇动要均匀。 4.临近第二终点时,一定要充分摇动,以防止形成CO2的过饱和溶液而使终点提前到达。 八、实验结果分析 附:混合碱试样配制n(NaOH)/n(NaCO)≈1/4
4.用同样方法再测定二份,并计算样品中各成分的含量。 六、实验数据处理 HCl标准溶液浓度(mol/L) 混合碱质量(g) 滴定初始读数(ml) 第一终点读数(ml) 第二终点读数(ml) V1(ml) V2(ml) 平均V1(ml) 平均V2(ml) WNaOH WNa2CO3 WNaHCO3 七、注意事项 1. 在第一终点滴完后的锥形瓶中加甲基橙,立即滴 V2。千万不能在三个锥形瓶先分别滴 V1,再分别滴 V2。 2. 滴定第一终点时酚酞指示剂可适当多滴几滴,以防 NaOH 滴定不完全而使 NaOH 的测定 结果偏低,Na2CO3 的测定结果偏高。 3. 最好用浓度相当的 NaHCO3 的酚酞溶液做对照,在到达第一终点前,不要因为滴定速度 过快,造成溶液中 HCl 局部过浓,引起 CO2 的损失,带来较大的误差,滴定速度亦不能 太慢,摇动要均匀。 4. 临近第二终点时,一定要充分摇动,以防止形成 CO2 的过饱和溶液而使终点提前到达。 八、实验结果分析 附:混合碱试样配制 n(NaOH)/n(Na2CO3)≈1/4