
第二章化学反应速率与化学平衡 本章知识点与考核要求 •化学反应速率表示方法 ·浓度、温度、催化剂对反应速率的影响 •化学平衡标准平衡常数 •影响化学平衡的因素和吕查德里原理
第二章 化学反应速率与化学平衡 本章知识点与考核要求 •化学反应速率表示方法 •浓度、温度、催化剂对反应速率的影响 •化学平衡 标准平衡常数 •影响化学平衡的因素和吕查德里原理

第一节化学反应速率 一、化学反应速率 > 各种不同的化学反应进行的快慢程 度不同,如炸药的爆炸瞬间完成: 而金属腐烛等反应进行的缓慢。 >化学上衡量化学反应快慢的量,叫 做化学反应速率
第一节 化学反应速率 一、化学反应速率 ➢ 各种不同的化学反应进行的快慢程 度不同,如炸药的爆炸瞬间完成; 而金属腐蚀等反应进行的缓慢。 ➢ 化学上衡量化学反应快慢的量,叫 做化学反应速率

化学反应速率的表示法 1.定义 是用单位时间内反应物浓度的减少 或生成物浓度的增加来表示 ·浓度用“CB”表示,单位molL 时间t则根据具体反应的快慢,用秒、 分或小时来表示
化学反应速率的表示法 1. 定义 是用单位时间内反应物浓度的减少 或生成物浓度的增加来表示 ▪ 浓度用“CB” 表示, 单位mol/L ▪ 时间t 则根据具体反应的快慢,用秒、 分或小时来表示

2.化学反应速率用符号“V”表示 反应AB 反应从t1开始,反应物浓度为CA1,, 变化到t2浓度为CA2,这时反应的速 率为 C42-CAL △CA t2-t1 △t
2.化学反应速率用符号“”表示 反应 A B 反应从t1开始,反应物浓度为CA1, 变化到t2浓度为CA2,这时反应的速 率为 t C t t CA CA A = − − − = − 2 1 2 1

提示: 当用反应物浓度单位时间内的减少 来表示反应速率时,由于反应物浓 度随时间增加而减少,△CA为负值 而反应速率总是正值,故用反应物 浓度来表示反应速率时,必须在表 达式前加“负号”,使反应速率具 有正值
提示: ▪ 当用反应物浓度单位时间内的减少 来表示反应速率时,由于反应物浓 度随时间增加而减少,CA为负值, 而反应速率总是正值,故用反应物 浓度来表示反应速率时,必须在表 达式前加“负号”,使反应速率具 有正值

对一般反应 aA+bBdD+eE 其反应的化学反应速率可用任意 一反应物或产物单位时间内浓度的 变化来表示,平均反应速率为 1△CA 1 ACB 1 ACp 1 ACE a△t b△td△t e△t
对一般反应 aA + bB dD + eE 其反应的化学反应速率可用任意 一反应物或产物单位时间内浓度的 变化来表示,平均反应速率为 t C t e C t d C t b C a A B D E = = = − = − 1 1 1 1

二、反应速率理论 1.有效碰撞理论 其要点归结如下: (1)要发生化学反应,反应物分子 必须碰撞 (2)在化学反应中,只有一定数目 的少数分子在碰撞时才能发生反应
二、反应速率理论 1. 有效碰撞理论 其要点归结如下: (1)要发生化学反应,反应物分子 必须碰撞 (2)在化学反应中,只有一定数目 的少数分子在碰撞时才能发生反应

■根据有效碰撞理论,只有具有较高能量 的活化分子间的碰撞才能发生反应 能够发生反应的碰撞,称为有效碰撞; 不能够发生反应的碰撞,叫弹性碰撞
根据有效碰撞理论,只有具有较高能量 的活化分子间的碰撞才能发生反应 能够发生反应的碰撞,称为有效碰撞; 不能够发生反应的碰撞,叫弹性碰撞
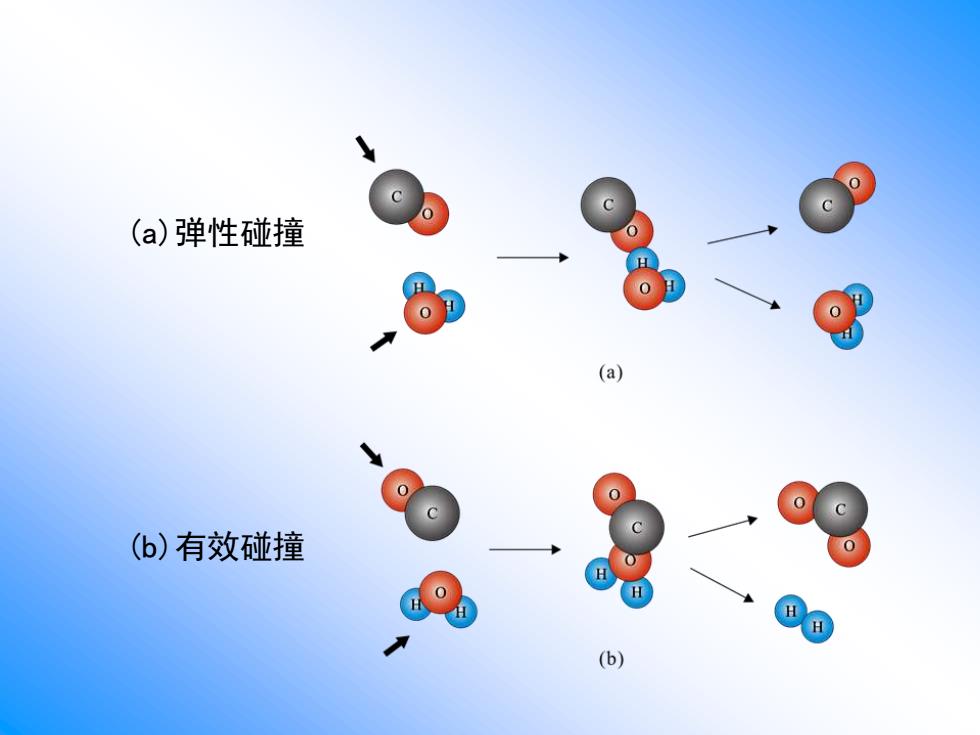
(a)弹性碰撞 (a) c (b)有效碰撞 H (b)
(a)弹性碰撞 (b)有效碰撞

活化分子、活化能 能够发生有效碰撞的分子,叫活化分子 活化分子具有的平均能量与反应物分子 具有的平均能量的差值,叫活化能。符 号为“Ea” 口通常活化分子占的百分数是很小的
活化分子、活化能 能够发生有效碰撞的分子,叫活化分子 活化分子具有的平均能量与反应物分子 具有的平均能量的差值,叫活化能。符 号为“Ea” 通常活化分子占的百分数是很小的