
以Fe为原料制备感光液 一、实验目的 1.学习利用盐类在不同温度下溶解度的差别来制备物质的原理和方法: 2.掌握合成NHa)2Fe(SO26H:O、KFe(C2O]3HO的基本原理和操作技术: 3.加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解: 4.巩周水浴加热、冷却、结晶、重结晶、洗涤、干燥等基本操作 二、实验原理 1.(NH4)2Fe(S026H0的制备 以铁屑或铁粉为原料,溶于稀硫酸制得硫酸亚铁溶液,然后加入硫酸铵制得饱和溶液,经加 热浓缩、冷却至室温后可得溶解度较小的硫酸亚铁铵复盐品体。 Fe+H,sO,→FesO,+H2t FeSO,+(NH)SO,+6HO(NH)2 Fe(SO)6H.O 2.KFc(C0)川3H0的合成 以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀,然后再用草酸亚铁在草酸 钾和草酸的存在下,以过氧化氢为氧化剂,得到铁(Ⅲ)草酸配合物。主要反应为 (NH)hFe(SO)2+H,C,O,+2H,0→FeC,O,·2H,0↓+NH)2SO,+H,SO, 2FeC,O·2H,0+H,O+3K,C,O+H,C,O.→2K,IFCO)h]·3H,0 改变溶剂极性并加少量盐析剂,可析出绿色单斜品体纯的三草酸合铁(Ⅲ)酸钾。 3.复盐硫酸亚铁衒FeSO(NH2SO:6HO]又称摩尔盐,是浅蓝绿色的单斜晶体。它在空气中比 一般亚铁盐稳定,不易被氧化,溶于水但不溶于乙醇。疏酸铵、硫酸亚铁铵和疏酸亚铁在不同温 度下的溶解度见下表: 表1-1(NH)SO、FeSO7HO、(NH)zFc(SOh6H0的溶解度/g(100g水 温度C 物质 1020304050607080 (NHa)2 SOa 73.075.478.081.0 88.0-95.3 FeSO4-7H2O 20.526.539.240.248.6- (NH)Fe(0426H018.126.9-38.5-53.4 73.0
以Fe为原料制备感光液 一、实验目的 1. 学习利用盐类在不同温度下溶解度的差别来制备物质的原理和方法; 2. 掌握合成(NH4)2Fe(SO4)2·6H2O、K3Fe[(C2O4)3]·3H2O的基本原理和操作技术; 3. 加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解; 4. 巩固水浴加热、冷却、结晶、重结晶、洗涤、干燥等基本操作; 二、实验原理 1. (NH4)2Fe(SO4)2·6H2O的制备 以铁屑或铁粉为原料,溶于稀硫酸制得硫酸亚铁溶液,然后加入硫酸铵制得饱和溶液,经加 热浓缩、冷却至室温后可得溶解度较小的硫酸亚铁铵复盐晶体。 Fe + H2SO4 → FeSO4 + H2 FeSO4 + (NH4 ) 2 SO4 + 6H2O →(NH4 ) 2Fe(SO4 ) 2 •6H2O 2. K3Fe[(C2O4)3]·3H2O的合成 以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀,然后再用草酸亚铁在草酸 钾和草酸的存在下,以过氧化氢为氧化剂,得到铁(Ⅲ)草酸配合物。主要反应为 4 2 4 2 2 2 4 2 2 4 2 4 2 4 2 4 (NH ) Fe(SO ) + H C O + 2H O → FeC O • 2H O +(NH ) SO + H SO 2FeC2O4 • 2H2O + H2O2 + 3K2C2O4 + H2C2O4 → 2K3 [Fe(C2O4 ) 3 ]•3H2O 改变溶剂极性并加少量盐析剂,可析出绿色单斜晶体纯的三草酸合铁(Ⅲ)酸钾。 3. 复盐硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]又称摩尔盐,是浅蓝绿色的单斜晶体。它在空气中比 一般亚铁盐稳定,不易被氧化,溶于水但不溶于乙醇。硫酸铵、硫酸亚铁铵和硫酸亚铁在不同温 度下的溶解度见下表: 表1-1 (NH4)2 SO4、FeSO4·7H2O、(NH4)2Fe(SO4)2·6H2O的溶解度/g·(100g水) -1 物质 温度/°C 10 20 30 40 50 60 70 80 (NH4)2 SO4 73.0 75.4 78.0 81.0 ― 88.0 ― 95.3 FeSO4·7H2O 20.5 26.5 39.2 40.2 48.6 ― ― ― (NH4)2Fe(SO4)2·6H2O 18.1 26.9 ― 38.5 ― 53.4 ― 73.0

4.KFe(C2O43HO的性质 K3F(C,0小-3H0是一种翠绿色的单斜晶体,在298K时,在100g水中的溶解度为4.7g 110°℃开始失去结晶水,230C开始分解。见光,高温,强酸性条件下易分解,易溶于水,难溶于 醇、醚、酮等有机溶剂,是制备负载型活性铁催化剂的主要原料。 5.盐析的原理 盐析一般是指溶液中加入无机盐类而使溶解的物质析出的过程。如:加浓(NH)2SO4使蛋 白质凝聚的过程。 6.感光液制备原理 三草酸合铁配合物具有光敏活性,在紫外线的作用下,发生光化学反应,产生二价铁,当二 价铁与赤血盐相遇时产生膝氏蓝从而显蓝色。 2Fe(C,0)3"→2F(C,0)]'→2FeC,0,+2C02+3C,0,2 K[Fe(CW6]+FeC,O,→KFFe(CW)6](滕氏蓝)+K,C,O, 三、实验仪器与试剂 仪器:托盘天平,抽滤装置(水泵,布氏漏斗,吸滤瓶),烧杯(500mL,250mL,100mL),水浴 锅,表面皿,煤油温度计(0-100C) 试剂:(NbFc(SO26O,HSO1.0molL,C2O,(饱和),KCO(饱和),KNO(300.0 gL),乙醇(95%),KF©(CN)6](5%)每实验室准备一瓶),H02(3%). 四、实验步骤 1,硫酸亚铁铵的制备 称取3.0g铁粉,放在锥形瓶中,加入20.0mL30 mol-LH2S0,置于水浴中加热反应,反应装置 应靠近通风口(为什么会产生臭鸡蛋气味?)。反应过程中,适当补充被蒸发掉的水分(尽可能 维持原有液面刻度水平,加热不要过猛,控制反应温度在70-80C),当反应基本完全时,趁热 过滤。滤液转移至小烧杯或蒸发皿中。观察滤纸上残渣的颜色、状态。烘干称量。 根据差量法大致估算反应掉的铁粉量,量取配置好的饱和硫酸铵溶液在蒸发皿中搅拌均匀后 水浴浓缩。蒸发浓缩值液面出现品膜为止(浓缩开始时可适当搅拌,后期不宜搅拌)。取出蒸发 皿静置,冷却后减压抽滤。用少量的乙醇洗涤品体两次。取出干燥称量。 2.草酸亚铁的制备 称取5.0g硫酸亚铁铵固体放在250mL烧杯中,然后加15.0mL蒸馏水和5-6滴1.0molL
4. K3Fe[(C2O4)3]·3H2O的性质 K3Fe[(C2O4)3]·3H2O是一种翠绿色的单斜晶体,在298K时,在100 g水中的溶解度为4.7 g, 110°C开始失去结晶水,230°C开始分解。见光,高温,强酸性条件下易分解, 易溶于水,难溶于 醇、醚、酮等有机溶剂,是制备负载型活性铁催化剂的主要原料。. 5. 盐析的原理 盐析一般是指溶液中加入无机盐类而使溶解的物质析出的过程。如:加浓(NH4)2SO4使蛋 白质凝聚的过程。 6. 感光液制备原理 三草酸合铁配合物具有光敏活性,在紫外线的作用下,发生光化学反应,产生二价铁,当二 价铁与赤血盐相遇时产生滕氏蓝从而显蓝色。 − − − ⎯⎯→ ⎯→ + + 2 2 4 2 2 4 3 * 2 4 3 3 2[Fe(C2O4 ) 3 ] 2[Fe(C O ) ] 2FeC O 2CO 3C O h 3 6 2 4 6 K2 2 4 K [Fe(CN) ]+ FeC O ⎯→ KFe[Fe(CN) ](滕氏蓝)+ C O 三、实验仪器与试剂 仪器: 托盘天平,抽滤装置(水泵,布氏漏斗,吸滤瓶),烧杯(500 mL, 250 mL, 100 mL),水浴 锅,表面皿, 煤油温度计(0-100℃) 试剂: (NH4)2Fe(SO4)2·6H2O,H2SO4(1.0 mol·L-1 ),H2C2O4(饱和),K2C2O4(饱和),KNO3(300.0 g·L -1 ),乙醇(95%),K3[Fe(CN)6] (5%) 每实验室准备一瓶),H2O2 (3%)。 四、实验步骤 1.硫酸亚铁铵的制备 称取3.0 g铁粉,放在锥形瓶中,加入20.0 mL 3.0 mol·L-1 H2SO4,置于水浴中加热反应,反应装置 应靠近通风口(为什么会产生臭鸡蛋气味?)。反应过程中,适当补充被蒸发掉的水分(尽可能 维持原有液面刻度水平,加热不要过猛,控制反应温度在70-80°C),当反应基本完全时,趁热 过滤。滤液转移至小烧杯或蒸发皿中。观察滤纸上残渣的颜色、状态。烘干称量。 根据差量法大致估算反应掉的铁粉量,量取配置好的饱和硫酸铵溶液在蒸发皿中搅拌均匀后 水浴浓缩。蒸发浓缩值液面出现晶膜为止(浓缩开始时可适当搅拌,后期不宜搅拌)。取出蒸发 皿静置,冷却后减压抽滤。用少量的乙醇洗涤晶体两次。取出干燥称量。 2. 草酸亚铁的制备 称取5.0 g硫酸亚铁铵固体放在250 mL烧杯中,然后加15.0 mL蒸馏水和5~6滴1.0 mol·L-1

HS0,加热溶解后,再加入25.0mL饱和草酸溶液,加热搅拌至沸,然后迅速搅拌片刻,防止飞 溅。停止加热,静置。待黄色品体FεCz042H0沉淀后倾析,弃去上层清液,加入20mL蒸馏水 洗涤品体,搅拌并温热,静置,弃去上层清液,即得黄色品体草酸亚铁。 3.三草酸合铁(Ⅲ)酸钾的制备 往草酸亚铁沉淀中,加入饱和K,C20溶液10.0mL,水浴加热313.0K,恒温下慢慢滴加3%的 H02溶液20.0mL,沉淀转为深棕色。边加边搅拌,加完后将溶液加热至沸,然后趁热逐滴加入 20.0mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯中,加 入95%的乙醇25.0mL,混匀后冷却,可以看到烧杯底部有晶体析出。为了加快结晶速度,可往 其中滴加几滴KNO溶液。晶体完全析出后,抽滤,用乙醇10.0mL分多次淋洒滤饼,抽干混合液。 固体产品置于一表面皿上,置暗处晾干。称重,计算产率。 4.感光液的制备 将0.5g三草酸合铁(Ⅲ)酸钾溶于5.0ml蒸馏水中,滴加5滴KF©(CN)s](5%),搅拌均匀后, 玻璃棒燕取溶液在纸面上写字,在日光下观察。 五、实验思考 L.能否直接用三价铁制备三草酸合铁(Ⅲ)酸钾,如FC1等 2.为什么在滴加HO:过程中需要控制温度? 3.滴加KNO3溶液起到什么作用? 4.最后能否在析晶之前适当浓缩溶液 5.什么叫复盐?它与配合物有何区别? 6.实验中为什么保持硫酸亚铁、硫酸亚铁铵溶液呈较强的酸性?
H2SO4,加热溶解后,再加入25.0 mL饱和草酸溶液,加热搅拌至沸,然后迅速搅拌片刻,防止飞 溅。停止加热,静置。待黄色晶体FeC2O4·2H2O沉淀后倾析,弃去上层清液,加入20 mL蒸馏水 洗涤晶体,搅拌并温热,静置,弃去上层清液,即得黄色晶体草酸亚铁。 3. 三草酸合铁(Ⅲ)酸钾的制备 往草酸亚铁沉淀中,加入饱和K2C2O4溶液10.0 mL,水浴加热313.0K,恒温下慢慢滴加3%的 H2O2溶液20.0 mL,沉淀转为深棕色。边加边搅拌,加完后将溶液加热至沸,然后趁热逐滴加入 20.0 mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色。趁热抽滤,滤液转入100 mL烧杯中,加 入95%的乙醇25.0 mL,混匀后冷却,可以看到烧杯底部有晶体析出。为了加快结晶速度,可往 其中滴加几滴KNO3溶液。晶体完全析出后,抽滤,用乙醇10.0 mL分多次淋洒滤饼,抽干混合液。 固体产品置于一表面皿上,置暗处晾干。称重,计算产率。 4. 感光液的制备 将0.5 g 三草酸合铁(Ⅲ)酸钾溶于5.0 ml蒸馏水中,滴加5滴K4[Fe(CN)6] (5%),搅拌均匀后, 玻璃棒蘸取溶液在纸面上写字,在日光下观察。 五、实验思考 1. 能否直接用三价铁制备三草酸合铁(Ⅲ)酸钾,如FeCl3等? 2. 为什么在滴加H2O2 过程中需要控制温度? 3. 滴加KNO3溶液起到什么作用? 4. 最后能否在析晶之前适当浓缩溶液? 5. 什么叫复盐?它与配合物有何区别? 6. 实验中为什么保持硫酸亚铁、硫酸亚铁铵溶液呈较强的酸性?

混合碱分析与测定 一、实验目的 1,利用双指示剂法分析和测定混合碱的组成和含量的基本原理和方法: 2.巩固酸碱滴定的基本操作: 二、基本原理 1.混合碱系是指NaCO、NaOH、NaHCO:的各自混合物及类似的混合物。但不存在NaOH和 NaHCO的混合物,为什么? 2.0.1molL的NaOH、NaCo、NaHCOs溶液的pH分别为:13.0、11.6、8.3,用0.1mol/LHC 分别滴定O.1mol/LNaOH、NCO、NaHCO,溶液时,如果以酚酞为指示剂,酚酞的变色范围为 8lO,因此,NaOH、NaCO:可以被滴定,NaOH转化为NaCl,NaCO3转化为NaHCO:,为第 一终点:而NaHCO不被滴定,当以甲基橙(3.1~4.3)为指示剂时,NaHCO被滴定转化为NaC 为第二终点。 分析: NaOH Na2CO3 NaHCO3 HCI 消 耗 HCI的 第一终点NaC 体积V NaHCO: HCI 消 耗 HCI的 体积V2 第二终点 NaCL NaCL 从上述分析可见,通过滴定不仅能够完成定量分析,还可以完成定性分析。 因为NaCO转化生成NaHCO以及NaHCO:转化为NaC消耗HC的量是相等的,所以, 由V和V2的大小可以判断混合碱的组成 当V>V2时,说明是NaOH和NaCO:组成混合碱,当V1<V2时,说明是NaCO,和NaHCO 组成混合碱。 计算公式:
混合碱分析与测定 一、实验目的 1. 利用双指示剂法分析和测定混合碱的组成和含量的基本原理和方法; 2. 巩固酸碱滴定的基本操作; 二、基本原理 1. 混合碱系是指 Na2CO3、NaOH、NaHCO3 的各自混合物及类似的混合物。但不存在 NaOH 和 NaHCO3 的混合物,为什么? 2. 0.1 mol/L 的 NaOH、Na2CO3、NaHCO3 溶液的 pH 分别为:13.0、11.6、8.3,用 0.1 mol/L HCl 分别滴定 0.1 mol/L NaOH、Na2CO3、NaHCO3 溶液时,如果以酚酞为指示剂,酚酞的变色范围为 8~10,因此,NaOH、Na2CO3 可以被滴定,NaOH 转化为 NaCl,Na2CO3 转化为 NaHCO3,为第 一终点;而 NaHCO3 不被滴定,当以甲基橙(3.1~4.3)为指示剂时,NaHCO3 被滴定转化为 NaCl 为第二终点。 分析: 从上述分析可见,通过滴定不仅能够完成定量分析,还可以完成定性分析。 因为 Na2CO3 转化生成 NaHCO3 以及 NaHCO3 转化为 NaCl 消耗 HCl 的量是相等的,所以, 由 V1 和 V2 的大小可以判断混合碱的组成。 当 V1>V2 时,说明是 NaOH 和 Na2CO3 组成混合碱,当 V1<V2 时,说明是 Na2CO3 和 NaHCO3 组成混合碱。 计算公式: NaOH Na2CO3 NaHCO3 HCl 消 耗 HCl 的 体积 V1 第一终点 NaCl NaHCO3 NaCl NaCl HCl 第二终点 消 耗 HCl 的 体积 V2

a.NaOH和NaCO组成混合碱(V1>V2): MNaot NaOH % c(W,-gX100 -×100% cx2V,×2×1000 m ×100% b.NaCO,和NaHCO3组成混合碱(V1<Y2): Mco Na2C0,%= cx2rx7×1000 ×100% m Mxalco NaHCO %= c(W2-V)x1000x10% m 当V1=0,V20:V0,V2=0:V1=V0时,又如何?(思考) 三、实验内容 1.HC标准溶液的标定 准确称量0.1012g无水NC03三份,分别于250mL锥形瓶中,加入25mL比0溶解, 2~3滴甲基橙,用HC标准溶液滴定至终点。 注意:终点时生成的是HCO,饱和溶液,pH为3.9,为了防止终点提前,必须尽可能驱除 CO2,接近终点时要剧烈振荡溶液,或者加热。 2.混合碱分析 称取一定量的混合碱于小烧杯中,加入少许水溶解,定量转入250mL容量瓶中定容。 滴定,移取25.00mL混合碱溶液于250mL锥形瓶中,加入34滴酚酞指示剂,用HC标 准溶液滴定至第一终点。记录消耗HC1标准溶液的体积VmL。再加入34滴甲基橙指示剂,用 HC1标准溶液滴定至第二终点。记录消耗HC标准溶液的总体积VmL。平行操作三次。 注意:在第一终点时,生成NHCO,应尽可能保证CO2不丢失!而在第二终点时,生成HCO 应尽可能驱除CO!采取的措施:a接近终点时,滴定速度一定不能过快!否则造成HC1局部过 浓,引起C02丢失!b摇动要缓慢,不要刷烈振动: 四、数据处理 1.判断混合碱的组成。 根据第一终点、第二终点消耗HC标准溶液的体积V1mL和V2mLV2=V一V)的大小判断
a.NaOH 和 Na2CO3 组成混合碱(V1>V2): b.Na2CO3 和 NaHCO3 组成混合碱(V1<V2): 当 V1=0,V2≠0;V1≠0,V2=0;V1=V2≠0 时,又如何?(思考) 三、实验内容 1. HCl 标准溶液的标定 准确称量 0.1~0.12 g 无水 Na2CO3 三份,分别于 250 mL 锥形瓶中,加入 25 mL H2O 溶解, 2~3 滴甲基橙,用 HCl 标准溶液滴定至终点。 注意:终点时生成的是 H2CO3 饱和溶液,pH 为 3.9,为了防止终点提前,必须尽可能驱除 CO2,接近终点时要剧烈振荡溶液,或者加热。 2. 混合碱分析 称取一定量的混合碱于小烧杯中,加入少许水溶解,定量转入 250 mL 容量瓶中定容。 滴定,移取 25.00 mL 混合碱溶液于 250 mL 锥形瓶中,加入 3~4 滴酚酞指示剂,用 HCl 标 准溶液滴定至第一终点。记录消耗 HCl 标准溶液的体积 V1 mL。再加入 3~4 滴甲基橙指示剂,用 HCl 标准溶液滴定至第二终点。记录消耗 HCl 标准溶液的总体积 VmL。平行操作三次。 注意:在第一终点时,生成 NaHCO3 应尽可能保证 CO2 不丢失!而在第二终点时,生成 H2CO3 应尽可能驱除 CO2!采取的措施:a.接近终点时,滴定速度一定不能过快!否则造成 HCl 局部过 浓,引起 CO2 丢失!b.摇动要缓慢,不要剧烈振动! 四、数据处理 1. 判断混合碱的组成。 根据第一终点、第二终点消耗 HCl 标准溶液的体积 V1 mL 和 V2 mL(V2=V-V1)的大小判断 NaOH % = c (V1-V2)× MNaOH 1000 m ×100% Na 2CO 3% = c×2 V2× 1 2 × MNa 2CO 3 1000 m ×100% Na 2CO 3% = c×2 V1× 1 2 × MNa 2CO 3 1000 m ×100% NaHCO 3% = c (V2-V1)× MNaHCO 3 1000 m ×100%
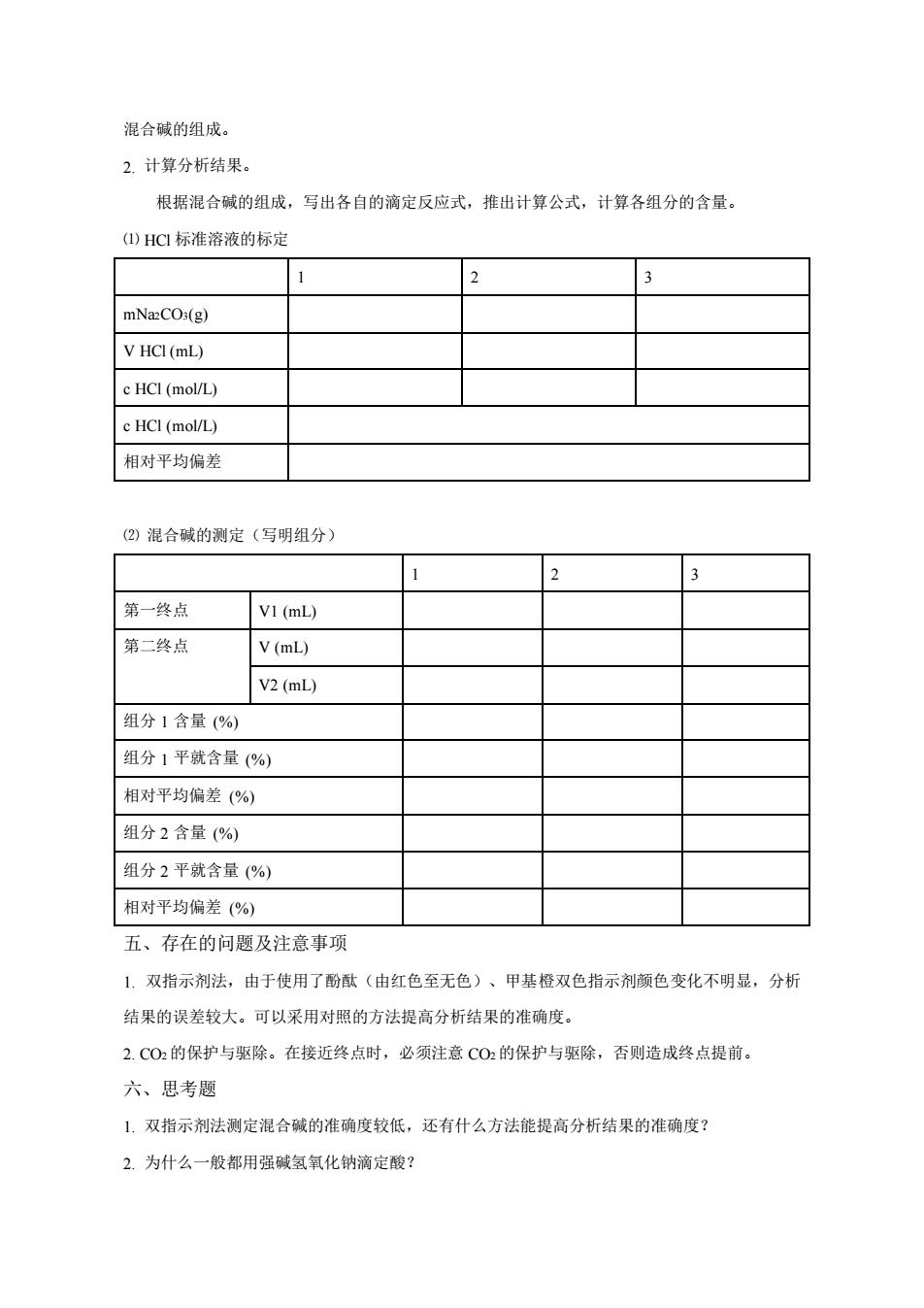
混合碱的组成。 2.计算分析结果。 根据混合碱的组成,写出各自的滴定反应式,推出计算公式,计算各组分的含量。 ()HC标准溶液的标定 mNazCO3(g) V HCI(mL) c HCI (mol/L) c HCI (mol/L) 相对平均偏差 (2)混合碱的测定(写明组分) 第一终点 VI(mL) 第二终点 V(mL) V2(mL) 组分1含量(%) 组分1平就含量(%) 相对平均偏差(%) 组分2含量(%) 组分2平就含量(%) 相对平均偏差(%) 五、存在的问题及注意事项 1.双指示剂法,由于使用了酚酞(由红色至无色)、甲基橙双色指示剂颜色变化不明显,分析 结果的误差较大。可以采用对照的方法提高分析结果的准确度。 2.C02的保护与驱除。在接近终点时,必须注意C02的保护与驱除,否则造成终点提前。 六、思考题 1.双指示剂法测定混合碱的准确度较低,还有什么方法能提高分析结果的准确度? 2.为什么一般都用强碱氢氧化钠滴定酸?
混合碱的组成。 2. 计算分析结果。 根据混合碱的组成,写出各自的滴定反应式,推出计算公式,计算各组分的含量。 ⑴ HCl 标准溶液的标定 1 2 3 mNa2CO3(g) V HCl (mL) c HCl (mol/L) c HCl (mol/L) 相对平均偏差 ⑵ 混合碱的测定(写明组分) 1 2 3 第一终点 V1 (mL) 第二终点 V (mL) V2 (mL) 组分 1 含量 (%) 组分 1 平就含量 (%) 相对平均偏差 (%) 组分 2 含量 (%) 组分 2 平就含量 (%) 相对平均偏差 (%) 五、存在的问题及注意事项 1. 双指示剂法,由于使用了酚酞(由红色至无色)、甲基橙双色指示剂颜色变化不明显,分析 结果的误差较大。可以采用对照的方法提高分析结果的准确度。 2. CO2 的保护与驱除。在接近终点时,必须注意 CO2 的保护与驱除,否则造成终点提前。 六、思考题 1. 双指示剂法测定混合碱的准确度较低,还有什么方法能提高分析结果的准确度? 2. 为什么一般都用强碱氢氧化钠滴定酸?

3.为什么标淮溶液的浓度一般都为0.1moL,而不宜过高或过低? 4.酸碱滴定法中,选择指示剂的依据是什么? 5.干燥的纯NaOH和NHCO,按2:1的质量比混合后溶于水,并用盐酸标准溶液滴定。使用酚 酞为指示剂时用去盐酸的体积为V,继用甲基橙为指示剂,又用去盐酸的体积为V2,求V/V (保留3位有效数字)
3. 为什么标准溶液的浓度一般都为 0.1mol/L,而不宜过高或过低? 4. 酸碱滴定法中,选择指示剂的依据是什么? 5. 干燥的纯 NaOH 和 NaHCO3 按 2:1 的质量比混合后溶于水,并用盐酸标准溶液滴定。使用酚 酞为指示剂时用去盐酸的体积为 V1,继用甲基橙为指示剂,又用去盐酸的体积为 V2,求 V1/ V2。 (保留 3 位有效数字)

胃舒平药片中铝和镁的测定 一、实验目的 1,学习药剂测定的前处理方法: 2.学习用返滴定法测定铝的方法 3.掌握沉淀分离的操作方法: 二、实验原理 1.舒平主要成分为氢氧化铝、三硅酸铝及少量中药颠茄流浸音,在制成片剂时还加了大量糊 精等赋形剂。药片中Al和Mg的含量可用EDTA配位滴定法测定。 2.首先溶解样品,分离除去水不溶物质,然后分取试液加入过量的EDTA溶液,调节pH至4 左右,煮沸使EDTA与N配位完全,再以二甲酚橙为指示剂,用Zn标准溶液返滴过量的EDTA, 测出A1含量。另取试液,调节pH将A1沉淀分离后在pH为I0的条件下以铬黑T作指示剂,用 EDTA标准溶液滴定滤液中的Mg。 三、主要仪器及试剂 仪器:滴定管(50.00mL,容量瓶(250.00mL,移液管(25.00mL锥形瓶(250mL3个):烧杯 (100mL2个): 试剂:EDTA标准溶液(0.02moL):Zm2标准溶液(0.02mol/L)六亚甲基四胺(20%)三乙 醇胺(1:2)氨水(1:1)盐酸(1:1)甲基红指示剂(02%乙醇溶液)铬黑T指示剂()二甲酚 橙指示剂(0.2%)NH3-N4C缓冲溶液(p=10) 四、实验步骤 1.样品处理 称取胃舒平药片10片,研细后从中称出药粉20g左右,加入20.0mLHC1(),加蒸馏水 100.0mL,煮沸,冷却后过滤,并以水洗涤沉淀,收集滤液及洗涤液于250.00mL容量瓶中,稀 释至刻度,摇匀。 2.铝的测定 准确吸取上述试液5.00mL,加水至25.0mL左右,滴加11出0溶液至刚出现浑浊, 再加11HC1溶液至沉淀恰好溶解,准确加入EDTA标准溶液25.00mL,再加入10.0mL六亚甲 基四胺溶液,煮沸10m并冷却后,加入二甲酚橙指示剂2~3滴,以Zn2*标准溶液滴定至溶液 由黄色变为红色,即为终点。根据EDTA加入量与Z2标准溶液滴定体积,计算每片药片中 AI(OH:质量分数
胃舒平药片中铝和镁的测定 一、实验目的 1. 学习药剂测定的前处理方法; 2. 学习用返滴定法测定铝的方法; 3. 掌握沉淀分离的操作方法; 二、实验原理 1. 胃舒平主要成分为氢氧化铝、三硅酸铝及少量中药颠茄流浸膏,在制成片剂时还加了大量糊 精等赋形剂。药片中 Al 和 Mg 的含量可用 EDTA 配位滴定法测定。 2. 首先溶解样品,分离除去水不溶物质,然后分取试液加入过量的 EDTA 溶液,调节 pH 至 4 左右,煮沸使 EDTA 与 Al 配位完全,再以二甲酚橙为指示剂,用 Zn 标准溶液返滴过量的 EDTA, 测出 Al 含量。另取试液,调节 pH 将 Al 沉淀分离后在 pH 为 10 的条件下以铬黑 T 作指示剂,用 EDTA 标准溶液滴定滤液中的 Mg。 三、主要仪器及试剂 仪器:滴定管(50.00mL); 容量瓶(250.00 mL); 移液管(25.00 mL); 锥形瓶(250 mL,3 个);烧杯 (100 mL,2 个); 试剂:EDTA 标准溶液(0.02 mol/L);Zn2+标准溶液(0.02 mol/L)六亚甲基四胺(20%)三乙 醇胺(1:2)氨水(1:1)盐酸(1:1)甲基红指示剂 (0.2%乙醇溶液)铬黑 T 指示剂()二甲酚 橙指示剂(0.2%)NH3-NH4Cl 缓冲溶液(pH=10) 四、实验步骤 1. 样品处理 称取胃舒平药片 10 片,研细后从中称出药粉 2.0 g 左右,加入 20.0 mL HCl (1:1),加蒸馏水 100.0 mL,煮沸,冷却后过滤,并以水洗涤沉淀,收集滤液及洗涤液于 250.00 mL 容量瓶中,稀 释至刻度,摇匀。 2. 铝的测定 准确吸取上述试液 5.00 mL,加水至 25.0 mL 左右,滴加 1:1 NH3·H2O 溶液至刚出现浑浊, 再加 1:1 HCl 溶液至沉淀恰好溶解,准确加入 EDTA 标准溶液 25.00mL,再加入 10.0 mL 六亚甲 基四胺溶液,煮沸 10 min 并冷却后,加入二甲酚橙指示剂 2~3 滴,以 Zn2+标准溶液滴定至溶液 由黄色变为红色,即为终点。根据 EDTA 加入量与 Zn2+标准溶液滴定体积,计算每片药片中 Al(OH)3 质量分数

3.镁的测定 吸取试液25.00mL,滴加11NH出0溶液至刚出现沉淀,再加1:1HC1溶液至沉淀恰好溶 解,加入2.0g固体NHC1,滴加六亚甲基四胺溶液至沉淀出现并过量150mL,加热至80C,维 持10~15mn,冷却后过滤,以少量蒸馏水洗涤沉淀数次,收集滤液与洗涤液于250.0mL锥形 瓶中,加入三乙醇胺溶液1O.0mL、NH-NH4C缓冲溶液1O.0mL及甲基红指示剂1滴,铬黑T 指示剂少许,用EDTA标准溶液滴定至试液由暗红色转变为蓝绿色,即为终点。计算每片药片 中Mg的质量分数(以MgO表示) 数据记录及计算 (①铝的测定 次数 项目 M1(药片)g M2(药粉)g V试液mL 25.00 VZn标始mL VZn标终mL VZn标mL Al(OH)3% A(OH3%平均值 (2)镁的测定 次数 2 项目 M1(药片)g M2(药粉)g V试液mL 5.00 V(EDTA)标mL 25.00 V(EDTA)标始mL V(EDTA)标终mL V(EDTA)标mL
3. 镁的测定 吸取试液 25.00 mL,滴加 1:1 NH3·H2O 溶液至刚出现沉淀,再加 1:1 HCl 溶液至沉淀恰好溶 解,加入 2.0 g 固体 NH4Cl,滴加六亚甲基四胺溶液至沉淀出现并过量 15.0 mL,加热至 80℃,维 持 10~15min,冷却后过滤,以少量蒸馏水洗涤沉淀数次,收集滤液与洗涤液于 250.0 mL 锥形 瓶中,加入三乙醇胺溶液 10.0 mL、NH3-NH4Cl 缓冲溶液 10.0 mL 及甲基红指示剂 1 滴,铬黑 T 指示剂少许,用 EDTA 标准溶液滴定至试液由暗红色转变为蓝绿色,即为终点。计算每片药片 中 Mg 的质量分数(以 MgO 表示) 数据记录及计算 (1) 铝的测定 次数 项目 1 2 3 M1(药片) g M2(药粉) g V 试液 mL 25.00 VZn 标始 mL VZn 标终 mL VZn 标 mL Al(OH)3% Al(OH)3%平均值 (2) 镁的测定 次数 项目 1 2 3 M1 (药片) g M2 (药粉) g V 试液 mL 5.00 V(EDTA)标 mL 25.00 V(EDTA)标始 mL V(EDTA)标终 mL V(EDTA)标 mL

Mg0% MgO%平均值 五、注意事项 1,为使测定结果具有代表性,应取较多样品,研细后再取部分进行分析。 2.测定镁时加入甲基红一滴可使终点更为敏锐。 六、思考愿 1.本实验为什么要称取大样后,再分取部分试液进行滴定? 2.在分离铝后的滤液中测定镁,为什么要加三乙醇胺?
MgO% MgO%平均值 五、注意事项 1. 为使测定结果具有代表性,应取较多样品,研细后再取部分进行分析。 2. 测定镁时加入甲基红一滴可使终点更为敏锐。 六、思考题 1. 本实验为什么要称取大样后,再分取部分试液进行滴定? 2. 在分离铝后的滤液中测定镁,为什么要加三乙醇胺?