
以Fe为原料制备感光液 一、实验目的 1.学习利用盐类在不同温度下溶解度的差别来制备物质的原理和方法: 2.掌握合成NH4hFc(SO4h6HO、KF[(CzO4)]3HO的基本原理和操作 技术: 3.加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解; 4.巩固水浴加热、冷却、结晶、重结晶、洗涤、干燥等基本操作。 二、实验原理 1.NH4hFe(SO4h6HO的制备 以铁屑或铁粉为原料,溶于稀硫酸制得硫酸亚铁溶液,然后加入硫酸 铵制得饱和溶液,经加热浓缩、冷却至室温后可得溶解度较小的硫酸亚 铁铵复盐晶体。 Fe+HSO,→FeSO,+H2↑ FeSO,+(NH)SO,+6HO(NH)Fe(SO,)6H.O 2.KFe[(C2O4)BJ3HO的合成 以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀, 然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化剂,得 到铁(Ⅲ)草酸配合物。主要反应为 (NH)Fe(SO,)+HCO,+2HFeC,O(NH)2 SO,+HSO 2FeCO.2HO+H2O+3KCO.+HCO2K[Fe(C:O.)s].3H2O 改变溶剂极性并加少量盐析剂,可析出绿色单斜晶体纯的三草酸合铁
以Fe为原料制备感光液 一、实验目的 1. 学习利用盐类在不同温度下溶解度的差别来制备物质的原理和方法; 2. 掌握合成(NH4)2Fe(SO4)2·6H2O、K3Fe[(C2O4)3]·3H2O的基本原理和操作 技术; 3. 加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解; 4. 巩固水浴加热、冷却、结晶、重结晶、洗涤、干燥等基本操作。 二、实验原理 1. (NH4)2Fe(SO4)2·6H2O的制备 以铁屑或铁粉为原料,溶于稀硫酸制得硫酸亚铁溶液,然后加入硫酸 铵制得饱和溶液,经加热浓缩、冷却至室温后可得溶解度较小的硫酸亚 铁铵复盐晶体。 Fe + H2SO4 → FeSO4 + H2 FeSO4 + (NH4 ) 2 SO4 + 6H2O →(NH4 ) 2Fe(SO4 ) 2 •6H2O 2. K3Fe[(C2O4)3]·3H2O的合成 以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀, 然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化剂,得 到铁(Ⅲ)草酸配合物。主要反应为 4 2 4 2 2 2 4 2 2 4 2 4 2 4 2 4 (NH ) Fe(SO ) + H C O + 2H O → FeC O • 2H O +(NH ) SO + H SO 2FeC2O4 • 2H2O + H2O2 + 3K2C2O4 + H2C2O4 → 2K3 [Fe(C2O4 ) 3 ]•3H2O 改变溶剂极性并加少量盐析剂,可析出绿色单斜晶体纯的三草酸合铁
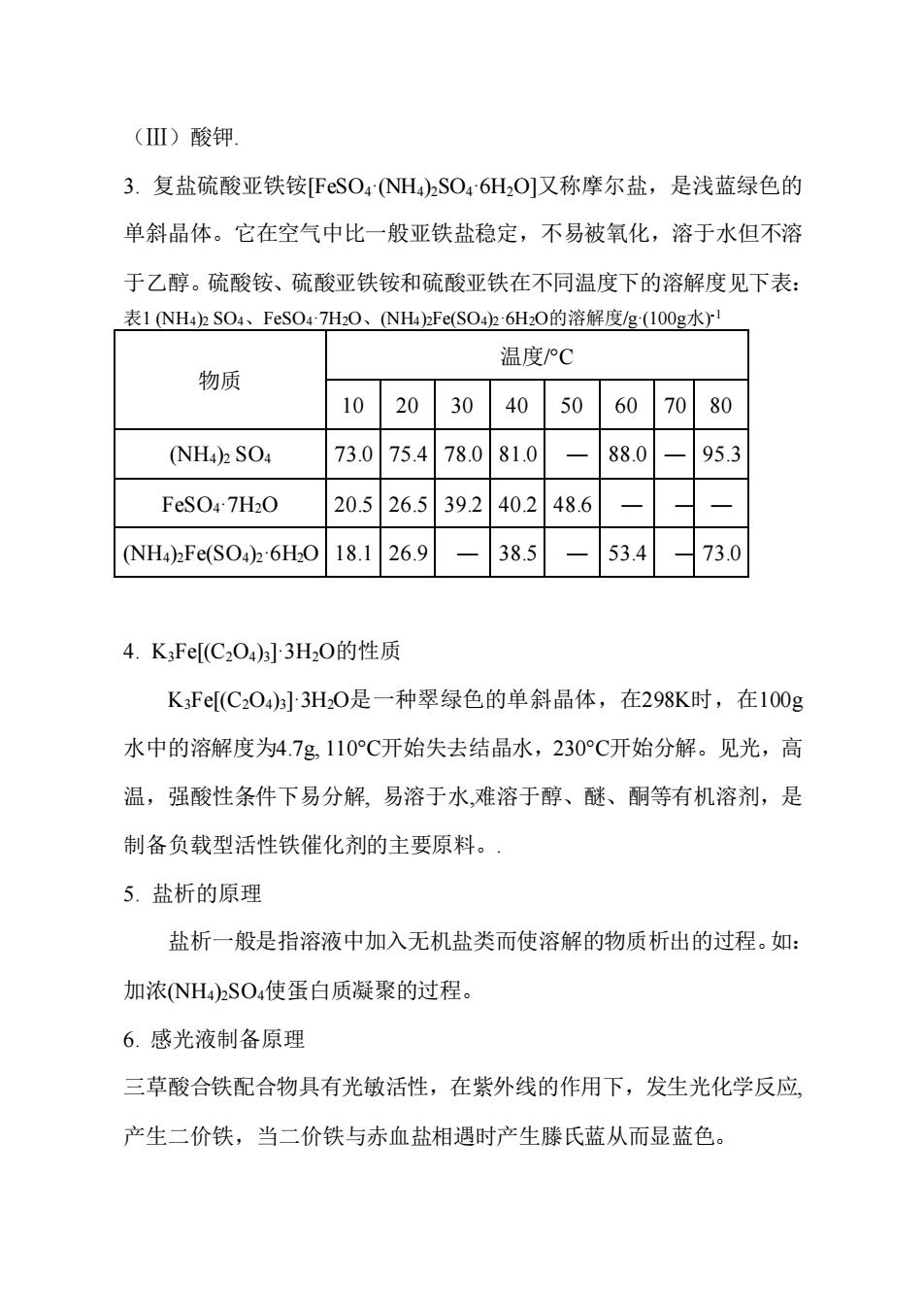
()酸钾 3.复盐硫酸亚铁铵[FSO4NH)2SO46HO]又称摩尔盐,是浅蓝绿色的 单斜晶体。它在空气中比一般亚铁盐稳定,不易被氧化,溶于水但不溶 于乙醇。硫酸铵、硫酸亚铁铵和硫酸亚铁在不同温度下的溶解度见下表: 表1NH42SO4、FeSO47HO、NH42Fe(SO42-6H20的溶解度g100g水1 温度/°C 物质 10 20 3040 5060 7080 (NH4)2 SO4 73.075.478.081.0 88.0 95.3 FeSO47H2O 20.526.539240.248.6 (NH4)Fe(SO4)2-6H:O18.126.9 -38.5 53.4 73.0 4.K3Fe[(C2O4)]3H20的性质 KF[(C204)3]3H0是一种翠绿色的单斜晶体,在298K时,在100g 水中的溶解度为4.7g,110℃开始失去结晶水,230°℃开始分解。见光,高 温,强酸性条件下易分解,易溶于水,难溶于醇、醚、酮等有机溶剂,是 制备负载型活性铁催化剂的主要原料。· 5.盐析的原理 盐析一般是指溶液中加入无机盐类而使溶解的物质析出的过程。如: 加浓NH)2SO4使蛋白质凝聚的过程。 6.感光液制备原理 三草酸合铁配合物具有光敏活性,在紫外线的作用下,发生光化学反应, 产生二价铁,当二价铁与赤血盐相遇时产生滕氏蓝从而显蓝色
(Ⅲ)酸钾. 3. 复盐硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]又称摩尔盐,是浅蓝绿色的 单斜晶体。它在空气中比一般亚铁盐稳定,不易被氧化,溶于水但不溶 于乙醇。硫酸铵、硫酸亚铁铵和硫酸亚铁在不同温度下的溶解度见下表: 表1 (NH4)2 SO4、FeSO4·7H2O、(NH4)2Fe(SO4)2·6H2O的溶解度/g·(100g水) -1 物质 温度/°C 10 20 30 40 50 60 70 80 (NH4)2 SO4 73.0 75.4 78.0 81.0 ― 88.0 ― 95.3 FeSO4·7H2O 20.5 26.5 39.2 40.2 48.6 ― ― ― (NH4)2Fe(SO4)2·6H2O 18.1 26.9 ― 38.5 ― 53.4 ― 73.0 4. K3Fe[(C2O4)3]·3H2O的性质 K3Fe[(C2O4)3]·3H2O是一种翠绿色的单斜晶体,在298K时,在100g 水中的溶解度为4.7g, 110°C开始失去结晶水,230°C开始分解。见光,高 温,强酸性条件下易分解, 易溶于水,难溶于醇、醚、酮等有机溶剂,是 制备负载型活性铁催化剂的主要原料。. 5. 盐析的原理 盐析一般是指溶液中加入无机盐类而使溶解的物质析出的过程。如: 加浓(NH4)2SO4使蛋白质凝聚的过程。 6. 感光液制备原理 三草酸合铁配合物具有光敏活性,在紫外线的作用下,发生光化学反应, 产生二价铁,当二价铁与赤血盐相遇时产生滕氏蓝从而显蓝色

2Fe(C,0)r→2FC(C,0)'→2FeC,0,+2C0,+3C,0,2 K,[Fe(CNs]+FeC,O,→KFeFet(CW)s]滕氏蓝)+K,C,O 三、实验仪器与试剂 仪器:托盘天平,抽滤装置(水泵,布氏漏斗,吸滤瓶),烧杯(250mL,100 mL,100mL),水浴锅,表面皿,煤油温度计(0-100℃ 试剂:NH)bFe(S0h6H0,HS04(1.0molL),HCz04(饱和),K,C04 (饱和),KNO300.0gL'),乙醇(95%),KF(CN)(5%)每实验 室准备一瓶),H202(3%)。 四、实验步骤 1.硫酸亚铁铵的制备 称取3.0g铁粉,放在锥形瓶中,加入20.0mL3.0moL1HS04置于水浴 中加热反应,反应装置应靠近通风口(为什么会产生臭鸡蛋气味?)。 反应过程中,适当补充被蒸发掉的水分(尽可能维持原有液面刻度水平, 加热不要过猛,控制反应温度在70-80°℃),当反应基本完全时,趁热过 滤。滤液转移至小烧杯或蒸发皿中。观察滤纸上残渣的颜色、状态。烘 干称量。 根据差量法大致估算反应掉的铁粉量,量取配置好的饱和硫酸铵溶液 在蒸发皿中搅拌均匀后水浴浓缩。蒸发浓缩值液面出现晶膜为止(浓缩 开始时可适当搅拌,后期不宜搅拌)。取出蒸发皿静置,冷却后减压抽 滤。用少量的乙醇洗涤晶体两次。取出干燥称量。 2.草酸亚铁的制备 称取5.0g硫酸亚铁铵固体放在250mL烧杯中,然后加15.0mL蒸馏水和
− − − ⎯⎯→ ⎯→ + + 2 2 4 2 2 4 3 * 2 4 3 3 2[Fe(C2O4 ) 3 ] 2[Fe(C O ) ] 2FeC O 2CO 3C O h 3 6 2 4 6 K2 2 4 K [Fe(CN) ]+ FeC O ⎯→ KFe[Fe(CN) ](滕氏蓝)+ C O 三、实验仪器与试剂 仪器: 托盘天平,抽滤装置(水泵,布氏漏斗,吸滤瓶),烧杯(250 mL, 100 mL, 100 mL),水浴锅,表面皿, 煤油温度计(0-100℃) 试剂: (NH4)2Fe(SO4)2·6H2O,H2SO4(1.0 mol·L-1 ),H2C2O4(饱和),K2C2O4 (饱和),KNO3(300.0g·L-1 ),乙醇(95%),K3[Fe(CN)6] (5%) 每实验 室准备一瓶),H2O2 (3%)。 四、实验步骤 1.硫酸亚铁铵的制备 称取3.0 g铁粉,放在锥形瓶中,加入20.0 mL 3.0 mol·L-1 H2SO4,置于水浴 中加热反应,反应装置应靠近通风口(为什么会产生臭鸡蛋气味?)。 反应过程中,适当补充被蒸发掉的水分(尽可能维持原有液面刻度水平, 加热不要过猛,控制反应温度在70-80°C),当反应基本完全时,趁热过 滤。滤液转移至小烧杯或蒸发皿中。观察滤纸上残渣的颜色、状态。烘 干称量。 根据差量法大致估算反应掉的铁粉量,量取配置好的饱和硫酸铵溶液 在蒸发皿中搅拌均匀后水浴浓缩。蒸发浓缩值液面出现晶膜为止(浓缩 开始时可适当搅拌,后期不宜搅拌)。取出蒸发皿静置,冷却后减压抽 滤。用少量的乙醇洗涤晶体两次。取出干燥称量。 2. 草酸亚铁的制备 称取5.0 g硫酸亚铁铵固体放在250 mL烧杯中,然后加15.0 mL蒸馏水和

5-6滴1.0moLH2S04,加热溶解后,再加入25.0mL饱和草酸溶液,加 热搅拌至沸,然后迅速搅拌片刻,防止飞溅。停止加热,静置。待黄色 晶体FC2042H2O沉淀后倾析,弃去上层清液,加入20mL蒸馏水洗涤晶 体,搅拌并温热,静置,弃去上层清液,即得黄色晶体草酸亚铁。 3.三草酸合铁(Ⅲ)酸钾的制备 往草酸亚铁沉淀中,加入饱和KC2O4溶液10.0mL,水浴加热313.0K,恒 温下慢慢滴加3%的HO2溶液20.0mL,沉淀转为深棕色。边加边搅拌, 加完后将溶液加热至沸,然后趁热逐滴加入20.0L饱和草酸溶液,沉淀 立即溶解,溶液转为绿色。趁热抽滤,滤液转入100mL烧杯中,加入95% 的乙醇25.0mL,混匀后冷却,可以看到烧杯底部有晶体析出。为了加快 结晶速度,可往其中滴加几滴KNO溶液。晶体完全析出后,抽滤,用乙 醇10.0L分多次淋洒滤饼,抽干混合液。固体产品置于一表面皿上,置 暗处晾干。称重,计算产率。 4.感光液的制备 将0.5g三草酸合铁()酸钾溶于5ml蒸馏水中,滴加5滴K4Fe(CN)] (5%),搅拌均匀后,玻璃棒蘸取溶液在纸面上写字,在日光下观察。 五、实验思考 1.能否直接用三价铁制备三草酸合铁()酸钾,如FeCl,等? 2.为什么在滴加H02过程中需要控制温度? 3.滴加KNO3溶液起到什么作用? 4.最后能否在析晶之前适当浓缩溶液? 5.什么叫复盐?它与配合物有何区别?
5~6滴1.0 mol·L-1 H2SO4,加热溶解后,再加入25.0 mL饱和草酸溶液,加 热搅拌至沸,然后迅速搅拌片刻,防止飞溅。停止加热,静置。待黄色 晶体FeC2O4·2H2O沉淀后倾析,弃去上层清液,加入20 mL蒸馏水洗涤晶 体,搅拌并温热,静置,弃去上层清液,即得黄色晶体草酸亚铁。 3. 三草酸合铁(Ⅲ)酸钾的制备 往草酸亚铁沉淀中,加入饱和K2C2O4溶液10.0 mL,水浴加热313.0K,恒 温下慢慢滴加3%的H2O2溶液20.0 mL,沉淀转为深棕色。边加边搅拌, 加完后将溶液加热至沸,然后趁热逐滴加入20.0 mL饱和草酸溶液,沉淀 立即溶解,溶液转为绿色。趁热抽滤,滤液转入100 mL烧杯中,加入95% 的乙醇25.0 mL,混匀后冷却,可以看到烧杯底部有晶体析出。为了加快 结晶速度,可往其中滴加几滴KNO3溶液。晶体完全析出后,抽滤,用乙 醇10.0 mL分多次淋洒滤饼,抽干混合液。固体产品置于一表面皿上,置 暗处晾干。称重,计算产率。 4. 感光液的制备 将0.5g 三草酸合铁(Ⅲ)酸钾溶于5 ml蒸馏水中,滴加5滴K4[Fe(CN)6] (5%),搅拌均匀后,玻璃棒蘸取溶液在纸面上写字,在日光下观察。 五、实验思考 1. 能否直接用三价铁制备三草酸合铁(Ⅲ)酸钾,如FeCl3等? 2. 为什么在滴加H2O2 过程中需要控制温度? 3. 滴加KNO3溶液起到什么作用? 4. 最后能否在析晶之前适当浓缩溶液? 5. 什么叫复盐?它与配合物有何区别?

6.实验中为什么保持硫酸亚铁、硫酸亚铁铵溶液呈较强的酸性? 六、实验报告要求 1.两次实验合写一份报告,题目为“以铁为原料制备感光液”。写一份完 整的综合实验报告,格式要求完整!! 名称:(放中间) 实验目的: 实验原理:(自己归纳总结,要条理,说出实验操作用到的原理) 实验仪器:(试剂纯度、浓度:仪器规格型号要完整) 实验步骤:(步骤完整,自己真实的实验过程,量具要读数,过程状态) 实验现象解释 实验数据分析 误差分析: 实验方案的改进: 实验结论: 2.解释实验中出现的各种现象。 3.计算各部分中间产品及最终产品产率,高还是低? 4.分析实验过程中的关键操作的实际情况对最终结果的影响,产生误差 的正负:分析要有理有据,不放空炮。 5.实验方案可有改进的地方? 6.最后一次报告总分值占总报告成绩的25%
6. 实验中为什么保持硫酸亚铁、硫酸亚铁铵溶液呈较强的酸性? 六、实验报告要求 1. 两次实验合写一份报告,题目为“以铁为原料制备感光液”。写一份完 整的综合实验报告,格式要求完整!! 名称:(放中间) 实验目的: 实验原理:(自己归纳总结, 要条理, 说出实验操作用到的原理) 实验仪器: (试剂纯度、浓度; 仪器规格型号要完整) 实验步骤:(步骤完整,自己真实的实验过程,量具要读数,过程状态) 实验现象解释: 实验数据分析: 误差分析: 实验方案的改进: 实验结论: 2. 解释实验中出现的各种现象。 3. 计算各部分中间产品及最终产品产率,高还是低? 4. 分析实验过程中的关键操作的实际情况对最终结果的影响, 产生误差 的正负;分析要有理有据,不放空炮。 5. 实验方案可有改进的地方? 6. 最后一次报告总分值占总报告成绩的25%

混合碱分析与测定 一、实验目的 利用双指示剂法分析和测定混合碱的组成和含量的基本原理和方法 二、基本原理 混合碱系是指Na2CO3、NaOH、NaHCO3的各自混合物及类似的混 合物。但不存在NaOH和NaHCO3的混合物,为什么? 0.1mol/L的NaOH、Na2CO3、NaHCO3溶液的pH分别为:13.0、11.6、 8.3,用0.1mo/LHCl分别滴定0.1mol/L NaOH、Na2CO3、NaHCO3溶液 时,如果以酚酞为指示剂,酚酞的变色范围为8~10,因此,NaOH、Na2CO 可以被滴定,NaOH转化为NaCl,NazCO3转化为NaHCO3,为第一终点: 而NaHCO3不被滴定,当以甲基橙(3.1~4.3)为指示剂时,NaHCO3被 滴定转化为NaCl为第二终点。 分析: Nao NazCO: NaHCO: HCI 消 耗 HC 第一终NaCL NaHCOz 体积V HCI 消耗 HCI的 体积 第二终点 NaCl NaCl 从上述分析可见,通过滴定不仅能够完成定量分析,还可以完成定 性分析
混合碱分析与测定 一、实验目的 利用双指示剂法分析和测定混合碱的组成和含量的基本原理和方法 二、基本原理 混合碱系是指 Na2CO3、NaOH、NaHCO3的各自混合物及类似的混 合物。但不存在 NaOH 和 NaHCO3 的混合物,为什么? 0.1mol/L 的 NaOH、Na2CO3、NaHCO3溶液的 pH 分别为:13.0、11.6、 8.3,用 0.1mol/L HCl 分别滴定 0.1mol/L NaOH、Na2CO3、NaHCO3溶液 时,如果以酚酞为指示剂,酚酞的变色范围为 8~10,因此,NaOH、Na2CO3 可以被滴定,NaOH 转化为 NaCl,Na2CO3转化为 NaHCO3,为第一终点; 而 NaHCO3 不被滴定,当以甲基橙(3.1~4.3)为指示剂时,NaHCO3 被 滴定转化为 NaCl 为第二终点。 分析: 从上述分析可见,通过滴定不仅能够完成定量分析,还可以完成定 性分析。 NaO Na2CO3 H NaHCO3 HCl 消 耗 HCl 的 第一终点 体积 V1 NaCl NaHCO3 NaCl NaCl HCl 第二终点 消 耗 HCl 的 体积 V2

因为Na2CO,转化生成NaHCO3以及NaHCO3转化为NaCI消耗HCl 的量是相等的,所以,由V1和V2的大小可以判断混合碱的组成。 当V1>V2时,说明是NaOH和Na2CO3组成混合碱,当V12): NaOH % c(y-r21000x10% MSoon m Na,C0,%= 阳g含高w m b.NaCO3和NaHCO组成混合碱(V1<V2): Mxa.co Na2C03%=- 2r010% Mxaco NaHCO %= c(y:-VK1000 ×100% m 当V1=0,V20:V0,V2=0:V1=V20时,又如何?(思考) 三、实验内容 1.HC1标准溶液的标定 准确称量0.10.12g无水Na2C03三份,分别于250mL锥形瓶中,加 入25mLH0溶解,2~3滴甲基橙,用HC标准溶液滴定至终点。 注意:终点时生成的是HC0,饱和溶液,pH为3.9,为了防止终点提前,必须尽可能驱除 CO2,接近终点时要则烈振荡溶液,或者加热。 2.混合碱分析 称量,称取一定量的混合碱于小烧杯中,加入少许水溶解,定量转
因为 Na2CO3转化生成 NaHCO3以及 NaHCO3转化为 NaCl 消耗 HCl 的量是相等的,所以,由 V1和 V2的大小可以判断混合碱的组成。 当 V1>V2时,说明是 NaOH 和 Na2CO3组成混合碱,当 V1<V2时, 说明是 Na2CO3和 NaHCO3组成混合碱。 计算公式: a.NaOH 和 Na2CO3组成混合碱(V1>V2): b.Na2CO3和 NaHCO3组成混合碱(V1<V2): 当 V1=0,V2≠0;V1≠0,V2=0;V1=V2≠0 时,又如何?(思考) 三、实验内容 1.HCl 标准溶液的标定 准确称量 0.1~0.12g 无水 Na2CO3三份,分别于 250mL 锥形瓶中,加 入 25mL H2O 溶解,2~3 滴甲基橙,用 HCl 标准溶液滴定至终点。 注意:终点时生成的是 H2CO3 饱和溶液,pH 为 3.9,为了防止终点提前,必须尽可能驱除 CO2,接近终点时要剧烈振荡溶液,或者加热。 2.混合碱分析 称量,称取一定量的混合碱于小烧杯中,加入少许水溶解,定量转 NaOH % = c (V1-V2)× MNaOH 1000 m ×100% Na 2CO 3% = c×2 V2× 1 2 × MNa 2CO 3 1000 m ×100% Na 2CO 3% = c×2 V1× 1 2 × MNa 2CO 3 1000 m ×100% NaHCO 3% = c (V2-V1)× MNaHCO 3 1000 m ×100%
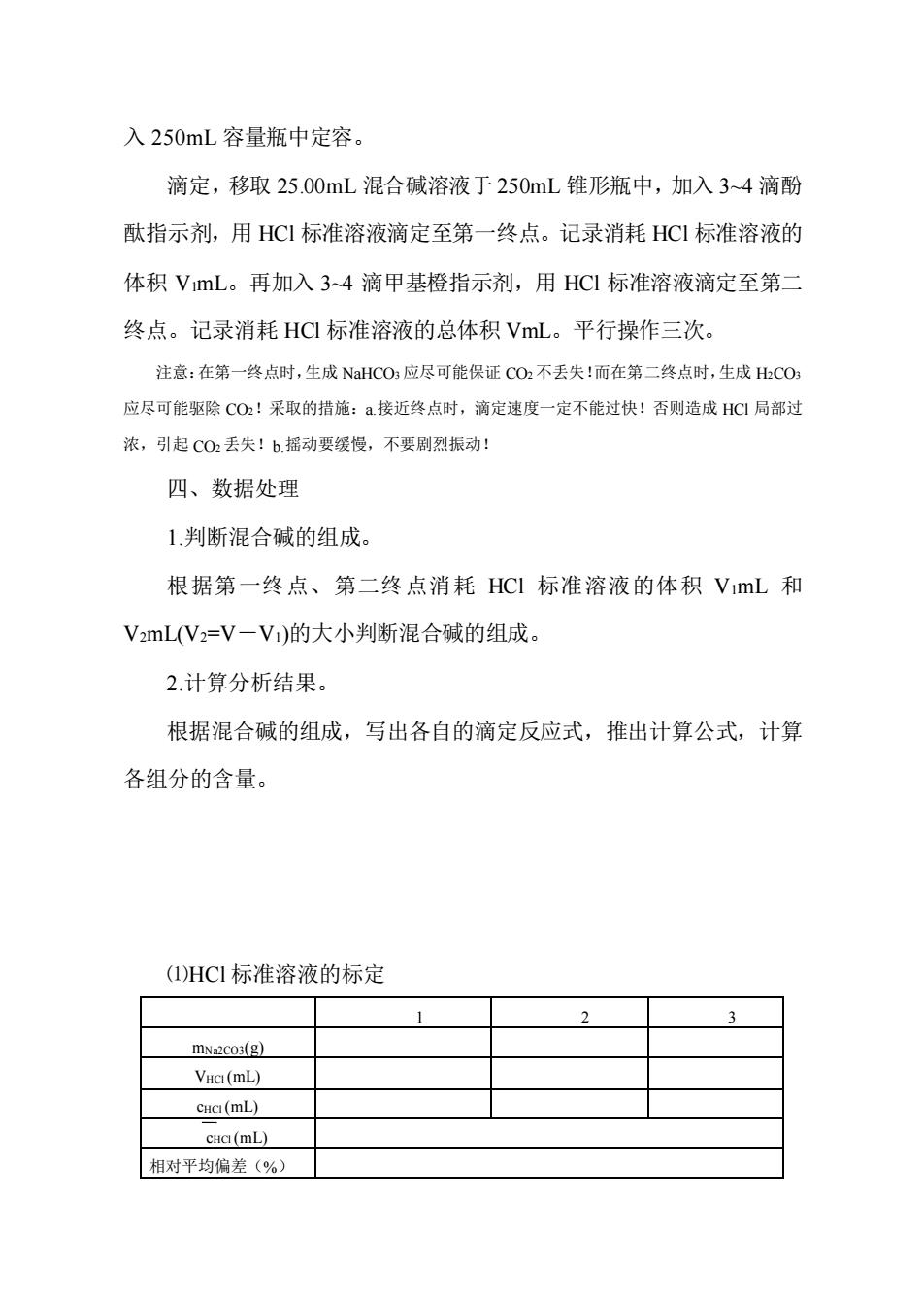
入250mL容量瓶中定容。 滴定,移取25.00mL混合碱溶液于250mL锥形瓶中,加入3~4滴酚 酞指示剂,用HC1标准溶液滴定至第一终点。记录消耗HC标准溶液的 体积VmL。再加入34滴甲基橙指示剂,用HC1标准溶液滴定至第二 终点。记录消耗HCI标准溶液的总体积VmL。平行操作三次。 注意:在第一终点时,生成NHCO3应尽可能保证CO2不丢失!而在第二终点时,生成HCO 应尽可能驱除CO!采取的措施:a接近终点时,滴定速度一定不能过快!否则造成HC1局部过 浓,引起C02丢失!b摇动要缓慢,不要剧烈振动: 四、数据处理 1.判断混合碱的组成 根据第一终点、第二终点消耗HC1标准溶液的体积VmL和 V2mL(V2=V一V)的大小判断混合碱的组成。 2.计算分析结果。 根据混合碱的组成,写出各自的滴定反应式,推出计算公式,计算 各组分的含量。 (I)HC标准溶液的标定 mNaco3(g) VHcI(mL) cuc(mL) cHa(mL) 相对平均偏差(%)
入 250mL 容量瓶中定容。 滴定,移取 25.00mL 混合碱溶液于 250mL 锥形瓶中,加入 3~4 滴酚 酞指示剂,用 HCl 标准溶液滴定至第一终点。记录消耗 HCl 标准溶液的 体积 V1mL。再加入 3~4 滴甲基橙指示剂,用 HCl 标准溶液滴定至第二 终点。记录消耗 HCl 标准溶液的总体积 VmL。平行操作三次。 注意:在第一终点时,生成 NaHCO3 应尽可能保证 CO2 不丢失!而在第二终点时,生成 H2CO3 应尽可能驱除 CO2!采取的措施:a.接近终点时,滴定速度一定不能过快!否则造成 HCl 局部过 浓,引起 CO2 丢失!b.摇动要缓慢,不要剧烈振动! 四、数据处理 1.判断混合碱的组成。 根据第一终点、第二终点消耗 HCl 标准溶液的体积 V1mL 和 V2mL(V2=V-V1)的大小判断混合碱的组成。 2.计算分析结果。 根据混合碱的组成,写出各自的滴定反应式,推出计算公式,计算 各组分的含量。 ⑴HCl 标准溶液的标定 1 2 3 mNa2CO3(g) VHCl (mL) cHCl (mL) cHCl (mL) 相对平均偏差(%)
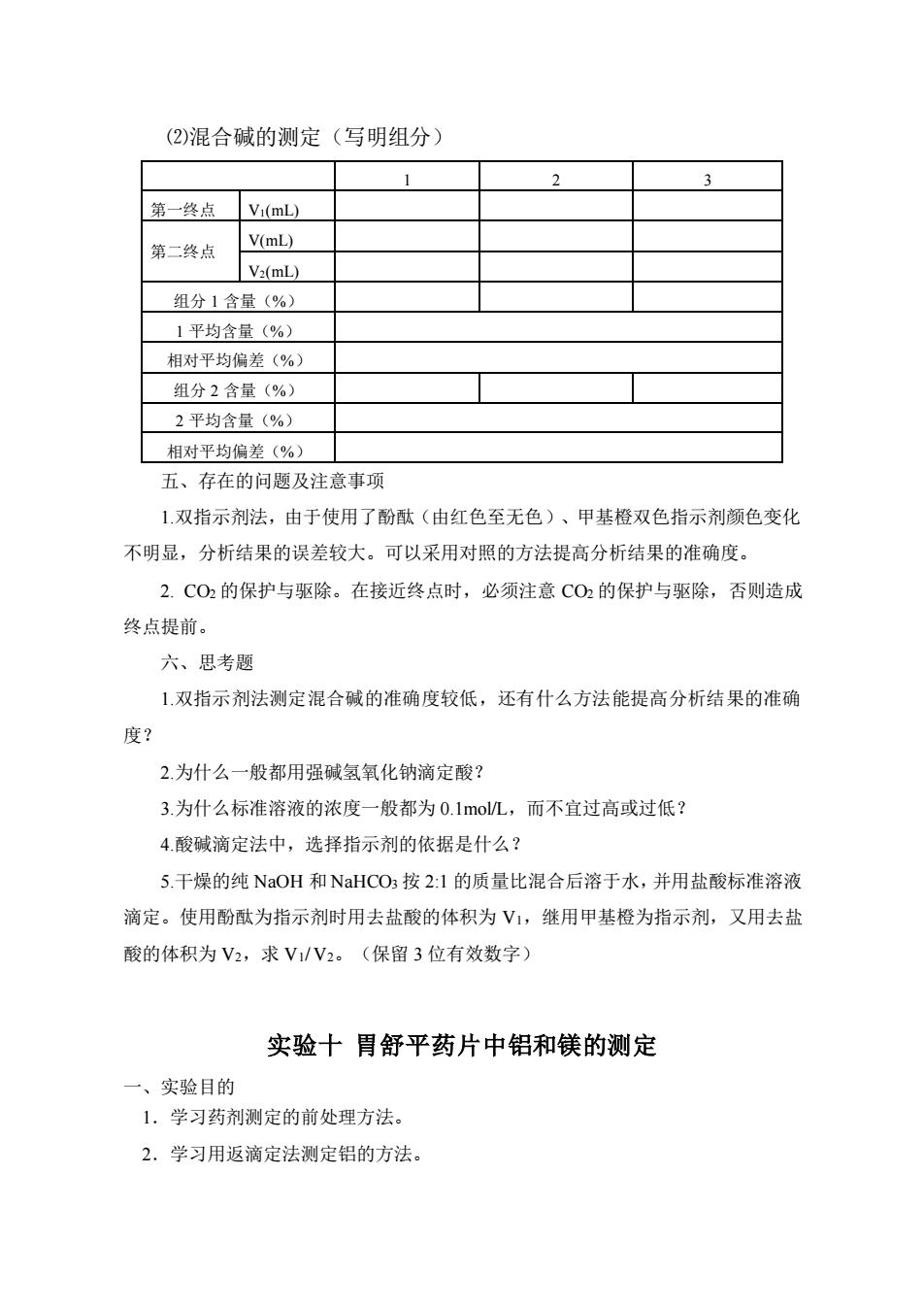
(2)混合碱的测定(写明组分) 1 第一终点☐V(mL) 第二终点 V(mL) V2(mL) 组分1含量(%) 1平均含量(%) 相对平均偏差(%) 组分2含量(%) 2平均含量(%) 相对平均偏差(%) 五、存在的问题及注意事项 1双指示剂法,由于使用了酚酞(由红色至无色)、甲基橙双色指示剂颜色变化 不明显,分析结果的误差较大。可以采用对照的方法提高分析结果的准确度。 2.C02的保护与驱除。在接近终点时,必须注意CO2的保护与驱除,否则造成 终点提前。 六、思考题 1双指示剂法测定混合碱的准确度较低,还有什么方法能提高分析结果的准确 度? 2为什么一般都用强碱氢氧化钠滴定酸? 3.为什么标准溶液的浓度一般都为0.1moL,而不宜过高或过低? 4酸碱滴定法中,选择指示剂的依据是什么? 5.干燥的纯NaOH和NaHCO:按2:1的质量比混合后溶于水,并用盐酸标准溶液 滴定。使用酚酞为指示剂时用去盐酸的体积为V1,继用甲基橙为指示剂,又用去盐 酸的体积为V2,求V1/V2。(保留3位有效数字) 实验十胃舒平药片中铝和镁的测定 一、实验目的 1.学习药剂测定的前处理方法。 2,学习用返滴定法测定铝的方法
⑵混合碱的测定(写明组分) 1 2 3 第一终点 V1(mL) 第二终点 V(mL) V2(mL) 组分 1 含量(%) 1 平均含量(%) 相对平均偏差(%) 组分 2 含量(%) 2 平均含量(%) 相对平均偏差(%) 五、存在的问题及注意事项 1.双指示剂法,由于使用了酚酞(由红色至无色)、甲基橙双色指示剂颜色变化 不明显,分析结果的误差较大。可以采用对照的方法提高分析结果的准确度。 2. CO2 的保护与驱除。在接近终点时,必须注意 CO2 的保护与驱除,否则造成 终点提前。 六、思考题 1.双指示剂法测定混合碱的准确度较低,还有什么方法能提高分析结果的准确 度? 2.为什么一般都用强碱氢氧化钠滴定酸? 3.为什么标准溶液的浓度一般都为 0.1mol/L,而不宜过高或过低? 4.酸碱滴定法中,选择指示剂的依据是什么? 5.干燥的纯 NaOH 和 NaHCO3 按 2:1 的质量比混合后溶于水,并用盐酸标准溶液 滴定。使用酚酞为指示剂时用去盐酸的体积为 V1,继用甲基橙为指示剂,又用去盐 酸的体积为 V2,求 V1/ V2。(保留 3 位有效数字) 实验十 胃舒平药片中铝和镁的测定 一、实验目的 1.学习药剂测定的前处理方法。 2.学习用返滴定法测定铝的方法

3.掌握沉淀分离的操作方法 二、实验原理 胃舒平主要成分为氢氧化铝、三硅酸铝及少量中药颠茄流浸膏,在制成片 剂时还加了大量糊精等赋形剂。药片中AI和Mg的含量可用EDTA配位滴定 法测定。 首先溶解样品,分离除去水不溶物质,然后分取试液加入过量的EDTA溶 液,调节pH至4左右,煮沸使EDTA与A1配位完全,再以二甲酚橙为指示 剂,用Z标准溶液返滴过量的EDTA,测出AI含量。另取试液,调节pH将 AI沉淀分离后在pH为I0的条件下以铬黑T作指示剂,用EDTA标准溶液滴 定滤液中的Mg: 三、主要仪器及试剂 1.滴定管 2.容量瓶 3.移液管等 4.EDTA标准溶液0.02molM 5.Zm2+标准溶液0.02molM 6.六亚甲基四胺20% 7.三乙醇胺 12 8.氨水 11 9.盐酸 11 10.甲基红指示剂0.2%乙醇溶液 11.铬黑T指示剂 12.二甲酚橙指示剂0.2% 13.NH3-NH4CI缓冲溶液pH=10 四、实验步骤 1.样品处理 称取胃舒平药片10片,研细后从中称出药粉2g左右,加入 20mLHC1(1:1),加蒸馏水100mL,煮沸,冷却后过滤,并以水洗涤沉淀,收 集滤液及洗涤液于250mL容量瓶中,稀释至刻度,摇匀
3.掌握沉淀分离的操作方法。 二、实验原理 胃舒平主要成分为氢氧化铝、三硅酸铝及少量中药颠茄流浸膏,在制成片 剂时还加了大量糊精等赋形剂。药片中 Al 和 Mg 的含量可用 EDTA 配位滴定 法测定。 首先溶解样品,分离除去水不溶物质,然后分取试液加入过量的 EDTA 溶 液,调节 pH 至 4 左右,煮沸使 EDTA 与 Al 配位完全,再以二甲酚橙为指示 剂,用 Zn 标准溶液返滴过量的 EDTA,测出 Al 含量。另取试液,调节 pH 将 Al 沉淀分离后在 pH 为 10 的条件下以铬黑 T 作指示剂,用 EDTA 标准溶液滴 定滤液中的 Mg。 三、主要仪器及试剂 1.滴定管 2.容量瓶 3.移液管等 4.EDTA 标准溶液 0.02mol/L 5.Zn2+标准溶液 0.02mol/L 6.六亚甲基四胺 20% 7.三乙醇胺 1:2 8.氨水 1:1 9.盐酸 1:1 10.甲基红指示剂 0.2%乙醇溶液 11.铬黑 T 指示剂 12.二甲酚橙指示剂 0.2% 13.NH3-NH4Cl 缓冲溶液 pH=10 四、实验步骤 1.样品处理 称取胃舒平药片 10 片 ,研细后从中称 出药粉 2g 左右, 加入 20mLHCl(1:1),加蒸馏水 100mL,煮沸,冷却后过滤,并以水洗涤沉淀,收 集滤液及洗涤液于 250mL 容量瓶中,稀释至刻度,摇匀